解题方法
1 . 1—20号元素中的A、B、C、D、E五种元素,它们的原子序数按E、C、D、A、B依次增大,E原子最外层有4个电子;A-与B+的核外电子排布相同;D的气态氢化物的化学式为H2D,最高价氧化物中D的质量分数为40%,且D原子核内质子数和中子数相等;C的原子序数比D少9,比B少12。
(1)写元素符号:A_____ ,B_____ ,C_______ ,D_______ ,E_______ 。
(2)画出A-、B+的结构示意图:_______ ,_______ 。
(3)D最高价氧化物对应的水化物化学式为____ ,C的气态氢化物的化学式为______ 。
(4)D、C最高价氧化物对应的水化物相互反应的离子方程式:_______ 。
(1)写元素符号:A
(2)画出A-、B+的结构示意图:
(3)D最高价氧化物对应的水化物化学式为
(4)D、C最高价氧化物对应的水化物相互反应的离子方程式:
您最近一年使用:0次
解题方法
2 . 前四周期主族元素X、Y、Z、W的原子序数依次增大,X是地壳中含量最多的元素,Y原子最外层只有1个电子,基态Z原子的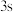 和
和 轨道上电子数相同,Y与W同主族。下列说法错误的是。
轨道上电子数相同,Y与W同主族。下列说法错误的是。
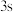 和
和 轨道上电子数相同,Y与W同主族。下列说法错误的是。
轨道上电子数相同,Y与W同主族。下列说法错误的是。A.原子半径: |
| B.X的第一电离能比同周期相邻元素的小 |
| C.Y的最高价氧化物对应水化物的碱性比W的强 |
| D.Z单质形成的晶体属于共价晶体 |
您最近一年使用:0次
2023-12-01更新
|
741次组卷
|
3卷引用:2024届河南省新乡市高三第一次模拟考试理科综合试题
2024届河南省新乡市高三第一次模拟考试理科综合试题辽宁省部分学校2023-2024学年高三上学期12月考试化学试题(已下线)专题04 物质结构与性质 元素推断-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
名校
3 . 黄铜矿有关转化关系如图所示。

回答下列问题:
(1)尾气SO2可以制备一种二元强酸,它是____ (填化学式,下同);也可以制备一种具有还原性的钠盐(正盐),该盐是____ 。
(2)在实验室完成操作X,宜选择的仪器有____ (填标号)。

(3)Cu2S与O2在高温下反应的化学方程式为____ 。
(4)在上述转化中,能证明氯的非金属性比硫强的化学方程式为____ 。
(5)某黄铜矿(主要成分是CuFeS2,含少量SiO2)中S元素的质量分数为32%。现有100kg该黄铜矿,按上述流程转化,理论上最多可制得Fe2O3____ kg。

回答下列问题:
(1)尾气SO2可以制备一种二元强酸,它是
(2)在实验室完成操作X,宜选择的仪器有

(3)Cu2S与O2在高温下反应的化学方程式为
(4)在上述转化中,能证明氯的非金属性比硫强的化学方程式为
(5)某黄铜矿(主要成分是CuFeS2,含少量SiO2)中S元素的质量分数为32%。现有100kg该黄铜矿,按上述流程转化,理论上最多可制得Fe2O3
您最近一年使用:0次
4 . 短周期主族元素X、Y、Z、W原子序数依次增大;X是地壳中含量最多的元素;Y原子最外层只有一个电子;Z位于元素周期表ⅣA族;W与X属于同一主族。下列说法正确的是
| A.原子半径:W>Z>Y |
| B.由X、Y组成的化合物中均不含共价键 |
| C.Z的单质可用于生产光导纤维 |
| D.X最简单气态氢化物的热稳定性比W的气态氢化物的热稳定性强 |
您最近一年使用:0次
名校
5 . R、X、Y、Z是原子序数依次增大的短周期元素,a、b、c、d分别是这4种元素的单质。已知:Y是地壳中含量最高的金属元素。向甲的溶液中通入丙气体,产生白色沉淀,它们之间的转化关系如图所示。下列说法正确的是
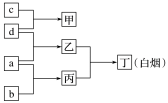

| A.元素对应的简单离子的半径:Y>Z>X |
| B.元素非金属性:Z>R>X |
| C.Y的最高价氧化物对应的水化物是强碱 |
| D.元素最高化合价:Z>X>Y>R |
您最近一年使用:0次
2024-04-08更新
|
77次组卷
|
2卷引用:河南省实验中学2023-2024学年高一下学期月考化学试卷
名校
6 . A、B、C、D、E、F、G为短周期元素,原子序数依次增大。A、B两元素最高正价和最低负价代数和为零;D是地壳中含量最高的非金属元素;E和A同主族,G与D同主族;E、F、G的最高价氧化物的水化物两两之间可以反应。
(1)G元素的名称是__________ ,其在周期表中的位置是_____________ ,其离子结构示意图为_____________ 。
(2) 的电子式
的电子式_____________ ;由A、C原子个数比为5∶1组成的一种化合物,其中各原子均达到稳定结构,该化合物中所含化学键类型为_____________ 。
(3)B、C形成的最高价氧化物的水化物,酸性由强到弱的顺序为_____________ (用分子式表示,下同);D和G的简单氢化物沸点的由高到低的顺序为_____________ 。
(4)E和F分别对应的最高价氧化物的水化物相互反应的离子方程式________________ 。
(5)由C、E组成的一种离子化合物的化学式为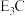 ,该化合物中两种离子的半径由大到小的顺序是(用离子符号表示)
,该化合物中两种离子的半径由大到小的顺序是(用离子符号表示)_________________________ ;该化合物遇水剧烈反应,有刺激性气味的气体生成,该反应的化学方程式为___________________________ 。
(1)G元素的名称是
(2)
 的电子式
的电子式(3)B、C形成的最高价氧化物的水化物,酸性由强到弱的顺序为
(4)E和F分别对应的最高价氧化物的水化物相互反应的离子方程式
(5)由C、E组成的一种离子化合物的化学式为
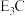 ,该化合物中两种离子的半径由大到小的顺序是(用离子符号表示)
,该化合物中两种离子的半径由大到小的顺序是(用离子符号表示)
您最近一年使用:0次
解题方法
7 . 我国科学家在嫦娥五号月壤样品中发现一种新矿物“嫦娥石”,其中含有原子序数依次增大的短周期主族元素X、Y、Z、R。X在地壳中含量最多,Y的电子层数是其最外层电子数的3倍,基态Z原子无未成对电子,基态R原子的p轨道半充满。下列说法错误的是
| A.Y的简单离子半径比Z的简单离子半径大 |
| B.R的简单氢化物的VSEPR模型为三角锥形 |
| C.Z的第一电离能大于同周期相邻元素 |
| D.X、R的简单氢化物的稳定性前者强于后者 |
您最近一年使用:0次
解题方法
8 . 下表为元素周期表的一部分,请根据元素①~⑧所处的位置回答下列问题:
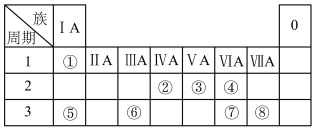
(1)元素④⑤⑧的离子半径由大到小的顺序为_______ (用离子符号表示)。
(2)元素⑦的原子结构示意图为_______ ,元素④⑦的最简单氢化物的稳定性关系为_______ (用化学式表示)。
(3)由元素④⑤组成原子个数比为1:1的化合物中含_______ (填“离子键”、“共价键”或“离子键和共价键”),将78g该化合物投入98g水中,所得溶液的质量分数为_______ 。
(4)元素②⑦⑧的最高价含氧酸的酸性最强的是_______ (填化学式),该酸与元素⑥的最高价氧化物对应的水化物反应的离子方程式是_______ 。
(5)由元素①③组成的含 和
和 的分子的电子式分别是
的分子的电子式分别是_______ 、_______ 。

(1)元素④⑤⑧的离子半径由大到小的顺序为
(2)元素⑦的原子结构示意图为
(3)由元素④⑤组成原子个数比为1:1的化合物中含
(4)元素②⑦⑧的最高价含氧酸的酸性最强的是
(5)由元素①③组成的含
 和
和 的分子的电子式分别是
的分子的电子式分别是
您最近一年使用:0次
名校
解题方法
9 . 无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在科技发展中发挥着重要的作用。完成下列填空:
I.新型材料α-Fe粉具有超强的磁性能,用作高密度磁记录的介质以及高效催化剂等。
(1)自然界一共存在四种稳定的铁原子,计算铁元素的近似相对原子质量的计算式为:54×a1%+56×a2%+57×a3%+58×a4%,其中a1%是指_______ ,58是指_______ 。
(2)已知铁位于周期表第四周期,与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为_______ 。
II.硅元素是无机非金属材料的主角。
(3)硅在周期表中的位置是_______ ,SiH4的空间构型为_______ 。
III.Nierite是一种高熔点高硬度的陶瓷材料,摩尔质量为140 g/mol,硅元素的质量分数为60%。已知1 mol NH3与足量的化合物T充分反应后可得到35 g Nierite与3 mol HCl气体。
(4)Nierite的化学式为_______ ,T的电子式为_______ 。
(5)碳化硅(SiC)单晶是目前技术最成熟的第三代半导体材料, 下列能说明碳的非金属性强于硅的反应(或反应组)是_______ (选填编号)
a.SiO + 2CO2 + 2H2O = H2SiO3 + 2HCO
+ 2CO2 + 2H2O = H2SiO3 + 2HCO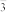
b.
c.SiH4 Si+2H2↑;CH4
Si+2H2↑;CH4 C+2H2↑
C+2H2↑
d.Si+O2 SiO2;C+O2
SiO2;C+O2 CO2
CO2
I.新型材料α-Fe粉具有超强的磁性能,用作高密度磁记录的介质以及高效催化剂等。
(1)自然界一共存在四种稳定的铁原子,计算铁元素的近似相对原子质量的计算式为:54×a1%+56×a2%+57×a3%+58×a4%,其中a1%是指
(2)已知铁位于周期表第四周期,与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为
II.硅元素是无机非金属材料的主角。
(3)硅在周期表中的位置是
III.Nierite是一种高熔点高硬度的陶瓷材料,摩尔质量为140 g/mol,硅元素的质量分数为60%。已知1 mol NH3与足量的化合物T充分反应后可得到35 g Nierite与3 mol HCl气体。
(4)Nierite的化学式为
(5)碳化硅(SiC)单晶是目前技术最成熟的第三代半导体材料, 下列能说明碳的非金属性强于硅的反应(或反应组)是
a.SiO
 + 2CO2 + 2H2O = H2SiO3 + 2HCO
+ 2CO2 + 2H2O = H2SiO3 + 2HCO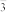
b.

c.SiH4
 Si+2H2↑;CH4
Si+2H2↑;CH4 C+2H2↑
C+2H2↑d.Si+O2
 SiO2;C+O2
SiO2;C+O2 CO2
CO2
您最近一年使用:0次
10 . X、Y、Z、Q是原子序数依次增大的短周期主族元素,X原子的最外层电子数是次外层电子数的2倍,Y原子的最外层电子数与最内层电子数相等,Z原子的最外层电子数为3,X、Z、Q原子的最外层电子数之和为14,M元素在地壳中的含量居第四位。回答下列问题:
(1)Y的元素符号为___________ 。用电子式表示Q与金属钠形成化合物的过程:___________ 。
(2)Z与Q的单质在加热条件下可以发生反应,请写出反应的化学方程式:___________ 。
(3)金属性:Y___________ Z(填“<”“>”或“=”),从原子结构角度上分析原因:___________ 。
(4)Z和X按照原子个数比4:3构成的固体化合物( )易与水反应生成可燃性气体(
)易与水反应生成可燃性气体( )和一种两性氢氧化物。该化合物与水反应的化学方程式为
)和一种两性氢氧化物。该化合物与水反应的化学方程式为___________ 。
(5)M的单质可用于处理酸性废水中的 ,使其转换为
,使其转换为 ,同时生成具有磁性的M的氧化物W。
,同时生成具有磁性的M的氧化物W。
①上述反应中M做___________ (填“氧化剂”或“还原剂”)。
②Z的单质与W在高温条件下反应的化学方程式为___________ 。
(1)Y的元素符号为
(2)Z与Q的单质在加热条件下可以发生反应,请写出反应的化学方程式:
(3)金属性:Y
(4)Z和X按照原子个数比4:3构成的固体化合物(
 )易与水反应生成可燃性气体(
)易与水反应生成可燃性气体( )和一种两性氢氧化物。该化合物与水反应的化学方程式为
)和一种两性氢氧化物。该化合物与水反应的化学方程式为(5)M的单质可用于处理酸性废水中的
 ,使其转换为
,使其转换为 ,同时生成具有磁性的M的氧化物W。
,同时生成具有磁性的M的氧化物W。①上述反应中M做
②Z的单质与W在高温条件下反应的化学方程式为
您最近一年使用:0次



