解题方法
1 . 锂是最轻的活泼金属,其单质及其化合物有广泛的用途。回答下列问题:
(1)在元素周期表中,与
 的化学性质最相似的邻族元素是
的化学性质最相似的邻族元素是___________ ,该元素基态原子中,占据最高能级电子的电子云轮廓图形状为___________ 。
(2)LiH是一种储氢材料。
(i)Li与H中第一电离能较小的元素是___________ 。
(ii)离子半径:Li+___________ H-(填“>”“=”或“<”)。
(3)已知金属锂晶体为FCC(面心立方晶格),面心立方紧密堆积结构示意图如下:
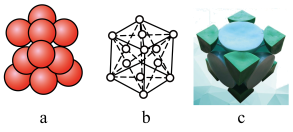
(i)晶胞中锂的配位数为___________ 。
(ii)若锂原子的半径为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则锂晶体密度为
,则锂晶体密度为___________  (列出含有
(列出含有 、
、 的计算式即可)。
的计算式即可)。
(1)在元素周期表中,与
 的化学性质最相似的邻族元素是
的化学性质最相似的邻族元素是(2)LiH是一种储氢材料。
(i)Li与H中第一电离能较小的元素是
(ii)离子半径:Li+
(3)已知金属锂晶体为FCC(面心立方晶格),面心立方紧密堆积结构示意图如下:

(i)晶胞中锂的配位数为
(ii)若锂原子的半径为
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则锂晶体密度为
,则锂晶体密度为 (列出含有
(列出含有 、
、 的计算式即可)。
的计算式即可)。
您最近一年使用:0次
2023-10-28更新
|
93次组卷
|
2卷引用:山西省朔州市怀仁市第九中学高中部2023-2024学年高三上学期11月期中考试化学试题
解题方法
2 . 结合元素周期律,根据下列事实所得推测合理的是
| 选项 | 事实 | 推测 |
| A | CO2是分子晶体,熔点较低 | SiO2是分子晶体,但熔点高于CO2 |
| B | 根据“对角线规则”,元素Be和Al的化学性质相似 | Be(OH)2具有两性,可与稀氨水反应 |
| C | 电解CuCl2溶液可得到金属Cu | 电解MgCl2溶液可得到金属Mg |
| D | 三氟乙酸的酸性强于三氯乙酸的酸性 | 三氯乙酸酸性强于三溴乙酸酸性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
3 . 硼是第IIIA族中唯一的非金属元素,可以形成众多的化合物。回答下列问题:
(1)B的第一电离能比Be低,原因是_______ ,按照“对角线规则”,硼的性质应该和_______ (填元素符号)相似,因此晶体硼的晶体类型是_______ 。
(2)氢气的安全贮存和运输是氢能应用的关键,氨硼烷(H3NBH3)是目前颇具潜力的储氢材料之一
①氨硼烷能溶于水,其主要原因是_______ 。
②氨硼烷热分解放氢,能生成一种环状的平面分子(B3N3H6),该分子的结构式为_______ 。
③分子之间除范德华力外,还有可能形成氢键,处于不同环境中氢原子也有可能显不同的电性,此时带相反电性的两个氢原子会形成一种新的作用力,叫双氢键,氨硼烷分子间既能形成氢键又能形成双氢键。下列选项中表示氨硼烷分子间的氢键的是_______ (填标号,下同),表示氨硼烷分子间的双氢键的是_______ 。
a.H-B…H-B b.B-H…H-B c.N-H…H-N d.H-N…H-N
e.H-N…H-B f.B-H…H-N g.H-B…H-N
(3)硼氢化钠(NaBH4)是一种常用的还原剂,其晶胞结构如图所示。
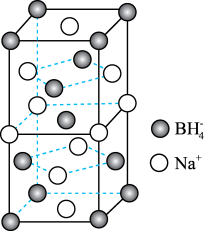
①Na+的配位数是_______ 。
②若晶胞的上、下底面心处的Na+被Li+取代,得到晶体的化学式为_______ 。
③已知硼氢化钠晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值,则Na+与BH 之间的最近距离为
之间的最近距离为_______ (用含ρ、NA的代数式表示)nm。
(1)B的第一电离能比Be低,原因是
(2)氢气的安全贮存和运输是氢能应用的关键,氨硼烷(H3NBH3)是目前颇具潜力的储氢材料之一
①氨硼烷能溶于水,其主要原因是
②氨硼烷热分解放氢,能生成一种环状的平面分子(B3N3H6),该分子的结构式为
③分子之间除范德华力外,还有可能形成氢键,处于不同环境中氢原子也有可能显不同的电性,此时带相反电性的两个氢原子会形成一种新的作用力,叫双氢键,氨硼烷分子间既能形成氢键又能形成双氢键。下列选项中表示氨硼烷分子间的氢键的是
a.H-B…H-B b.B-H…H-B c.N-H…H-N d.H-N…H-N
e.H-N…H-B f.B-H…H-N g.H-B…H-N
(3)硼氢化钠(NaBH4)是一种常用的还原剂,其晶胞结构如图所示。

①Na+的配位数是
②若晶胞的上、下底面心处的Na+被Li+取代,得到晶体的化学式为
③已知硼氢化钠晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值,则Na+与BH
 之间的最近距离为
之间的最近距离为
您最近一年使用:0次
2022-04-27更新
|
114次组卷
|
3卷引用:山西省临汾市部分学校2021-2022学年高二下学期期中联考化学试题
4 . 在元素周期表中的某些元素之间存在着特殊的“对角线规则”,如Li和Mg、Be和Al、B和Si的一些性质相似。下列说法不正确的是
| A.氢氧化铍是两性氢氧化物 | B.B和Si的电负性数值相近 |
| C.Li在N2中燃烧生成Li3N | D.Li和Mg的原子半径相近,且核外电子排布相同 |
您最近一年使用:0次
5 . 运用元素周期律分析下列推断,不正确的是
| A.Sr的原子序数为38,则氢氧化锶的化学式为Sr(OH)2 |
| B.H3BO3的酸性与H2SiO3接近 |
| C.氧化硼可能与氢氟酸发生反应 |
| D.HCl的还原性比H2S强,是因为Cl的非金属性比S强 |
您最近一年使用:0次
9-10高一下·江西·期中
6 . 运用元素周期律分析下面的推断,其中错误的是( )
| A.铍(Be)的氧化物的水化物可能具有两性 |
| B.砹(At)为有色固体;HAt不稳定;AgAt感光性很强,且不溶于水也不溶于稀酸 |
| C.硫酸锶(SrSO4)是难溶于水的白色固体 |
| D.硒化氢(H2Se)是无色、有毒、比H2S稳定的气体 |
您最近一年使用:0次



