1 . W、X、Y、Z是原子序数依次增大的短周期元素。W、X的最简单氢化物及Y2+、Z3+均具有相同的电子数。下列说法正确的是
| A.W、X、Y、Z位于元素周期表同一周期 |
| B.离子半径:Y2+<Z3+ |
| C.最简单氢化物沸点可能为:X>W |
| D.Y、Z的最高价氧化物对应的水化物均是强碱 |
您最近一年使用:0次
解题方法
2 . 现有A、B、C、D、E、F、G、H八种元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
(1) 的电子式为
的电子式为_______ (用元素符号表示,下同),其易溶于水的原因为_______ 。
(2)B元素的原子核外共有_______ 种不同运动状态的电子,基态原子中能量最高的电子所占据的原子轨道呈_______ 形。B元素的一种单质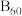 分子中每个B原子只跟相邻的3个碳原子形成共价键,且每个碳原子最外层都满足8电子稳定结构,则一个
分子中每个B原子只跟相邻的3个碳原子形成共价键,且每个碳原子最外层都满足8电子稳定结构,则一个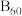 分子中π键的数目为
分子中π键的数目为_______ 个。
(3)E元素的原子 远远大于
远远大于 ,其原因是
,其原因是_______ 。
(4)D、E、F三种元素的简单离子半径由大到小的顺序是_______ (用离子符号表示)。
(5)H位于元素周期表中_______ 区(按电子排布分区),其基态原子的价层电子轨道表示式为_______ ,实验室用一种含G元素的黄色溶液检验 时产生蓝色沉淀,该反应的离子方程式为
时产生蓝色沉淀,该反应的离子方程式为_______ 。
| A元素的核外电子数和电子层数相等,也是宇宙中含量最丰富的元素 |
| B元素是形成化合物种类最多的元素 |
| C元素基态原子的核外p电子数比s电子数少1 |
| D元素基态原子的核外p轨道中有两个未成对电子 |
E元素的气态基态原子的第一至第四电离能分别如下: , , , , , , |
| F元素的主族序数与周期数的差为4 |
| G元素是前四周期中电负性最小的元素 |
| H元素位于元素周期表中的第八纵列 |
 的电子式为
的电子式为(2)B元素的原子核外共有
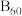 分子中每个B原子只跟相邻的3个碳原子形成共价键,且每个碳原子最外层都满足8电子稳定结构,则一个
分子中每个B原子只跟相邻的3个碳原子形成共价键,且每个碳原子最外层都满足8电子稳定结构,则一个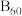 分子中π键的数目为
分子中π键的数目为(3)E元素的原子
 远远大于
远远大于 ,其原因是
,其原因是(4)D、E、F三种元素的简单离子半径由大到小的顺序是
(5)H位于元素周期表中
 时产生蓝色沉淀,该反应的离子方程式为
时产生蓝色沉淀,该反应的离子方程式为
您最近一年使用:0次
名校
3 . 已知X、Y、Z、W、M均为短周期主族元素,常温下,其最高价氧化物对应水化物的溶液(浓度均为 )的pH和原子半径的关系如图所示。
)的pH和原子半径的关系如图所示。

已知:①Y的一种同位素常用于测定生物化石的年代;
② 。
。
下列说法错误的是
 )的pH和原子半径的关系如图所示。
)的pH和原子半径的关系如图所示。
已知:①Y的一种同位素常用于测定生物化石的年代;
②
 。
。下列说法错误的是
A.由Z元素形成的单质可溶于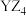 溶液中 溶液中 |
| B.仅由X元素与氢元素形成的化合物有可能是离子化合物 |
| C.M元素在自然界中都以化合物的形式存在 |
D. 中,所含的离子总数为 中,所含的离子总数为 |
您最近一年使用:0次
解题方法
4 . 短周期元素W、X、Y、Z的原子序数依次增大,X与W、Z相邻,且X、Z同主族,Y的金属性在短周期元素中最强,Z的一种氧化物是形成酸雨的主要物质。下列说法正确的是
| A.简单离子半径:Y>Z |
| B.简单氢化物的稳定性:W>X |
| C.X、Y可形成含有共价键的离子化合物 |
| D.Z的氧化物的水化物均为强酸 |
您最近一年使用:0次
2023-07-12更新
|
153次组卷
|
2卷引用:广东省韶关市2022-2023学年高一下学期期末检测化学试题
名校
5 . X、Y、Z、W为原子序数递增的四种短周期元素,其中Z为金属元素,X、W为同一主族元素,Y 是地壳中含量最高的元素。X、Z、W分别与 Y 形成的最高价化合物为甲、乙、丙。结合如图转化关系,下列判断错误的是


| A.反应③为工业上制取粗硅的原理 |
| B.甲、丙、丁均为酸性氧化物,可以与碱反应得到对应的盐 |
| C.4种元素的原子中,Y原子的半径相对最小 |
| D.Z位于元素周期表第三周期IIA族 |
您最近一年使用:0次
2020-08-07更新
|
544次组卷
|
6卷引用:湖南省长沙市雅礼中学2020届高考6月模拟卷(一)理综化学试题
湖南省长沙市雅礼中学2020届高考6月模拟卷(一)理综化学试题江西省宜春市上高县第二中学2019-2020学年高一下学期期末考试化学试题湖南省常德市第二中学2020届高三临考冲刺理科综合化学试题(已下线)押新高考卷06题 元素周期表元素周期律-备战2022年高考化学临考题号押题(新高考通版)(已下线)专题12 元素周期律推断-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)专题07 突破原子结构和元素周期表(律)(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)
解题方法
6 . 原子序数依次增大的V、W、X、Y、Z五种短周期元素,V与其他元素均不在同一周期,W元素形成的化合物种类最多,X元素的简单氢化物与它的最高价氧化物对应的水化物能反应生成盐,Y与Z同主族,Z元素形成的单质是黑火药的成分之一,下列说法错误的是
| A.V和W或V和Y形成的化合物均可能存在非极性共价键 |
B.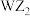 分子是非极性分子 分子是非极性分子 |
| C.仅由V、X、Y三种元素形成的化合物可能是离子化合物 |
| D.Y和Z形成的化合物常温、常压下均为气体 |
您最近一年使用:0次
2022-11-18更新
|
163次组卷
|
2卷引用:山西省大同市2023届高三第二次学情调研测试化学试题
7 . 短周期主族元素W、X、Y、Z的原子序数依次增大,W与Z同主族,且Z的单质是一种淡黄色的固体。已知W、Y、Z组成的化合物Q,可用作照相业的定影剂,Q的结构如图所示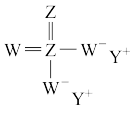 。
。
下列有关说法错误的是
 。
。下列有关说法错误的是
| A.简单离子半径大小:Z>Y>W>X |
| B.Q中W原子满足8电子稳定结构 |
| C.简单气态氢化物的稳定性:X>W>Z |
| D.Y分别与W、Z形成的二元化合物中可能均含有非极性键 |
您最近一年使用:0次
2022-03-16更新
|
160次组卷
|
2卷引用:辽宁省凌源市2021-2022学年高三下学期高三开学考试化学试题
2022·浙江·模拟预测
解题方法
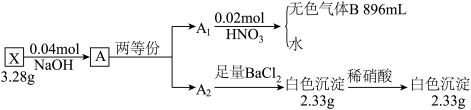
8 . 固体X是四种短周期元素组成的化合物,X的性质与铵盐相似。为探究固体X的组成,取3.28g X,与含NaOH 0.04mol的溶液恰好发生复分解反应,得溶液A(溶液A中含两种溶质,其中一种溶质的相对分子质量为33),将溶液A分成 和
和 两等份,完成如下实验(
两等份,完成如下实验( 与0.02mol硝酸恰好反应,无色气体B在标准状况下的体积为896mL,在空气中变成红棕色):
与0.02mol硝酸恰好反应,无色气体B在标准状况下的体积为896mL,在空气中变成红棕色):
(1)组成X的四种元素是_________ (填元素符号),X的化学式为_________ 。
(2)A中某种溶质与AgBr反应可生成两种单质,化学方程式为_________ 。
(3)写出X的水溶液与 溶液反应生成白色沉淀的离子方程式:
溶液反应生成白色沉淀的离子方程式:_________ 。
(4)为探究 和NaOH的反应,设计实验方案如下:向含
和NaOH的反应,设计实验方案如下:向含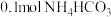 的溶液中加入0.1mol NaOH,反应完全后,滴加氯化钙稀溶液。若有沉淀生成,则
的溶液中加入0.1mol NaOH,反应完全后,滴加氯化钙稀溶液。若有沉淀生成,则 与NaOH的反应可能为
与NaOH的反应可能为_________ (写离子方程式);若无沉淀生成,则 与NaOH的反应可能为
与NaOH的反应可能为_________ (写离子方程式)。该实验方案有无不妥之处?若有,提出修正意见:_________ 。
 和
和 两等份,完成如下实验(
两等份,完成如下实验( 与0.02mol硝酸恰好反应,无色气体B在标准状况下的体积为896mL,在空气中变成红棕色):
与0.02mol硝酸恰好反应,无色气体B在标准状况下的体积为896mL,在空气中变成红棕色):
(1)组成X的四种元素是
(2)A中某种溶质与AgBr反应可生成两种单质,化学方程式为
(3)写出X的水溶液与
 溶液反应生成白色沉淀的离子方程式:
溶液反应生成白色沉淀的离子方程式:(4)为探究
 和NaOH的反应,设计实验方案如下:向含
和NaOH的反应,设计实验方案如下:向含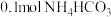 的溶液中加入0.1mol NaOH,反应完全后,滴加氯化钙稀溶液。若有沉淀生成,则
的溶液中加入0.1mol NaOH,反应完全后,滴加氯化钙稀溶液。若有沉淀生成,则 与NaOH的反应可能为
与NaOH的反应可能为 与NaOH的反应可能为
与NaOH的反应可能为
您最近一年使用:0次
9 . 由相邻短周期元素W、X、Y、Z组成的穴状配体结构如图(部分W和X未标注)X、Y、Z同周期,W原子半径在周期表中最小,下列说法错误的是


| A.第一电离能:Y>Z>X |
| B.W、X、Y三种元素可形成直线型或平面型化合物 |
| C.X、Y、Z分别与W形成的简单化合物,其熔沸点在同主族元素中均为最高 |
| D.含W、X、Y、Z元素的化合物,既可以形成分子晶体也可以形成离子晶体 |
您最近一年使用:0次
2021-05-28更新
|
355次组卷
|
2卷引用:山东省青岛市2021届高三5月自主检测化学试题
解题方法
10 . X、Y、Z、M、Q、R是元素周期表前四周期的元素,且原子序数依次增大,其相关信息如下表所示:
(1)写出元素Q的基态原子的价电子轨道表示式是_________ 。
(2)X、Y、Z三种元素的原子半径由小到大的顺序是_________ (用元素符号表示)
(3)M元素基态原子中能量最高的电子的电子云在空间有________ 个伸展方向,原子轨道呈________ 形。
(4)小范同学写了某基态原子的两个价电子的表达式,分析其分别违背了什么原理:
①3s13p4:___________ ,
② :
:__________ 。
(5)元素R可形成R2+和R3+,其中较稳定的是R3+,从原子结构角度解释原因是___________ 。
| 元素 | 相关信息 |
| X | 原子核外有6种不同运动状态的电子 |
| Y | 基态原子中s电子总数与p电子总数相同 |
| Z | 形成的氧化物和强酸、强碱都可以反应 |
| M | 基态原子的最外层p轨道上有两个电子的自旋方向与其它电子的自旋方向相反 |
| Q | 前4周期元素原子核外电子排布中未成对电子数最多的元素 |
| R | 基态原子核外有7个能级上有电子且能量最高的能级上有6个电子 |
(1)写出元素Q的基态原子的价电子轨道表示式是
(2)X、Y、Z三种元素的原子半径由小到大的顺序是
(3)M元素基态原子中能量最高的电子的电子云在空间有
(4)小范同学写了某基态原子的两个价电子的表达式,分析其分别违背了什么原理:
①3s13p4:
②
 :
:(5)元素R可形成R2+和R3+,其中较稳定的是R3+,从原子结构角度解释原因是
您最近一年使用:0次



