名校
解题方法
1 . 现有A、B、C、D、E、F、G、H、I九种元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
A:核外电子数和电子层数相等,也是宇宙中最丰富的元素
B:形成化合物种类最多的元素
C:基态原子的核外p能级电子数比s能级电子数少1
D:基态原子的核外p轨道中有两个未成对电子
E:气态基态原子的第一至第四电离能分别是:I1=738 kJ/mol,I2=1451 kJ/mol,I3=7733 kJ/mol,I4=10540 kJ/mol
F:同周期元素的简单离子中半径最小
G:主族序数与周期数的差为4
H:前四周期主族元素中电负性最小
I:位于元素周期表中的第八列
(1)C2A4的电子式为_______ 。
(2)B元素的原子核外共有_______ 种不同运动状态的电子。
(3)某同学推断E元素基态原子的核外电子轨道表示式为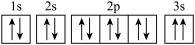 。该同学所画的轨道表示式违背了
。该同学所画的轨道表示式违背了_______ ,解释E元素原子的第一电高能大于F元素原子的第一电离能的原因:_______ 。
(4)用惰性电极电解熔融的EG2制备E单质的化学方程式为_______ 。
(5)与F元素成“对角线规则”关系的某短周期元素T的最高价氧化物的水化物具有两性,写出该两性物质与H元素的最高价氧化物的水化物反应的离子方程式:_______ ;已知T元素和Cl元素的电负性分别为1.5和3.0,则它们形成的化合物是_______ (填“离子化合物”或“共价化合物”)。
(6)与H元素同周期的基态原子中,未成对电子数与H原子相同的元素有_______ 种。
(7)I位于元素周期表中____ 区(按电子排布分区),实验室检验I3+的离子方程式为:____ 。
A:核外电子数和电子层数相等,也是宇宙中最丰富的元素
B:形成化合物种类最多的元素
C:基态原子的核外p能级电子数比s能级电子数少1
D:基态原子的核外p轨道中有两个未成对电子
E:气态基态原子的第一至第四电离能分别是:I1=738 kJ/mol,I2=1451 kJ/mol,I3=7733 kJ/mol,I4=10540 kJ/mol
F:同周期元素的简单离子中半径最小
G:主族序数与周期数的差为4
H:前四周期主族元素中电负性最小
I:位于元素周期表中的第八列
(1)C2A4的电子式为
(2)B元素的原子核外共有
(3)某同学推断E元素基态原子的核外电子轨道表示式为
 。该同学所画的轨道表示式违背了
。该同学所画的轨道表示式违背了(4)用惰性电极电解熔融的EG2制备E单质的化学方程式为
(5)与F元素成“对角线规则”关系的某短周期元素T的最高价氧化物的水化物具有两性,写出该两性物质与H元素的最高价氧化物的水化物反应的离子方程式:
(6)与H元素同周期的基态原子中,未成对电子数与H原子相同的元素有
(7)I位于元素周期表中
您最近半年使用:0次
名校
解题方法
2 . 已知A、B、C、D是元素周期表中的四种短周期元素,A分别与B、C、D化合形成甲、乙、丙三种分子,均含有相同数目的电子。丙与甲、乙均能发生化学反应,且甲、丙为无色有刺激性气味的气体,丁与C的某种单质在常温条件下反应生成红棕色气体;B、C、D三种元素的单质与甲、乙、丁三种化合物之间存在如图所示的转化关系:

(1)丙的化学式为_______ 。
(2)丁与C的常见的单质在常温下反应生成红棕色气体的化学方程式为_______ 。
(3)B、C、D原子半径由大到小顺序为_______ (用元素符号表示)。
(4)B的单质+乙→甲+C的单质的化学方程式为_______ 。

(1)丙的化学式为
(2)丁与C的常见的单质在常温下反应生成红棕色气体的化学方程式为
(3)B、C、D原子半径由大到小顺序为
(4)B的单质+乙→甲+C的单质的化学方程式为
您最近半年使用:0次
2022-03-22更新
|
677次组卷
|
2卷引用:河南省南阳市第一中学2021-2022学年高一下学期第一次月考化学试题
名校
解题方法
3 . A、B、C、D、E、F为原子序数依次增大的六种短周期主族元素。已知:A是宇宙中含量最高的元素;B、C形成的化合物是形成酸雨的主要物质;D、E、F为同周期元素,它们的最高价氧化物的水化物均可两两反应。用元素符号回答下列问题:
(1)元素C原子核内质子数比中子数少2个,满足该条件的原子符号为_______ ;元素E在周期中的位置:_______ 。
(2)若元素F的单质是一种黄绿色气体,常温时由F形成的最高价氧化物甲是一种液态物质,将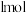 甲完全溶于水形成溶液时放出
甲完全溶于水形成溶液时放出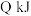 的热量,写出该过程的热化学反应方程式
的热量,写出该过程的热化学反应方程式_______ ;若元素F的单质是一种黄色固体,下列表述中能证明元素C的非金属性强于F的是_______ (填写序号)。
①元素C和F形成的化合物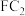 中,F化合价为
中,F化合价为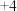 ,C化合价为
,C化合价为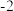
②元素C、F各自形成的最简单氢化物的沸点:前者>后者
③常温时,元素C的单质为气态,F的单质为固态
④元素C的单质可将F从其氢化物溶液中置换出来
(3)元素A、B可形成一种离子化合物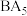 ,该化合物的电子式为
,该化合物的电子式为_______ 。
(4)用高能射线照射A、C形成的10电子分子时,一个分子能释放一个电子,同时产生一种具有较高氧化性的阳离子,试写出该阳离子的化学式_______ ,该阳离子存在的化学键类型有_______ 。
(5)写出元素D、E的最高价氧化物的水化物相互反应的离子方程式_______ 。
(1)元素C原子核内质子数比中子数少2个,满足该条件的原子符号为
(2)若元素F的单质是一种黄绿色气体,常温时由F形成的最高价氧化物甲是一种液态物质,将
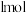 甲完全溶于水形成溶液时放出
甲完全溶于水形成溶液时放出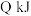 的热量,写出该过程的热化学反应方程式
的热量,写出该过程的热化学反应方程式①元素C和F形成的化合物
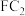 中,F化合价为
中,F化合价为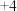 ,C化合价为
,C化合价为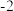
②元素C、F各自形成的最简单氢化物的沸点:前者>后者
③常温时,元素C的单质为气态,F的单质为固态
④元素C的单质可将F从其氢化物溶液中置换出来
(3)元素A、B可形成一种离子化合物
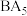 ,该化合物的电子式为
,该化合物的电子式为(4)用高能射线照射A、C形成的10电子分子时,一个分子能释放一个电子,同时产生一种具有较高氧化性的阳离子,试写出该阳离子的化学式
(5)写出元素D、E的最高价氧化物的水化物相互反应的离子方程式
您最近半年使用:0次
2023-05-11更新
|
565次组卷
|
2卷引用:重庆市巴蜀中学校2022-2023学年高一下学期5月期中考试化学试题
4 . 化合物X是由4种元素组成的盐,不含结晶水。某兴趣小组按如图流程进行实验(所加试剂均足量):
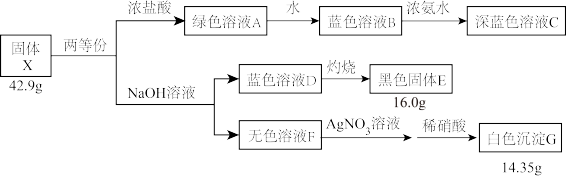
已知:溶液A、B、C中均含有结构相似的配离子,溶液F中的阳离子和酸根离子均只有一种(忽略水的电离)。
请回答:
(1)组成X的元素有____ ,X的化学式为____ 。
(2)根据A→B→C的现象,给出相应微粒与阳离子结合由弱到强的排序____ 。
(3)X与足量NaOH溶液反应的化学方程式是____ 。
(4)蓝色溶液B与Na2SO3作用,溶液蓝色褪去,同时生成易溶于硝酸的白色沉淀H(H为二元化合物)。
①写出该反应的离子方程式____ 。
②设计实验验证白色沉淀H的组成元素____ 。

已知:溶液A、B、C中均含有结构相似的配离子,溶液F中的阳离子和酸根离子均只有一种(忽略水的电离)。
请回答:
(1)组成X的元素有
(2)根据A→B→C的现象,给出相应微粒与阳离子结合由弱到强的排序
(3)X与足量NaOH溶液反应的化学方程式是
(4)蓝色溶液B与Na2SO3作用,溶液蓝色褪去,同时生成易溶于硝酸的白色沉淀H(H为二元化合物)。
①写出该反应的离子方程式
②设计实验验证白色沉淀H的组成元素
您最近半年使用:0次
5 . 固体化合物X由4种元素组成,其中2种为短周期元素,某学习小组开展如下探究实验:
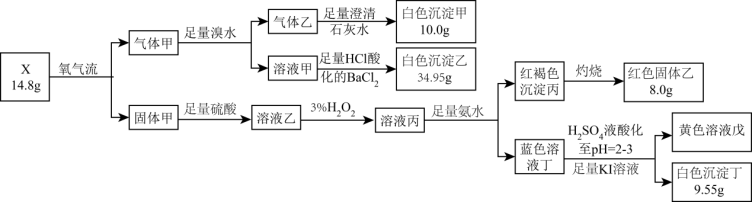
请回答:
(1)组成X的元素有_______ ,X的化学式为_______ 。
(2)溶液丙中含有的溶质除 外还有
外还有_______ ,相同条件下对应阳离子的氧化性由强到弱的排序为_______ 。
(3)溶液丁到沉淀丁的离子方程式是_______ 。
(4)已知白色沉淀丁几乎不溶于水和乙醇,溶于盐酸且该过程中铜元素化合价没有变化,请设计实验验证白色沉淀丁的组成元素_______ 。

请回答:
(1)组成X的元素有
(2)溶液丙中含有的溶质除
 外还有
外还有(3)溶液丁到沉淀丁的离子方程式是
(4)已知白色沉淀丁几乎不溶于水和乙醇,溶于盐酸且该过程中铜元素化合价没有变化,请设计实验验证白色沉淀丁的组成元素
您最近半年使用:0次
名校
解题方法
6 . A、B、C、D、E、F、G是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如表所示,请回答下列问题。
(1)A在元素周期表中的位置为___________ ,画出基态B原子的轨道表示式___________ 。
(2)B的简单气态氢化物的沸点___________ (填“高于”或“低于”)PH3,原因是___________ 。
(3)A、B、C三种元素的电负性由高到低的排列次序为___________ (用元素符号表示)。
(4)已知元素A、B形成的 链状分子中所有的原子都满足8电子稳定结构,则其分子中
链状分子中所有的原子都满足8电子稳定结构,则其分子中 键与
键与 键数目之比为
键数目之比为___________ 。
(5)G元素可形成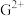 、
、 ,其中较稳定的是
,其中较稳定的是 ,原因是
,原因是___________ 。
(6)短周期元素 与元素
与元素 在周期表中的位置呈现对角线关系,已知元素
在周期表中的位置呈现对角线关系,已知元素 、
、 的电负性分别为1.5和3.0,预测它们形成的化合物是
的电负性分别为1.5和3.0,预测它们形成的化合物是___________ (填“离子”或“共价”)化合物。推测 的最高价氧化物对应的水化物
的最高价氧化物对应的水化物___________ (填“能”或“不能”)与 的最高价氧化物对应水化物发生反应。
的最高价氧化物对应水化物发生反应。
| A | 原子核外有6个电子 |
| B | 原子序数比 大1 大1 |
| C | 基态原子中 电子总数与p电子总数相等 电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子价层电子排布式为3s23p1 |
| F | 基态原子的最外层p 轨道有2个电子的自旋状态与其他电子的自旋状态相反 |
| G | 生活中使用最多的一种金属,其高价氯化物的盐溶液常用于刻蚀铜制印刷电路板 |
(2)B的简单气态氢化物的沸点
(3)A、B、C三种元素的电负性由高到低的排列次序为
(4)已知元素A、B形成的
 链状分子中所有的原子都满足8电子稳定结构,则其分子中
链状分子中所有的原子都满足8电子稳定结构,则其分子中 键与
键与 键数目之比为
键数目之比为(5)G元素可形成
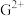 、
、 ,其中较稳定的是
,其中较稳定的是 ,原因是
,原因是(6)短周期元素
 与元素
与元素 在周期表中的位置呈现对角线关系,已知元素
在周期表中的位置呈现对角线关系,已知元素 、
、 的电负性分别为1.5和3.0,预测它们形成的化合物是
的电负性分别为1.5和3.0,预测它们形成的化合物是 的最高价氧化物对应的水化物
的最高价氧化物对应的水化物 的最高价氧化物对应水化物发生反应。
的最高价氧化物对应水化物发生反应。
您最近半年使用:0次
2022-07-25更新
|
954次组卷
|
3卷引用:陕西省西安市莲湖区2021-2022学年高二下学期期末质量检测化学(B卷)试题
2022高三·全国·专题练习
名校
7 . 有某固体化合物X(含有三种短周期元素)是一种络合氢化物储氢材料,X中某种元素的单质可用于制造信号弹。某实验员对固体化合物X作如图实验: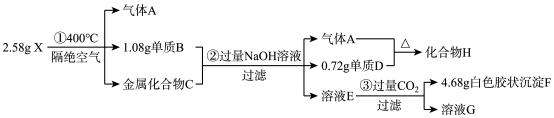
其中:X由三种短周期元素组成,且阴、阳离子个数比为2:1;金属互化物——全部由金属元素组成的化合物。请回答:
(1)化合物X的组成元素___________ ,写出H的电子式___________ 。
(2)X在400℃分解的化学方程式___________ 。
(3)溶液E和过量CO2发生反应的离子方程式为___________ 。
(4)金属互化物C分别与足量盐酸和足量氢氧化钠溶液反应产生的气体物质的量之比为___________ 。
(5)气体A与单质D制备化合物H的过程中,通常产物中会夹杂单质D,请设计实验方案,检验产品中是否含有单质D:___________ 。

其中:X由三种短周期元素组成,且阴、阳离子个数比为2:1;金属互化物——全部由金属元素组成的化合物。请回答:
(1)化合物X的组成元素
(2)X在400℃分解的化学方程式
(3)溶液E和过量CO2发生反应的离子方程式为
(4)金属互化物C分别与足量盐酸和足量氢氧化钠溶液反应产生的气体物质的量之比为
(5)气体A与单质D制备化合物H的过程中,通常产物中会夹杂单质D,请设计实验方案,检验产品中是否含有单质D:
您最近半年使用:0次
2022-08-26更新
|
509次组卷
|
3卷引用:第五章 物质结构 元素周期律(测)-2023年高考化学一轮复习讲练测(全国通用)
(已下线)第五章 物质结构 元素周期律(测)-2023年高考化学一轮复习讲练测(全国通用)浙江省舟山市舟山中学2022-2023学年国庆返校检测高三化学试题 山东省青岛第五十八中学2022-2023学年高一下学期3月月考化学试题
22-23高一上·全国·课时练习
8 . 已知元素W、X、Y、Z为原子序数依次增大的短周期主族元素,其中W的最高价氧化物的水化物能与其气态氢化物反应生成离子化合物,X原子的最外层电子数是次外层电子数的一半,Y与W同主族,Z元素的单质常温下为气体。
(1)W与X可以形成一种高温结构陶瓷材料甲,其中W、X的化合价分别是它们各自的最低价和最高价,其化学式为___________ 。
(2)X、Y、Z的气态氢化物的稳定性由强到弱的顺序是___________ (用分子式表示)。
(3)W、Z的气态氢化物分别为乙和丙,X与Z元素形成的化学物为丁。结构陶瓷材料甲的一种合成方法的反应如下:①丁+乙→丙+戊;②戊→甲+乙
其中,戊中含有三种元素,原子个数比为1︰4︰8,上述反应均在高温下进行。请写出反应的化学方程式:
①___________ 。
②___________ 。
(1)W与X可以形成一种高温结构陶瓷材料甲,其中W、X的化合价分别是它们各自的最低价和最高价,其化学式为
(2)X、Y、Z的气态氢化物的稳定性由强到弱的顺序是
(3)W、Z的气态氢化物分别为乙和丙,X与Z元素形成的化学物为丁。结构陶瓷材料甲的一种合成方法的反应如下:①丁+乙→丙+戊;②戊→甲+乙
其中,戊中含有三种元素,原子个数比为1︰4︰8,上述反应均在高温下进行。请写出反应的化学方程式:
①
②
您最近半年使用:0次
解题方法
9 . 由三种短周期元素组成的盐X,为测定其组成进行如下实验。已知A为金属单质、C为非金属单质,B、C中含有同种元素,F焰色反应呈紫红色。请回答下列问题:
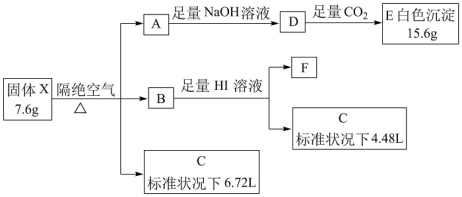
(1)组成X的三种元素是__ (填元素符号),X的化学式为__ 。
(2)固体X能与水反应生成C、E和另一种碱性物质,写出该反应的化学方程式:__ 。
(3)溶液D与过量CO2反应生成E,写出其反应的离子方程式:__ 。
(4)写出X与NH3按物质的量1∶4发生反应的化学方程式:__ 。
(5)物质F是电池工业重要原料,请设计实验方案检验F中的离子:__ 。

(1)组成X的三种元素是
(2)固体X能与水反应生成C、E和另一种碱性物质,写出该反应的化学方程式:
(3)溶液D与过量CO2反应生成E,写出其反应的离子方程式:
(4)写出X与NH3按物质的量1∶4发生反应的化学方程式:
(5)物质F是电池工业重要原料,请设计实验方案检验F中的离子:
您最近半年使用:0次
名校
10 . I.SF6是一种优良的绝缘气体,分子中只存在S-F键,已知1molS(s)转化为气态硫原子吸收能量280kJ,F-F键能为160kJ·mol-1,S-F键能为330kJ·mol-1。
(1)试写出S(s)和F2(g)反应生成SF6(g)的热化学方程式_______ 。
Ⅱ.V、W、X、Y、Z是由四种短周期元素中的2种或3种组成的5种化合物,其中W、X、Z均由2种元素组成,X是导致温室效应的主要气体,Z是天然气的主要成分,Y、W都既能与酸反应,又能与强碱溶液反应。上述5种化合物涉及的四种元素的原子序数之和等于28;V由一种金属元素A和两种非金属元素B与C组成,其化学式构成为A(BC3)3。它们之间的反应关系如下图:
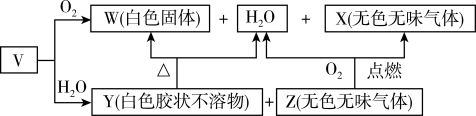
(2)写出气体X的结构式_______ 。
(3)写出Y与NaOH溶液反应的离子方程式:_______ 。
(4)V可通过金属A与Hg(BC3)2(金属Hg的化合物)反应制得,该反应的化学方程式为_____ 。
(5)写出A与浓硝酸加热反应的化学方程式:_______ 。
(6)以Z为燃料,活性炭为电极,熔融碳酸盐(如熔融K2CO3)环境下制成燃料电池的负极反应式为_______ 。
(1)试写出S(s)和F2(g)反应生成SF6(g)的热化学方程式
Ⅱ.V、W、X、Y、Z是由四种短周期元素中的2种或3种组成的5种化合物,其中W、X、Z均由2种元素组成,X是导致温室效应的主要气体,Z是天然气的主要成分,Y、W都既能与酸反应,又能与强碱溶液反应。上述5种化合物涉及的四种元素的原子序数之和等于28;V由一种金属元素A和两种非金属元素B与C组成,其化学式构成为A(BC3)3。它们之间的反应关系如下图:

(2)写出气体X的结构式
(3)写出Y与NaOH溶液反应的离子方程式:
(4)V可通过金属A与Hg(BC3)2(金属Hg的化合物)反应制得,该反应的化学方程式为
(5)写出A与浓硝酸加热反应的化学方程式:
(6)以Z为燃料,活性炭为电极,熔融碳酸盐(如熔融K2CO3)环境下制成燃料电池的负极反应式为
您最近半年使用:0次



