名校
1 . 有X、Y、Z、M、R、Q六种短周期的主族元素,部分信息如下表所示:
请回答下列问题:
(1)R在元素周期表中的位置是___________
(2)根据表中数据推测,Y的原子半径的最小范围是___________
(3)Z、M、Q的简单离子的半径由大到小的顺序为___________ (用离子符号表示)
(4)由元素X、M、Q组成的化合物属于___________ 化合物。写出Z2M2的电子式___________
(5)下列事实能作为比较元素Y与R的非金属性相对强弱依据的是___________ (选填字母序号)
A.常温下Y的单质呈固态,R的单质呈气态
B.稳定性:XR>YX4
C.Y与R形成的化合物中Y呈正价
D.酸性HR>H2XO3
(6)写出R的单质与Z的最高价氧化物对应水化物的水溶液反应的离子方程式___________
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.160 | ||
| 主要化合价 | -4、+ 4 | -2 | -1、+ 7 | |||
| 其它信息 | 某种核素无中子 | 常用的半导体材料 | 短周期主族元素中原子半径最大 | 次外层电子数是最外层电子数的4倍 |
(1)R在元素周期表中的位置是
(2)根据表中数据推测,Y的原子半径的最小范围是
(3)Z、M、Q的简单离子的半径由大到小的顺序为
(4)由元素X、M、Q组成的化合物属于
(5)下列事实能作为比较元素Y与R的非金属性相对强弱依据的是
A.常温下Y的单质呈固态,R的单质呈气态
B.稳定性:XR>YX4
C.Y与R形成的化合物中Y呈正价
D.酸性HR>H2XO3
(6)写出R的单质与Z的最高价氧化物对应水化物的水溶液反应的离子方程式
您最近一年使用:0次
2021-06-01更新
|
1260次组卷
|
6卷引用:广西柳州高级中学2023-2024学年高一上学期寒假月考化学试卷(一)
名校
解题方法
2 . W、X、Y、Z、M、G、H七种短周期元素,原子序数依次增大。W、Z同主族,可形成离子化合物ZW;Y、G同主族,可形成GY2、GY3两种分子;X的气态氢化物与其最高价氧化物的水化物能反应;H不是稀有气体元素,W、X、Y、Z、M、G、H的最外层电子数之和等于29。请回答下列问题:
(1)Y在元素周期表中的位置为_______ 。
(2)Y、Z、G三种元素原子半径由大到小的顺序是_______ (用元素符号表示)。
(3)上述元素的最高价氧化物对应水化物的碱性最强的是_______ (填化学式),Z、M最高价氧化物对应的水化物相互反应的离子方程式为_______ ,X的气态氢化物的催化氧化反应的化学方程式为_______ 。
(4)G的非金属性_______ (填“>”或“<”)H的非金属性,下列表述可以作为验证的证据的是_______ (填字母)。
A.比较这两种元素单质的沸点
B.比较这两种元素单质与氢气化合的难易程度
C.G和H单质分别与Fe反应生成FeG、FeH3
D.比较这两种元素单质与酸或碱反应的难易程度
(1)Y在元素周期表中的位置为
(2)Y、Z、G三种元素原子半径由大到小的顺序是
(3)上述元素的最高价氧化物对应水化物的碱性最强的是
(4)G的非金属性
A.比较这两种元素单质的沸点
B.比较这两种元素单质与氢气化合的难易程度
C.G和H单质分别与Fe反应生成FeG、FeH3
D.比较这两种元素单质与酸或碱反应的难易程度
您最近一年使用:0次
2023-04-27更新
|
434次组卷
|
2卷引用:广西示范性高中2022-2023学年高一下学期4月期中联合调研测试化学试题
名校
3 . 如表是元素周期表主族元素的一部分,请参照元素①~⑥在表中的位置,回答下列问题:

(1)②在周期表中的位置______ 。
(2)①的简单氢化物的电子式______ 。
(3)③④⑤形成的简单离子半径由大到小的排序是______ (用离子符号表示)。
(4)用电子式表示③和⑥形成的化合物的过程______ 。
(5)写出⑤单质与③的最高价氧化物对应水化物反应的离子方程式______ 。
(6)③和④中金属性强的是______ (填“元素符号”),以下说法能证明该结论的是______ 。
a.③容易失去1个e-,而④容易失去2个e-
b.③与冷水剧烈反应,而④与冷水反应缓慢
c.③和④的最高价氧化物对应水化物的碱性:③>④
(7)硒(Se)位于第四周期,与②同主族。下列推断不正确 的是______ 。
a.Se最低价为-2价
b.Se单质常温下也呈气态,只有氧化性
c.沸点:H2Se<H2O

(1)②在周期表中的位置
(2)①的简单氢化物的电子式
(3)③④⑤形成的简单离子半径由大到小的排序是
(4)用电子式表示③和⑥形成的化合物的过程
(5)写出⑤单质与③的最高价氧化物对应水化物反应的离子方程式
(6)③和④中金属性强的是
a.③容易失去1个e-,而④容易失去2个e-
b.③与冷水剧烈反应,而④与冷水反应缓慢
c.③和④的最高价氧化物对应水化物的碱性:③>④
(7)硒(Se)位于第四周期,与②同主族。下列推断
a.Se最低价为-2价
b.Se单质常温下也呈气态,只有氧化性
c.沸点:H2Se<H2O
您最近一年使用:0次
2023-04-23更新
|
168次组卷
|
2卷引用:广西壮族自治区玉林市2022-2023学年高一上学期1月期末考试化学试题
名校
4 . 已知:X、Y、Z、G、Q为原子序数依次增大的五种短周期主族元素;X、Y、Q的单质在常温下呈气态且X、Y位于同一周期;Y的最外层电子数是其电子层数的3倍;Y、Z的最外层电子数之和等于Q的最外层电子数;G是地壳中含量排第二的元素。请回答下列问题:
(1)Z在元素周期表中的位置为___________ ;X的单质的电子式为___________ 。
(2)X、G的非金属性强弱:___________ (填元素符号,下同)>___________ ,X、Y、Z、Q的原子半径由大到小的顺序为___________ 。
(3)上述元素的最高价氧化物对应水化物的酸性最强的是___________ (填化学式);化合物ZQY中含有的化学键的类型为___________ 。
(4)将化合物GY2加入Z的最高价氧化物对应水化物的溶液中,发生反应的化学方程式为___________ 。
(1)Z在元素周期表中的位置为
(2)X、G的非金属性强弱:
(3)上述元素的最高价氧化物对应水化物的酸性最强的是
(4)将化合物GY2加入Z的最高价氧化物对应水化物的溶液中,发生反应的化学方程式为
您最近一年使用:0次
2022-03-17更新
|
137次组卷
|
3卷引用:广西南宁市宾阳县宾阳中学2021-2022学年高一下学期3月月考化学试题
5 . X为短周期元素,A为该元素的简单氢化物,D为该元素的最高价含氧酸且为强酸。根据如图所示转化关系(反应条件及部分产物已略去),回答下列问题。
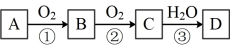
(1)若液态A可作制冷剂。C的化学式为_______ ,写出①的化学反应方程式:_______ ,反应③中还原剂与氧化剂的质量之比为_______ 。实验室制取A的化学方程式:_______ 。
(2)若A的摩尔质量为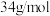 。A的电子式为
。A的电子式为_______ ,D的浓溶液与蔗糖的实验现象说明其具有_______ 性质。
(3)写出实验室用 和D的浓溶液制备B反应的化学方程式:
和D的浓溶液制备B反应的化学方程式:_______ 。

(1)若液态A可作制冷剂。C的化学式为
(2)若A的摩尔质量为
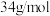 。A的电子式为
。A的电子式为(3)写出实验室用
 和D的浓溶液制备B反应的化学方程式:
和D的浓溶液制备B反应的化学方程式:
您最近一年使用:0次
解题方法
6 . 元素周期表在学习、研究和生产实践中有很重要的作用。下表显示了元素周期表中的短周期,①〜⑤代表5种元素。
(1)②在元素周期表中的位置是_______ 。
(2)①分别与④、⑤形成的化合物中,稳定性强的是_______ (用化学式表示)。
(3)③和④分别形成的最高价氧化物对应的水化物可以发生反应,离子方程式是_______ 。
(4)③能与⑤形成AB型化合物,用原子结构解释原因:_______ 。
(5)元素Se的原子结构示意图为 。下列推断正确的是
。下列推断正确的是_______ (填序号)。
a.Se位于第4周期、与④同主族
b.Se的最低负化合价为-2价
c.SeO2具有还原性
d.H2SeO3的酸性强于H2SO4
| ① | |||||||
| ② | |||||||
| ③ | ④ | ⑤ |
(2)①分别与④、⑤形成的化合物中,稳定性强的是
(3)③和④分别形成的最高价氧化物对应的水化物可以发生反应,离子方程式是
(4)③能与⑤形成AB型化合物,用原子结构解释原因:
(5)元素Se的原子结构示意图为
 。下列推断正确的是
。下列推断正确的是a.Se位于第4周期、与④同主族
b.Se的最低负化合价为-2价
c.SeO2具有还原性
d.H2SeO3的酸性强于H2SO4
您最近一年使用:0次
2021-01-24更新
|
237次组卷
|
2卷引用:广西钦州市第四中学2022-2023学年高一上学期12月份考试化学试题
名校
7 . 短周期元素的单质X、Y、Z在通常状况下均为气态,并有如图转化关系(反应条件略去):

已知:a.常见双原子单质分子中,X分子含共价键最多。b.甲分子中含10个电子,乙分子含有18个电子。
(1)X的电子式是_______ 。
(2)实验室可用如图所示装置(缺少收集装置,夹持固定装置略去)制备并收集甲。

①在图中方框内绘出用烧瓶收集甲的仪器装置简图_______ 。
②试管中的试剂是_______ (填写化学式)。
③烧杯中溶液由无色变为红色,其原因是_______ (用电离方程式表示)
(3)磷在Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外层不全是8电子结构,丁的化学式是_______ 。
(4)单质Z与过量的共价化合物甲反应有白烟生成,写出反应的化学方程式:_______ 。
(5)n mol丁与n mol丙在一定条件下反应,生成4n mol乙和另一化合物,该化合物蒸气的密度是相同状况下氢气的174倍,其化学式是_______ 。

已知:a.常见双原子单质分子中,X分子含共价键最多。b.甲分子中含10个电子,乙分子含有18个电子。
(1)X的电子式是
(2)实验室可用如图所示装置(缺少收集装置,夹持固定装置略去)制备并收集甲。

①在图中方框内绘出用烧瓶收集甲的仪器装置简图
②试管中的试剂是
③烧杯中溶液由无色变为红色,其原因是
(3)磷在Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外层不全是8电子结构,丁的化学式是
(4)单质Z与过量的共价化合物甲反应有白烟生成,写出反应的化学方程式:
(5)n mol丁与n mol丙在一定条件下反应,生成4n mol乙和另一化合物,该化合物蒸气的密度是相同状况下氢气的174倍,其化学式是
您最近一年使用:0次
8 . 已知A、B、C、D、E、F、G是原子序数依次增大的短周期主族元素,已知A的某种原子核内没有中子,A和D,C和F分别为同一主族元素,B原子的最外层电子数比次外层多3,E的最高价氧化物的水化物既可以和强酸反应也可以和强碱溶液反应,F的单质常出现在火山口。
(1)C、D分别形成的简单离子中,半径较大的是______ (填离子符号)。
(2)F和G的最高价氧化物的水化物酸性较强的是_______ (填化学式)。
(3)由A、B形成的18e-化合物的化学式为_______ ;由C、D形成摩尔质量为78g/mol化合物的电子式为_____ 。
(4)D、E的最高价氧化物的水化物相互反应的化学方程式为______ 。
(5)由B、G形成的化合物分子中,B和G原子的最外层均达到8电子稳定结构,该化合物遇水可反应生成一种具有漂白性的化合物,写出反应的化学方程式______ 。
(1)C、D分别形成的简单离子中,半径较大的是
(2)F和G的最高价氧化物的水化物酸性较强的是
(3)由A、B形成的18e-化合物的化学式为
(4)D、E的最高价氧化物的水化物相互反应的化学方程式为
(5)由B、G形成的化合物分子中,B和G原子的最外层均达到8电子稳定结构,该化合物遇水可反应生成一种具有漂白性的化合物,写出反应的化学方程式
您最近一年使用:0次
名校
解题方法
9 . 短周期主族元素X、Y、Z、W原子序数依次增大,X的单质是空气中含量最高的气体,Y的焰色反应现象为黄色。Z为金属元素,由Z制得的容器常温下可盛装浓硫酸。W原子最外层比X原子最外层多2个电子。
(1)X在元素周期表中的位置为___________ ,X单质的结构式为___________ 。
(2)W的简单气态氢化物电子式是___________ ,该气态氢化物溶于水时,破坏的化学键是___________ 。
(3)Y、Z、W的原子半径从大到小的顺序是___________ (用元素符号表示)。Y的最高价氧化物的水化物和Z的最高价氧化物的水化物反应的离子方程式是___________ 。
(1)X在元素周期表中的位置为
(2)W的简单气态氢化物电子式是
(3)Y、Z、W的原子半径从大到小的顺序是
您最近一年使用:0次
2020-07-03更新
|
284次组卷
|
5卷引用:广西崇左市高级中学2021-2022学年高二上学期开学考试化学试题
10 . A、B、C、D、E、F、G、H是周期表中前四周期的七种元素,B、C、D、E、H同周期,有关性质或结构信息如表:
(1)F元素位于周期表中的位置___ ,其最简单氢化物的电子式为___ 。
(2)B元素形成的单质与C元素的最高价氧化物的水化物反应的化学方程式___ 。
(3)A、B、C所形成简单离子半径由大到小的顺序是___ (填离子符号),G的原子结构示意图为___ ,D、E、H的简单氢化物的稳定性由高到低的顺序为___ 。(填化学式)
| 元素 | 有关性质或结构信息 |
| A | A元素形成的单质能使带火星的木条复燃 |
| B | B元素是地壳中含量最多的金属元素 |
| C | C与B同周期,且是所在周期中原子半径最大的(稀有气体除外) |
| D | D原子最外层电子数是电子层数的2倍,其氢化物有臭鸡蛋气味 |
| E | E形成的单质是气体且颜色呈黄绿色 |
| F | F的最简单氢化物在工业生产中常做制冷剂 |
| G | G是形成化合物种类最多的元素 |
| H | H与F同主族 |
(2)B元素形成的单质与C元素的最高价氧化物的水化物反应的化学方程式
(3)A、B、C所形成简单离子半径由大到小的顺序是
您最近一年使用:0次



