名校
解题方法
1 . A、B、C、D、E、F为原子序数依次增大的六种短周期主族元素。已知:A是宇宙中含量最高的元素;B、C形成的化合物是形成酸雨的主要物质;D、E、F为同周期元素,它们的最高价氧化物的水化物均可两两反应。用元素符号回答下列问题:
(1)元素C原子核内质子数比中子数少2个,满足该条件的原子符号为_______ ;元素E在周期中的位置:_______ 。
(2)若元素F的单质是一种黄绿色气体,常温时由F形成的最高价氧化物甲是一种液态物质,将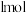 甲完全溶于水形成溶液时放出
甲完全溶于水形成溶液时放出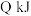 的热量,写出该过程的热化学反应方程式
的热量,写出该过程的热化学反应方程式_______ ;若元素F的单质是一种黄色固体,下列表述中能证明元素C的非金属性强于F的是_______ (填写序号)。
①元素C和F形成的化合物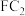 中,F化合价为
中,F化合价为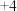 ,C化合价为
,C化合价为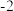
②元素C、F各自形成的最简单氢化物的沸点:前者>后者
③常温时,元素C的单质为气态,F的单质为固态
④元素C的单质可将F从其氢化物溶液中置换出来
(3)元素A、B可形成一种离子化合物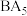 ,该化合物的电子式为
,该化合物的电子式为_______ 。
(4)用高能射线照射A、C形成的10电子分子时,一个分子能释放一个电子,同时产生一种具有较高氧化性的阳离子,试写出该阳离子的化学式_______ ,该阳离子存在的化学键类型有_______ 。
(5)写出元素D、E的最高价氧化物的水化物相互反应的离子方程式_______ 。
(1)元素C原子核内质子数比中子数少2个,满足该条件的原子符号为
(2)若元素F的单质是一种黄绿色气体,常温时由F形成的最高价氧化物甲是一种液态物质,将
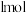 甲完全溶于水形成溶液时放出
甲完全溶于水形成溶液时放出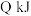 的热量,写出该过程的热化学反应方程式
的热量,写出该过程的热化学反应方程式①元素C和F形成的化合物
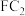 中,F化合价为
中,F化合价为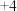 ,C化合价为
,C化合价为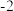
②元素C、F各自形成的最简单氢化物的沸点:前者>后者
③常温时,元素C的单质为气态,F的单质为固态
④元素C的单质可将F从其氢化物溶液中置换出来
(3)元素A、B可形成一种离子化合物
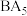 ,该化合物的电子式为
,该化合物的电子式为(4)用高能射线照射A、C形成的10电子分子时,一个分子能释放一个电子,同时产生一种具有较高氧化性的阳离子,试写出该阳离子的化学式
(5)写出元素D、E的最高价氧化物的水化物相互反应的离子方程式
您最近一年使用:0次
2023-05-11更新
|
580次组卷
|
2卷引用:湖南省岳阳市岳阳县第一中学2023-2024学年高一下学期4月期中考试化学试题
名校
2 . W、Q、X、Y、Z是原子序数依次增大的短周期主族元素,其最外层电子数之和为19,W只有一个电子层,Q与X、Y、Z位于不同周期,X、Y相邻,Y原子最外层电子数是Q原子内层电子数的2倍,仅由Z元素形成的固体在常温下为淡黄色。回答下列问题:
(1)Y在元素周期表中的位置为_______ 。
(2)最简单氢化物的沸点:Q_______ (填“>”、“<”或“=”)Z。
(3)写出X元素形成的单质与Q的最高价氧化物对应的水化物的稀溶液发生反应的离子方程式:_______ 。
(4)仅由W、Q、Z三种元素可形成化合物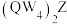 和
和 :
:
①化合物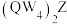 的名称为
的名称为_______ ,该化合物中Q元素的化合价为_______ 价。
②化合物 含有化学键的类型为
含有化学键的类型为_______ (填“离子键”、“共价键”或“离子键与共价键”)。
(5)化合物 与热水反应仅生成X的最高价氧化物对应的水化物和一种具有臭鸡蛋气味的气体,写出其化学方程式:
与热水反应仅生成X的最高价氧化物对应的水化物和一种具有臭鸡蛋气味的气体,写出其化学方程式:_______ 。
(6)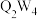 可用作火箭的燃料,1 mol
可用作火箭的燃料,1 mol 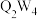 中所含的电子总数为
中所含的电子总数为_______  。
。
(1)Y在元素周期表中的位置为
(2)最简单氢化物的沸点:Q
(3)写出X元素形成的单质与Q的最高价氧化物对应的水化物的稀溶液发生反应的离子方程式:
(4)仅由W、Q、Z三种元素可形成化合物
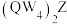 和
和 :
:①化合物
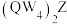 的名称为
的名称为②化合物
 含有化学键的类型为
含有化学键的类型为(5)化合物
 与热水反应仅生成X的最高价氧化物对应的水化物和一种具有臭鸡蛋气味的气体,写出其化学方程式:
与热水反应仅生成X的最高价氧化物对应的水化物和一种具有臭鸡蛋气味的气体,写出其化学方程式:(6)
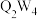 可用作火箭的燃料,1 mol
可用作火箭的燃料,1 mol 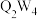 中所含的电子总数为
中所含的电子总数为 。
。
您最近一年使用:0次
2023-03-17更新
|
282次组卷
|
3卷引用:湖南省长沙市长沙市实验中学2022-2023学年高一下学期第一次月考化学试题
名校
解题方法
3 . X、Y、Z、W、R、Q为原子序数依次增大的六种短周期主族元素。X是原子半径最小的元素;Y原子最外层电子数是核外电子层数的3倍;Z是短周期中金属性最强的元素;W是地壳中含量最多的金属元素;R的最高正价与最低负价代数和为4。请回答下列问题:
(1)Y的元素名称是______ 。
(2)W在周期表中的位置是______ 。
(3)写出化合物Z2R的电子式______ 。
(4)写出化合物X2Y2的结构式______ 。
(5)Y、Z、W三种元素对应的简单离子半径由大到小的顺序是______ (用元素的离子符号表示)。
(6)下列说法能证明非金属性Q强于R的是______ (填序号)。
a.简单阴离子的还原性:Q>R
b.简单氢化物热稳定性:Q>R
c.氧化物对应的水化物的酸性: Q>R
(7)W的单质与Z的最高价氧化物对应的水化物反应的化学方程式是______ 。
(1)Y的元素名称是
(2)W在周期表中的位置是
(3)写出化合物Z2R的电子式
(4)写出化合物X2Y2的结构式
(5)Y、Z、W三种元素对应的简单离子半径由大到小的顺序是
(6)下列说法能证明非金属性Q强于R的是
a.简单阴离子的还原性:Q>R
b.简单氢化物热稳定性:Q>R
c.氧化物对应的水化物的酸性: Q>R
(7)W的单质与Z的最高价氧化物对应的水化物反应的化学方程式是
您最近一年使用:0次
2021-01-19更新
|
590次组卷
|
5卷引用:湖南省衡阳县四中2022-2023学年高二上学期开学摸底考试化学试题(A卷)
4 . 已知A、B、C、D、E是原子序数依次增大的短周期主族元素,F是第四周期元素。其中A是宇宙中含量最多的元素;B元素原子最高能级的不同轨道都有电子,并且自旋方向相同;C元素原子的价层电子排布是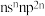 ;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。
;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。
(1)请用元素符号 完成下列空白:
①元素:A___________ 、D___________ 、F___________
②B、C两种元素第一电离能的大小关系为:___________
(2)元素F的基态价层电子排布式是:___________
(3)下表是A~F元素中某种元素的部分电离能,由此可判断该元素是___________
(4)F元素位于周期表的___________ 区。
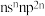 ;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。
;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其价层电子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。(1)请用
①元素:A
②B、C两种元素第一电离能的大小关系为:
(2)元素F的基态价层电子排布式是:
(3)下表是A~F元素中某种元素的部分电离能,由此可判断该元素是
电离能( ) ) | I1 | I2 | I3 | I4 | I5 |
| 某种元素 | 578 | 1817 | 2745 | 11575 | 14830 |
您最近一年使用:0次
名校
解题方法
5 . 部分短周期主族元素的原子半径和主要化合价的关系如图所示,其中E、G、T位于同一周期。回答下列问题:

(1)B位于第_______ 周期第______ 族。
(2)FDB的电子式为_______ ;T的原子结构示意图为_______ 。
(3)设计简单实验证明D的非金属性比C的强:________ 。
(4)A和D的简单氢化物相遇产生“白烟”,其生成物的化学式是_______ 。
(5)在上述元素的最高价氧化物对应的水化物中,酸性最强的是_______ (填化学式,下同),碱性最强的是_______ ;上述非金属元素的简单氢化物中,沸点最高的是_______ ,还原性最强的是_______ 。
(6)G、D的最高价氧化物对应的水化物之间发生反应的化学方程式为_______ 。

(1)B位于第
(2)FDB的电子式为
(3)设计简单实验证明D的非金属性比C的强:
(4)A和D的简单氢化物相遇产生“白烟”,其生成物的化学式是
(5)在上述元素的最高价氧化物对应的水化物中,酸性最强的是
(6)G、D的最高价氧化物对应的水化物之间发生反应的化学方程式为
您最近一年使用:0次
2023-10-27更新
|
174次组卷
|
2卷引用:湖南省炎德·英才·名校联考联合体2023-2024学年高三上学期第三次联考化学试题
名校
6 . 下图是元素周期表的一部分。按要求填写下列空白:

(1)元素⑦在周期表中的位置为_______ 。
(2)④、⑧、⑨的简单离子半径的大小顺序为_______ (填离子符号)。
(3)①~⑩元素的最高价氧化物对应的水化物中,酸性最强的是_______ (填化学式)。
(4)④⑧⑨三种元素形成的气态氢化物稳定性由大到小的顺序是_______ (用化学式表示)。
(5)⑤的最高价氧化物对应的水化物中所含的化学键为_______ ;③的氢化物的电子式为_______ 。
(6)为了证明⑤和⑥两种元素的金属性强弱,下列说法或实验能提供证据的是_______ 。
A.比较两种元素的单质的熔点、沸点高低
B.将两种元素的单质分别与冷水反应,观察反应的剧烈程度
C.比较两种元素的最高价氧化物对应的水化物的碱性强弱

(1)元素⑦在周期表中的位置为
(2)④、⑧、⑨的简单离子半径的大小顺序为
(3)①~⑩元素的最高价氧化物对应的水化物中,酸性最强的是
(4)④⑧⑨三种元素形成的气态氢化物稳定性由大到小的顺序是
(5)⑤的最高价氧化物对应的水化物中所含的化学键为
(6)为了证明⑤和⑥两种元素的金属性强弱,下列说法或实验能提供证据的是
A.比较两种元素的单质的熔点、沸点高低
B.将两种元素的单质分别与冷水反应,观察反应的剧烈程度
C.比较两种元素的最高价氧化物对应的水化物的碱性强弱
您最近一年使用:0次
2023-01-31更新
|
189次组卷
|
2卷引用:湖南省永州市第一中学2022-2023学年高一上学期期末阶段性考试化学试题
7 . 现有X、Y、Z三种属于元素周期表前18种的元素,X的单质可以在Z的单质中燃烧,生成XZ,燃烧时火焰为苍白色;X的单质也可以与Y的单质化合,生成常温下为液体的X2Y;Z的单质溶于X2Y中,生成一种含X、Y、Z三种元素的物质,具有强氧化性,可用于自来水的消毒。根据以上信息,完成下列问题:
(1)画出Z的原子结构示意图为____________ 。
(2)将XZ的水溶液滴入NaHCO3溶液中,有气泡产生,反应的离子方程式为____________ 。
(3)实验室可用X、Y两种元素组成的另外一种化合物来制备Y的单质,试写出该反应的化学方程式______ ;若生成11.2 L(标准状况)的Y的单质,则转移的电子的物质的量为____________ 。
(4)据报道:“84”消毒液(主要成分是NaClO)与“洁厕灵”(主要成分是XZ)混用,释放出一种有毒气体,发生中毒事件。试用离子方程式表示其原因__________ 。
(5)试写出Z的单质溶于X2Y中反应的化学方程式为_____________ 。
(6)由Y与Z组成的化合物ZY2,已成为一种新型自来水消毒剂。从物质的分类角度分析,化合物ZY2属于___________ 。
(1)画出Z的原子结构示意图为
(2)将XZ的水溶液滴入NaHCO3溶液中,有气泡产生,反应的离子方程式为
(3)实验室可用X、Y两种元素组成的另外一种化合物来制备Y的单质,试写出该反应的化学方程式
(4)据报道:“84”消毒液(主要成分是NaClO)与“洁厕灵”(主要成分是XZ)混用,释放出一种有毒气体,发生中毒事件。试用离子方程式表示其原因
(5)试写出Z的单质溶于X2Y中反应的化学方程式为
(6)由Y与Z组成的化合物ZY2,已成为一种新型自来水消毒剂。从物质的分类角度分析,化合物ZY2属于
您最近一年使用:0次
2020-11-16更新
|
612次组卷
|
5卷引用:湖南省三湘名校教育联盟2020-2012学年高一上学期期中考试化学试题
湖南省三湘名校教育联盟2020-2012学年高一上学期期中考试化学试题(已下线)4.2.2 元素周期表和元素周期律的应用(重点练)-2020-2021学年高一化学上学期十分钟同步课堂专练(人教版2019必修第一册)(已下线)4.2.2 元素周期表和元素周期律的应用-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)山西省朔州市怀仁市大地学校2020-2021学年高一上学期第四次月考化学试题(已下线)专题4.2.2 元素周期表和周期律的应用(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)
名校
8 . Ⅰ.现有部分短周期元素X、Y、Z、W,原子序数依次增大,四种元素的性质或原子结构如下表。
(1)写出元素X的气态氢化物的电子式___________ 。
(2)Y元素在周期表中的位置为___________ ,元素W的离子结构示意图为___________ 。
(3)下列事实能说明W元素的非金属性比 元素的非金属性弱的是___________(填标号)。
元素的非金属性弱的是___________(填标号)。
(4)Z与 反应生成
反应生成 的最高价化合物,恢复至室温,放热
的最高价化合物,恢复至室温,放热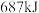 ,已知该化合物的熔、沸点分别为
,已知该化合物的熔、沸点分别为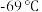 和
和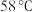 ,写出该反应的热化学方程式:
,写出该反应的热化学方程式:___________ 。
Ⅱ.化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染。
(5)电化学降解 的原理如图所示。
的原理如图所示。

①左侧 电极为
电极为___________ (填“阳极”或“阴极”),阳极的反应式为___________ 。
②若电解过程中转移了 电子,则理论上膜右侧电解液的质量变化为
电子,则理论上膜右侧电解液的质量变化为___________ g。
| 元素编号 | 元素性质或原子结构 |
| X | L层电子数比K层电子数多3 |
| Y | Y的氧化物既能与强酸反应,又能与强碱反应 |
| Z | Z与Y元素相邻 |
| W | 常温下, 的最高价含氧酸的 的最高价含氧酸的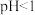 |
(2)Y元素在周期表中的位置为
(3)下列事实能说明W元素的非金属性比
 元素的非金属性弱的是___________(填标号)。
元素的非金属性弱的是___________(填标号)。A. 与 与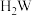 溶液反应,溶液变浑浊 溶液反应,溶液变浑浊 |
B.在氧化还原反应中,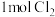 比 比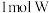 得电子多 得电子多 |
C. 和W两元素的简单氢化物受热分解,前者的分解温度高 和W两元素的简单氢化物受热分解,前者的分解温度高 |
D. 和W对应的单质分别与 和W对应的单质分别与 反应, 反应, 把 把 氧化到更高的价态 氧化到更高的价态 |
 反应生成
反应生成 的最高价化合物,恢复至室温,放热
的最高价化合物,恢复至室温,放热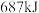 ,已知该化合物的熔、沸点分别为
,已知该化合物的熔、沸点分别为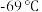 和
和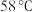 ,写出该反应的热化学方程式:
,写出该反应的热化学方程式:Ⅱ.化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染。
(5)电化学降解
 的原理如图所示。
的原理如图所示。
①左侧
 电极为
电极为②若电解过程中转移了
 电子,则理论上膜右侧电解液的质量变化为
电子,则理论上膜右侧电解液的质量变化为
您最近一年使用:0次
名校
9 . A、B、C、D、E、F是原子序数依次增大的前20号元素。元素A的周期数、主族序数、原子序数均相等;元素B的最高价氧化物对应水化物的化学式为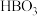 ;元素C与E同主族,且E元素原子的最外层电子数比次外层少2个,E、F两元素可形成化合物
;元素C与E同主族,且E元素原子的最外层电子数比次外层少2个,E、F两元素可形成化合物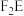 ;D、E、F三种元素的最高价氧化物对应水化物之间以两两反应。
;D、E、F三种元素的最高价氧化物对应水化物之间以两两反应。
(1)F在周期表中的位置为:_______ ,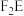 中F离子的结构示意图为
中F离子的结构示意图为_______ 。
(2)气态化合物 的电子式为
的电子式为_______ ,将 通入滴有酚酞的水中,溶液变红,用电离方程式解释此现象
通入滴有酚酞的水中,溶液变红,用电离方程式解释此现象_______ 。
(3)B、C、D三种元素的离子半径由大到小的顺序为:_______ (用离子符号表示)
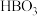 ;元素C与E同主族,且E元素原子的最外层电子数比次外层少2个,E、F两元素可形成化合物
;元素C与E同主族,且E元素原子的最外层电子数比次外层少2个,E、F两元素可形成化合物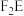 ;D、E、F三种元素的最高价氧化物对应水化物之间以两两反应。
;D、E、F三种元素的最高价氧化物对应水化物之间以两两反应。(1)F在周期表中的位置为:
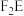 中F离子的结构示意图为
中F离子的结构示意图为(2)气态化合物
 的电子式为
的电子式为 通入滴有酚酞的水中,溶液变红,用电离方程式解释此现象
通入滴有酚酞的水中,溶液变红,用电离方程式解释此现象(3)B、C、D三种元素的离子半径由大到小的顺序为:
您最近一年使用:0次
2022-01-23更新
|
173次组卷
|
2卷引用:湖南省邵阳市邵东市2021-2022学年高一上学期期末统考化学试题
名校
解题方法
10 . A、B、C、D、E、F是六种短周期元素,它们的原子序数依次增大;A元素的原子半径最小:B元素的一种单质是空气中含量最多的一种成分:D与A同主族;F元素原子的最外层电子数是其次外层电子数的 ;A、B、D、F这四种元素,每一种都能与C元素形成原子个数比不相同的化合物。D、E、F三种元素最高价氧化物对应的水化物两两之间皆能反应。请回答下列问题:
;A、B、D、F这四种元素,每一种都能与C元素形成原子个数比不相同的化合物。D、E、F三种元素最高价氧化物对应的水化物两两之间皆能反应。请回答下列问题:
(1)B元素的原子结构示意图___________ ;E元素在周期表中的位置是___________ 。
(2)上述6种元素中,金属性最强的元素是___________ (写元素名称,下同):非金属性最强的元素是___________ 。
(3)A、B、C和F可组成一种化合物,其原子个数之比为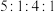 。写出该化合物的化学式
。写出该化合物的化学式___________ 。
(4)写出含E元素的氧化物与氢氧化钠溶液反应的离子方程式___________ 。
(5)由C、D两种元素形成的原子个数之比为 的化合物中,所含化学键的类型有
的化合物中,所含化学键的类型有___________ 。
 ;A、B、D、F这四种元素,每一种都能与C元素形成原子个数比不相同的化合物。D、E、F三种元素最高价氧化物对应的水化物两两之间皆能反应。请回答下列问题:
;A、B、D、F这四种元素,每一种都能与C元素形成原子个数比不相同的化合物。D、E、F三种元素最高价氧化物对应的水化物两两之间皆能反应。请回答下列问题:(1)B元素的原子结构示意图
(2)上述6种元素中,金属性最强的元素是
(3)A、B、C和F可组成一种化合物,其原子个数之比为
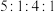 。写出该化合物的化学式
。写出该化合物的化学式(4)写出含E元素的氧化物与氢氧化钠溶液反应的离子方程式
(5)由C、D两种元素形成的原子个数之比为
 的化合物中,所含化学键的类型有
的化合物中,所含化学键的类型有
您最近一年使用:0次
2022-01-19更新
|
171次组卷
|
2卷引用:湖南省衡阳市衡阳县2021-2022学年高一上学期期末考试化学试题



