名校
解题方法
1 . A、B、C、D、E、F、G是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如表所示,请回答下列问题。
(1)A在元素周期表中的位置为___________ ,画出基态B原子的轨道表示式___________ 。
(2)B的简单气态氢化物的沸点___________ (填“高于”或“低于”)PH3,原因是___________ 。
(3)A、B、C三种元素的电负性由高到低的排列次序为___________ (用元素符号表示)。
(4)已知元素A、B形成的 链状分子中所有的原子都满足8电子稳定结构,则其分子中
链状分子中所有的原子都满足8电子稳定结构,则其分子中 键与
键与 键数目之比为
键数目之比为___________ 。
(5)G元素可形成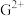 、
、 ,其中较稳定的是
,其中较稳定的是 ,原因是
,原因是___________ 。
(6)短周期元素 与元素
与元素 在周期表中的位置呈现对角线关系,已知元素
在周期表中的位置呈现对角线关系,已知元素 、
、 的电负性分别为1.5和3.0,预测它们形成的化合物是
的电负性分别为1.5和3.0,预测它们形成的化合物是___________ (填“离子”或“共价”)化合物。推测 的最高价氧化物对应的水化物
的最高价氧化物对应的水化物___________ (填“能”或“不能”)与 的最高价氧化物对应水化物发生反应。
的最高价氧化物对应水化物发生反应。
| A | 原子核外有6个电子 |
| B | 原子序数比 大1 大1 |
| C | 基态原子中 电子总数与p电子总数相等 电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子价层电子排布式为3s23p1 |
| F | 基态原子的最外层p 轨道有2个电子的自旋状态与其他电子的自旋状态相反 |
| G | 生活中使用最多的一种金属,其高价氯化物的盐溶液常用于刻蚀铜制印刷电路板 |
(2)B的简单气态氢化物的沸点
(3)A、B、C三种元素的电负性由高到低的排列次序为
(4)已知元素A、B形成的
 链状分子中所有的原子都满足8电子稳定结构,则其分子中
链状分子中所有的原子都满足8电子稳定结构,则其分子中 键与
键与 键数目之比为
键数目之比为(5)G元素可形成
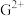 、
、 ,其中较稳定的是
,其中较稳定的是 ,原因是
,原因是(6)短周期元素
 与元素
与元素 在周期表中的位置呈现对角线关系,已知元素
在周期表中的位置呈现对角线关系,已知元素 、
、 的电负性分别为1.5和3.0,预测它们形成的化合物是
的电负性分别为1.5和3.0,预测它们形成的化合物是 的最高价氧化物对应的水化物
的最高价氧化物对应的水化物 的最高价氧化物对应水化物发生反应。
的最高价氧化物对应水化物发生反应。
您最近一年使用:0次
2022-07-25更新
|
964次组卷
|
3卷引用:宁夏石嘴山市第三中学2023-2024学年高二下学期3月月考化学试题
名校
2 . 下表为元素周期表的一部分,请参照元素 在表中的位置,用相应化学用语回答下列问题:
在表中的位置,用相应化学用语回答下列问题:
(1)画出表中形成化合物种类最多元素的原子结构示意图______ ;写出它与原子半径最小的原子形成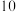 电子且为正四面体结构的化合物的电子式
电子且为正四面体结构的化合物的电子式______ ,用电子式表示 和
和 形成化合物的过程
形成化合物的过程______ 。
(2) 形成的简单离子半径由大到小的顺序为
形成的简单离子半径由大到小的顺序为______  填离子符号
填离子符号 ;
;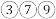 的最高价氧化物对应水化物的酸性由强到弱的顺序为
的最高价氧化物对应水化物的酸性由强到弱的顺序为______  填化学式
填化学式 。
。
(3)这些元素形成的氧化物中,不溶于水,但既能与强酸又能与强碱反应的是______  填化学式
填化学式 ,写出它与
,写出它与 的最高价氧化物对应水化物发生反应的离子方程式:
的最高价氧化物对应水化物发生反应的离子方程式:______ 。
(4)有两种化合物 和
和 都由
都由 四种元素组成.若
四种元素组成.若 与
与 在水溶液中能发生离子反应,则该反应的离子方程式为
在水溶液中能发生离子反应,则该反应的离子方程式为 ______ 。
 在表中的位置,用相应化学用语回答下列问题:
在表中的位置,用相应化学用语回答下列问题:
(1)画出表中形成化合物种类最多元素的原子结构示意图
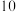 电子且为正四面体结构的化合物的电子式
电子且为正四面体结构的化合物的电子式 和
和 形成化合物的过程
形成化合物的过程(2)
 形成的简单离子半径由大到小的顺序为
形成的简单离子半径由大到小的顺序为 填离子符号
填离子符号 ;
;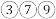 的最高价氧化物对应水化物的酸性由强到弱的顺序为
的最高价氧化物对应水化物的酸性由强到弱的顺序为 填化学式
填化学式 。
。(3)这些元素形成的氧化物中,不溶于水,但既能与强酸又能与强碱反应的是
 填化学式
填化学式 ,写出它与
,写出它与 的最高价氧化物对应水化物发生反应的离子方程式:
的最高价氧化物对应水化物发生反应的离子方程式:(4)有两种化合物
 和
和 都由
都由 四种元素组成.若
四种元素组成.若 与
与 在水溶液中能发生离子反应,则该反应的离子方程式为
在水溶液中能发生离子反应,则该反应的离子方程式为
您最近一年使用:0次
2023-07-30更新
|
200次组卷
|
3卷引用:宁夏回族自治区银川市宁夏育才中学2023-2024学年高一上学期1月期末考试化学试题
名校
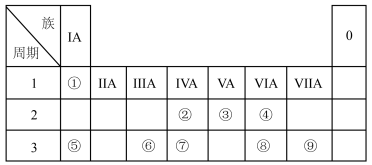
3 . 下图是元素周期表的一部分。按要求填写下列空白:

(1)元素⑦在周期表中的位置为_______ 。
(2)④、⑧、⑨的简单离子半径的大小顺序为_______ (填离子符号)。
(3)①~⑩元素的最高价氧化物对应的水化物中,酸性最强的是_______ (填化学式)。
(4)④⑧⑨三种元素形成的气态氢化物稳定性由大到小的顺序是_______ (用化学式表示)。
(5)⑤的最高价氧化物对应的水化物中所含的化学键为_______ ;③的氢化物的电子式为_______ 。
(6)为了证明⑤和⑥两种元素的金属性强弱,下列说法或实验能提供证据的是_______ 。
A.比较两种元素的单质的熔点、沸点高低
B.将两种元素的单质分别与冷水反应,观察反应的剧烈程度
C.比较两种元素的最高价氧化物对应的水化物的碱性强弱

(1)元素⑦在周期表中的位置为
(2)④、⑧、⑨的简单离子半径的大小顺序为
(3)①~⑩元素的最高价氧化物对应的水化物中,酸性最强的是
(4)④⑧⑨三种元素形成的气态氢化物稳定性由大到小的顺序是
(5)⑤的最高价氧化物对应的水化物中所含的化学键为
(6)为了证明⑤和⑥两种元素的金属性强弱,下列说法或实验能提供证据的是
A.比较两种元素的单质的熔点、沸点高低
B.将两种元素的单质分别与冷水反应,观察反应的剧烈程度
C.比较两种元素的最高价氧化物对应的水化物的碱性强弱
您最近一年使用:0次
2023-01-31更新
|
189次组卷
|
2卷引用:宁夏青铜峡市宁朔中学2022-2023学年高一下学期3月月考化学试题
名校
解题方法
4 . 元素周期表是化学知识的宝库,它的内涵十分丰富。如表是a~m九种元素在周期表中的位置,请回答下列问题:
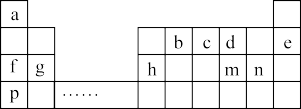
(1)m的阴离子结构示意图为____ 。
(2)d与a元素的原子按1:1结合的化合物的电子式____ 。
(3)b的最高价氧化物的结构式为____ 。
(4)d、g、n形成的简单离子的半径由大到小的顺序为____ (用离子符号填写)。
(5)f、g、p的最高价氧化物的水化物碱性从强到弱的顺序为____ (填化学式)。
(6)p和n两种元素最高价氧化物的水化物相互反应的离子反应方程式为____ 。
(7)c的氢化物和c的最高价氧化物对应水化物之间反应能生成盐M,M中含有的化学键类型有____ 。
(8)“类铝”在门捷列夫预言4年后,被布瓦博德朗在一种矿石中发现,命名为镓(Ga)。由镓的性质推知,镓与铝同主族,且位于h的下一周期。镓在周期表中的位置____ 。冶炼金属镓通常采用的方法是____ 。

(1)m的阴离子结构示意图为
(2)d与a元素的原子按1:1结合的化合物的电子式
(3)b的最高价氧化物的结构式为
(4)d、g、n形成的简单离子的半径由大到小的顺序为
(5)f、g、p的最高价氧化物的水化物碱性从强到弱的顺序为
(6)p和n两种元素最高价氧化物的水化物相互反应的离子反应方程式为
(7)c的氢化物和c的最高价氧化物对应水化物之间反应能生成盐M,M中含有的化学键类型有
(8)“类铝”在门捷列夫预言4年后,被布瓦博德朗在一种矿石中发现,命名为镓(Ga)。由镓的性质推知,镓与铝同主族,且位于h的下一周期。镓在周期表中的位置
您最近一年使用:0次
解题方法
5 . A、B、D、E、F、G为短周期主族元素,且原子序数依次递增。A位于第一周期,短周期中,F的氢氧化物碱性最强,E、G同主族。A与其他非金属元素化合时易形成共价键,F与其他非金属元素化合时易形成离子键,且F+与E2-核外电子排布相同。由以上元素组成的物质BE和D2具有相同的电子数。请回答下列问题:
(1)B位于第_____ 周期_____ 族。
(2)G的离子结构示意图为____ 。
(3)BE2的电子式为_____ 。
(4)由A、E、F三种元素形成的化合物的化学式为_____ ,含有的化学键有_____ (填写完整化学键类型),属于_____ 化合物。
(5)写出F2E2与水反应的化学方程式_____ 。
(1)B位于第
(2)G的离子结构示意图为
(3)BE2的电子式为
(4)由A、E、F三种元素形成的化合物的化学式为
(5)写出F2E2与水反应的化学方程式
您最近一年使用:0次
名校
6 . 有A、B、C、D、E、F6种短周期元素,其元素特征信息如表,回答下列问题:
(1)C元素在周期表中位置___________ 。
(2)写出D、E、F元素符号:D___________ 、E___________ 、F___________ 。
(3)写出A、B、C形成的化合物的电子式___________ ;该化合物含有的化学键类型有___________ 、___________ 。
(4)写出三种含B元素的10e-微粒___________ 、___________ 、___________ 。
(5)F的非金属性强于E,下列表述中能证明这一事实的是___________ (填字母)。
A.F的氢化物比E的氢化物稳定
B.F的单质能将E从其钠盐溶液中置换出来
| 编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,最高正化合价与最低负化合价的代数和为4 |
| F | 其最简单气态氢化物能和其最高价氧化物反应生成一种离子化合物 |
(1)C元素在周期表中位置
(2)写出D、E、F元素符号:D
(3)写出A、B、C形成的化合物的电子式
(4)写出三种含B元素的10e-微粒
(5)F的非金属性强于E,下列表述中能证明这一事实的是
A.F的氢化物比E的氢化物稳定
B.F的单质能将E从其钠盐溶液中置换出来
您最近一年使用:0次
名校
解题方法
7 . A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等.
(1)W2-离子的结构示意图为______________ ,E元素在周期表中的位置为____________ ,写出E的最高价氧化物与D的最高价氧化物的水化物反应的离子方程式____________________ 。
(2)经测定A2W2为二元弱酸,A2W2的电子式为___________ ,常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式__________________________ 。
(3)向含有Fe2+和淀粉KI的酸性溶液中滴入A2W2,观察到溶液呈蓝色并有红褐色沉淀成.当消耗2mol I﹣时,共转移3mol电子,该反应的离子方程式是_____________________ 。
(4)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,能与水反应放氢气,写出该反应方程式______________________ ,若将1molDA和1molE单质混合加入足量的水,充分反应后生成气体的体积是_________ L(标准状况下)。
(1)W2-离子的结构示意图为
(2)经测定A2W2为二元弱酸,A2W2的电子式为
(3)向含有Fe2+和淀粉KI的酸性溶液中滴入A2W2,观察到溶液呈蓝色并有红褐色沉淀成.当消耗2mol I﹣时,共转移3mol电子,该反应的离子方程式是
(4)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,能与水反应放氢气,写出该反应方程式
您最近一年使用:0次
2017-07-12更新
|
570次组卷
|
6卷引用:2017届宁夏固原一中高三上适应性训练四化学卷
名校
8 . A、B、C、D、E是位于短周期的主族元素。已知:①氢化物的稳定性HmD>HmC;②Cm−、E(m−1)−具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
(1)HmDm的电子式为_______ ,含有_______ (填“离子键”、“极性键”或“非极性键”)。
(2)Cm−、E(m−1)−的还原性强弱顺序为_______ 、离子半径大小顺序为_______ (均用离子符号表示),能证明其还原性强弱的离子方程式为_______ 。
(3)比较两种氢化物的沸点:HmD_______ HmC(填“>”或“<”),C元素在元素周期表中的位置为_______ 。
(4)用于判断C和D非金属性强弱的依据是_______。
(1)HmDm的电子式为
(2)Cm−、E(m−1)−的还原性强弱顺序为
(3)比较两种氢化物的沸点:HmD
(4)用于判断C和D非金属性强弱的依据是_______。
| A.简单气态氢化物的稳定性 | B.与氢气化合的难易程度 |
| C.得电子数目的多少 | D.最高价含氧酸的酸性 |
您最近一年使用:0次
名校
解题方法
9 . 已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它们的原子序数依次增大。A是元素周期表中原子半径最小的元素,D3B中阴、阳离子具有相同的电子层结构,B、C均可与A形成10电子分子,B、C位于同一周期,二者可以形成多种共价化合物,C、F位于同一主族元素,B元素原子最外电子层的P能级上的电子处于半满状态,C元素原子的最外层电子数是内层电子总数的3倍,E元素原子最外层电子数比最内层电子数多1。
请回答下列问题:
(1)E元素基态原子的电子排布式为___ 。
(2)F元素原子的价电子轨道表示式为___ 。
(3)F、G元素对应的最高价含氧酸中酸性较强的酸的化学式为___ 。
(4)离子半径:D+___ (填“<”“>”或“=”,下同)B3-,第一电离能:B___ C,电负性:C___ F。
(5)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比为1:1,X的电子式为___ ,试写出Cu、稀硫酸与X反应制备硫酸铜的离子方程式:___ 。
请回答下列问题:
(1)E元素基态原子的电子排布式为
(2)F元素原子的价电子轨道表示式为
(3)F、G元素对应的最高价含氧酸中酸性较强的酸的化学式为
(4)离子半径:D+
(5)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比为1:1,X的电子式为
您最近一年使用:0次
2020-04-09更新
|
250次组卷
|
3卷引用:【全国百强校】宁夏吴忠中学2017-2018学年高二6月月考化学试题
10 . X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
(1)元素X的原子中能量最高的是_______ 电子,它的氢化物的电子式是_______ 。
(2)元素Y位于元素周期表的第三周期_______ 族,该原子的价电子轨道表示式为_______ 。
(3)元素Z的原子最外层共有_______ 种不同运动状态的电子。
(4)W的基态原子核外电子排布式是_______ 。
(5)元素Y与元素Z相比,非金属性较强的是_______ (用元素符号表示),下列表述中能证明这一事实的是_______ 。
a.常温下,Y的单质与Z的单质状态不同
b.等物质的量浓度的氢化物水溶液的酸性不同
c.Z的电负性大于Y
d.Z的氢化物比Y的氢化物稳定
e.在反应中,Y原子得电子数比Z原子得电子数多
f.Z元素最高价氧化物对应水化物的酸性比Y元素最高价氧化物对应水化物的酸性强
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且最高能级是半充满状态 |
| Y | 第三周期元素,它的单质是良好的半导体材料 |
| Z | Z和Y同周期,Z是本周期原子半径最小的主族元素 |
| W | W的一种核素的质量数为63,中子数为34 |
(2)元素Y位于元素周期表的第三周期
(3)元素Z的原子最外层共有
(4)W的基态原子核外电子排布式是
(5)元素Y与元素Z相比,非金属性较强的是
a.常温下,Y的单质与Z的单质状态不同
b.等物质的量浓度的氢化物水溶液的酸性不同
c.Z的电负性大于Y
d.Z的氢化物比Y的氢化物稳定
e.在反应中,Y原子得电子数比Z原子得电子数多
f.Z元素最高价氧化物对应水化物的酸性比Y元素最高价氧化物对应水化物的酸性强
您最近一年使用:0次



