名校
解题方法
1 . 现有A、B、C、D、E、F、G、H、I九种元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
A:核外电子数和电子层数相等,也是宇宙中最丰富的元素
B:形成化合物种类最多的元素
C:基态原子的核外p能级电子数比s能级电子数少1
D:基态原子的核外p轨道中有两个未成对电子
E:气态基态原子的第一至第四电离能分别是:I1=738 kJ/mol,I2=1451 kJ/mol,I3=7733 kJ/mol,I4=10540 kJ/mol
F:同周期元素的简单离子中半径最小
G:主族序数与周期数的差为4
H:前四周期主族元素中电负性最小
I:位于元素周期表中的第八列
(1)C2A4的电子式为_______ 。
(2)B元素的原子核外共有_______ 种不同运动状态的电子。
(3)某同学推断E元素基态原子的核外电子轨道表示式为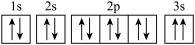 。该同学所画的轨道表示式违背了
。该同学所画的轨道表示式违背了_______ ,解释E元素原子的第一电高能大于F元素原子的第一电离能的原因:_______ 。
(4)用惰性电极电解熔融的EG2制备E单质的化学方程式为_______ 。
(5)与F元素成“对角线规则”关系的某短周期元素T的最高价氧化物的水化物具有两性,写出该两性物质与H元素的最高价氧化物的水化物反应的离子方程式:_______ ;已知T元素和Cl元素的电负性分别为1.5和3.0,则它们形成的化合物是_______ (填“离子化合物”或“共价化合物”)。
(6)与H元素同周期的基态原子中,未成对电子数与H原子相同的元素有_______ 种。
(7)I位于元素周期表中____ 区(按电子排布分区),实验室检验I3+的离子方程式为:____ 。
A:核外电子数和电子层数相等,也是宇宙中最丰富的元素
B:形成化合物种类最多的元素
C:基态原子的核外p能级电子数比s能级电子数少1
D:基态原子的核外p轨道中有两个未成对电子
E:气态基态原子的第一至第四电离能分别是:I1=738 kJ/mol,I2=1451 kJ/mol,I3=7733 kJ/mol,I4=10540 kJ/mol
F:同周期元素的简单离子中半径最小
G:主族序数与周期数的差为4
H:前四周期主族元素中电负性最小
I:位于元素周期表中的第八列
(1)C2A4的电子式为
(2)B元素的原子核外共有
(3)某同学推断E元素基态原子的核外电子轨道表示式为
 。该同学所画的轨道表示式违背了
。该同学所画的轨道表示式违背了(4)用惰性电极电解熔融的EG2制备E单质的化学方程式为
(5)与F元素成“对角线规则”关系的某短周期元素T的最高价氧化物的水化物具有两性,写出该两性物质与H元素的最高价氧化物的水化物反应的离子方程式:
(6)与H元素同周期的基态原子中,未成对电子数与H原子相同的元素有
(7)I位于元素周期表中
您最近一年使用:0次
名校
解题方法
2 . X、Y、Z、W、R、Q为原子序数依次增大的六种短周期主族元素。X是原子半径最小的元素;Y原子最外层电子数是核外电子层数的3倍;Z是短周期中金属性最强的元素;W是地壳中含量最多的金属元素;R的最高正价与最低负价代数和为4,请回答下列问题:
(1)用电子式表示 的形成过程
的形成过程______ 。
(2)W在周期表中的位置是______ 。
(3)ZYX的电子式为______ , 的结构式为
的结构式为______ ,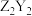 中含有的化学键类型为
中含有的化学键类型为______ 。
(4)Y、Z、W三种元素对应的简单离子半径由大到小的顺序是______ (用元素的离子符号表示)。
(5)下列说法能证明非金属性Q强于R的是______ (填字母)。
a.简单阴离子的还原性:
b.简单氢化物热稳定性:
c.氧化物对应的水化物的酸性:
(6)W的单质与Z的最高价氧化物对应的水化物反应的化学方程式是______ 。
(7)处于周期表中对角线位置(左上方和右下方)的元素,其性质具有相似性,称为“对角线规则”,写出 与氢氧化钠溶液反应的化学方程式
与氢氧化钠溶液反应的化学方程式______ 。
(1)用电子式表示
 的形成过程
的形成过程(2)W在周期表中的位置是
(3)ZYX的电子式为
 的结构式为
的结构式为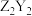 中含有的化学键类型为
中含有的化学键类型为(4)Y、Z、W三种元素对应的简单离子半径由大到小的顺序是
(5)下列说法能证明非金属性Q强于R的是
a.简单阴离子的还原性:

b.简单氢化物热稳定性:

c.氧化物对应的水化物的酸性:

(6)W的单质与Z的最高价氧化物对应的水化物反应的化学方程式是
(7)处于周期表中对角线位置(左上方和右下方)的元素,其性质具有相似性,称为“对角线规则”,写出
 与氢氧化钠溶液反应的化学方程式
与氢氧化钠溶液反应的化学方程式
您最近一年使用:0次
名校
解题方法
3 . 已知A、B、C、D、E、F、G是原子序数依次增大的短周期主族元素,已知A的某种原子核内没有中子,A和D,C和F分别为同一主族元素,B原子的最外层电子数比次外层多3,E的最高价氧化物的水化物既可以和强酸反应也可以和强碱溶液反应,F的单质常出现在火山口。
(1)C在元素周期表中的位置是___________ 。
(2)C、D分别形成的简单离子中,半径较大的是___________ (填离子符号)。
(3)F和G的最高价氧化物的水化物酸性较强的是___________ (填化学式)。
(4)由A、C、D形成的化合物中化学键的类型为___________ ,C、D形成摩尔质量为78g/mol的化合物的电子式为 ___________ 。
(5)由A、B形成18e-化合物的结构式为___________ ;该化合物可与O2组成燃料电池,写出用氢氧化钾溶液作电解质溶液时正极的电极反应式___________ 。
(6)D、E的最高价氧化物的水化物相互反应的化学方程式为___________ 。
(7)由B、G形成的化合物分子中,B和G原子的最外层均达到8电子稳定结构,该化合物遇水可反应生成一种具有漂白性的化合物,写出反应的化学方程式:___________ 。
(1)C在元素周期表中的位置是
(2)C、D分别形成的简单离子中,半径较大的是
(3)F和G的最高价氧化物的水化物酸性较强的是
(4)由A、C、D形成的化合物中化学键的类型为
(5)由A、B形成18e-化合物的结构式为
(6)D、E的最高价氧化物的水化物相互反应的化学方程式为
(7)由B、G形成的化合物分子中,B和G原子的最外层均达到8电子稳定结构,该化合物遇水可反应生成一种具有漂白性的化合物,写出反应的化学方程式:
您最近一年使用:0次
名校
4 . 短周期元素W、X、Y、Z、Q、R的原子序数依次增大,c、d、e、f、h是由这些元素组成的二元化合物,自然界中硬度最大的单质和a都由X组成,b由W、Y、Q三种元素组成,d能使品红溶液褪色,是液体,上述物质的转化关系如下图所示(个别产物略去)。请回答下列问题:
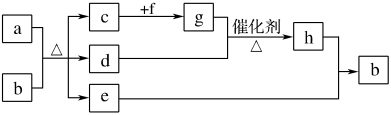
(1)R在元素周期表中的位置:_______ 。
(2)化合物f的电子式:_______ 该化合物存在的化学键种类是:_______ ;化合物c的结构式:_______ 。
(3)用电子式表示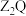 的形成过程为
的形成过程为_______ 。
(4)W、Y、Z、Q四种元素可以形成两种酸式盐(均由四种元素组成),这两种酸式盐的化学式分别为_______ 、_______ ,这两种酸式盐相互反应的离子方程式为_______ 。
(5)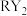 是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过
是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过 和
和 在稀硫酸酸化的环境中反应制得气体
在稀硫酸酸化的环境中反应制得气体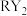 ,试写出该反应的离子反应方程式并配平:
,试写出该反应的离子反应方程式并配平:_______ 。
(6)在100mL 18mol/L b的浓溶液中加入过量的铜片,加热使之充分反应,铜片部分溶解,产生的气体在标准状况下的体积可能是_______(填序号)。

(1)R在元素周期表中的位置:
(2)化合物f的电子式:
(3)用电子式表示
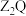 的形成过程为
的形成过程为(4)W、Y、Z、Q四种元素可以形成两种酸式盐(均由四种元素组成),这两种酸式盐的化学式分别为
(5)
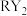 是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过
是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过 和
和 在稀硫酸酸化的环境中反应制得气体
在稀硫酸酸化的环境中反应制得气体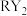 ,试写出该反应的离子反应方程式并配平:
,试写出该反应的离子反应方程式并配平:(6)在100mL 18mol/L b的浓溶液中加入过量的铜片,加热使之充分反应,铜片部分溶解,产生的气体在标准状况下的体积可能是_______(填序号)。
| A.7.32L | B.6.72L | C.20.16L | D.30.24L |
您最近一年使用:0次
名校
解题方法
5 . 现有部分从上到下原子序数依次增大的短周期主族元素,它们的元素性质或原子结构如下表所示:
回答下列问题:
(1)写出元素D在元素周期表中的位置:_______ 。
(2)元素A的一种核素可测定文物年代,这种核素是_______ (填核素符号)。B、C、D三种元素的离子半径由大到小的顺序为_______ (填离子符号)。
(3)火箭发动机曾经利用B2H4作燃料、H2C2作助燃剂,产物无污染,写出二者反应的化学方程式:_______ 。
(4)元素C的单质与钠在常温下生成物质X。用电子式表示物质X的形成过程:_______ 。
(5)探寻物质性质的差异性是学习化学的重要方法之一。A、B、E、F四种元素的最高价氧化物对应的水化物中,酸性最强的是_______ (填化学式)。E的最高价氧化物对应的水化物溶液与D的最高价氧化物对应的水化物反应的离子方程式为_______ 。
| 元素编号 | 元素性质或原子结构 |
| A | 该元素的一种同素异形体可用作润滑剂 |
| B | 单质为空气中含量最高的气体 |
| C | 最外层电子数是最内层电子数的3倍 |
| D | 单质为一种银白色金属,通常表面有一层致密的氧化膜,保护金属不被继续腐蚀 |
| E | M层电子数是电子层数的2倍 |
| F | 元素最高正价是+7,最低价是-1 |
(1)写出元素D在元素周期表中的位置:
(2)元素A的一种核素可测定文物年代,这种核素是
(3)火箭发动机曾经利用B2H4作燃料、H2C2作助燃剂,产物无污染,写出二者反应的化学方程式:
(4)元素C的单质与钠在常温下生成物质X。用电子式表示物质X的形成过程:
(5)探寻物质性质的差异性是学习化学的重要方法之一。A、B、E、F四种元素的最高价氧化物对应的水化物中,酸性最强的是
您最近一年使用:0次
2023-10-05更新
|
217次组卷
|
2卷引用:四川省泸州市叙永第一中学校2023-2024学年高一上学期1月期末化学试题
名校
解题方法
6 . 原子序数依次增大的A、B、C、D、E五种位于不同短周期的元素,可以两两形成多种原子个数比为 的化合物,其中的甲、乙、丙、丁4种化合物有两种属于离子化合物。A、B的原子序数之和是元素D的一半。B既是蛋白质的重要组成成分,也是某种化肥的组成部分。只有C为金属元素,焰色反应呈黄色。请回答下列问题:
的化合物,其中的甲、乙、丙、丁4种化合物有两种属于离子化合物。A、B的原子序数之和是元素D的一半。B既是蛋白质的重要组成成分,也是某种化肥的组成部分。只有C为金属元素,焰色反应呈黄色。请回答下列问题:
(1)元素E在周期表中的位置是_______ 。
(2)B和D形成原子个数比为 的化合物甲,其相对分子质量在170~190之间,且D的质量分数约为70%,则该化合物的化学式为:
的化合物甲,其相对分子质量在170~190之间,且D的质量分数约为70%,则该化合物的化学式为:_______ 。
(3)A和B形成的化合物乙为 ,在一定条件下可以
,在一定条件下可以 完全电离产生两种离子,其中一种为
完全电离产生两种离子,其中一种为 的离子,该物质在一定条件下的电离方程式为
的离子,该物质在一定条件下的电离方程式为_______ 。
(4)化合物 溶液在空气中长期放置会变质生成丙
溶液在空气中长期放置会变质生成丙 ,用化学方程式表示该过程
,用化学方程式表示该过程_______ 。
(5)D和E以 形成的化合物丁中所有原子均满足
形成的化合物丁中所有原子均满足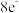 稳定结构,该化合物的电子式为
稳定结构,该化合物的电子式为_______ ;该物质遇水剧烈反应,产生有刺激性气味的混合气体X和Y,同时还有固体单质产生,已知X是能使品红溶液褪色的气体,Y在标准状态下的密度为 ,该上述过程对应的化学方程式为
,该上述过程对应的化学方程式为_______ 。某研究小组同学为确定干燥的X和Y混合气体中Y的存在,设计方案如下:把干燥的X和Y与干燥的 混合,出现白烟,则证明有Y气体,你认为此方案
混合,出现白烟,则证明有Y气体,你认为此方案_______ (填“正确”或“不正确)。
 的化合物,其中的甲、乙、丙、丁4种化合物有两种属于离子化合物。A、B的原子序数之和是元素D的一半。B既是蛋白质的重要组成成分,也是某种化肥的组成部分。只有C为金属元素,焰色反应呈黄色。请回答下列问题:
的化合物,其中的甲、乙、丙、丁4种化合物有两种属于离子化合物。A、B的原子序数之和是元素D的一半。B既是蛋白质的重要组成成分,也是某种化肥的组成部分。只有C为金属元素,焰色反应呈黄色。请回答下列问题:(1)元素E在周期表中的位置是
(2)B和D形成原子个数比为
 的化合物甲,其相对分子质量在170~190之间,且D的质量分数约为70%,则该化合物的化学式为:
的化合物甲,其相对分子质量在170~190之间,且D的质量分数约为70%,则该化合物的化学式为:(3)A和B形成的化合物乙为
 ,在一定条件下可以
,在一定条件下可以 完全电离产生两种离子,其中一种为
完全电离产生两种离子,其中一种为 的离子,该物质在一定条件下的电离方程式为
的离子,该物质在一定条件下的电离方程式为(4)化合物
 溶液在空气中长期放置会变质生成丙
溶液在空气中长期放置会变质生成丙 ,用化学方程式表示该过程
,用化学方程式表示该过程(5)D和E以
 形成的化合物丁中所有原子均满足
形成的化合物丁中所有原子均满足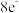 稳定结构,该化合物的电子式为
稳定结构,该化合物的电子式为 ,该上述过程对应的化学方程式为
,该上述过程对应的化学方程式为 混合,出现白烟,则证明有Y气体,你认为此方案
混合,出现白烟,则证明有Y气体,你认为此方案
您最近一年使用:0次
7 . 图A所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸,a的一种同素异形体的晶胞如图B所示。

回答下列问题:
(1)图B对应的物质名称是_________ ,其晶胞中的原子数为______ ,晶体类型为_______ 。
(2)d中元素的原子核外电子排布式为_______ 。
(3)图A中由二种元素组成的物质中,沸点最高的是______ ,原因是______ ,该物质的分子构型为_________ ,中心原子的杂化轨道类型为_________ 。
(4)图A中的双原子分子中,极性最大的分子是_________ 。
(5)k的分子式为_________ ,中心原子的杂化轨道类型为_________ ,属于_________ 分子(填“极性”或“非极性”)。

回答下列问题:
(1)图B对应的物质名称是
(2)d中元素的原子核外电子排布式为
(3)图A中由二种元素组成的物质中,沸点最高的是
(4)图A中的双原子分子中,极性最大的分子是
(5)k的分子式为
您最近一年使用:0次
2019-01-30更新
|
2543次组卷
|
13卷引用:四川省成都市树德中学2019-2020学年高二下学期期中考试化学试题
四川省成都市树德中学2019-2020学年高二下学期期中考试化学试题2013年全国普通高等学校招生统一考试化学(海南卷)(已下线)2014高考名师推荐化学--预测16云南省麻栗坡民族中学2019-2020学年高三上学期期末考试化学试题贵州省黔南布依族苗族自治州瓮安第二中学2019-2020学年高三上学期期末考试化学试题山东省济南市高新区新2019-2020学年高三化学一轮复习《物质结构与性质》专题测试(人教版2019)选择性必修2 模块复习备考攻略(已下线)专题16 物质结构与性质不丢分-2021年高考化学必做热点专题(已下线)模块同步卷08 分子晶体与原子晶体-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)云南省楚雄第一中学2022-2023学年高二下学期期末考试化学试题云南省西双版纳傣族自治州第一中学2022-2023学年高二下学期期末考试化学试题云南省龙陵县第一中学2022-2023学年高二下学期期末考试化学试题云南省玉溪市第二中学2022-2023学年高二下学期期末考试化学试题
8 . 下表是元素周期表中前四周期的部分元素,表中所列字母分别代表一种元素。
回答下列问题:
(1)i在元素周期表中的位置是__________ 。
(2)a、e、g、l形成的简单离子其半径由大到小的顺序为__________ (填写离子符号)。
(3)n与o形成的化合物为__________ (填写化学式),将该化合物进行焰色试验,火焰呈__________ 色。
(4)用电子式表示g和m形成化合物的过程__________ 。
(5)将足量d的氢化物溶于水,再取少量 的水溶液滴入其中,反应的离子方程式为
的水溶液滴入其中,反应的离子方程式为__________ 。
(6)某同学欲探究元素性质递变规律与原子结构的关系,进行如下实验:
实验操作:取已除去氧化膜且表面积相等的镁条和铝条,分别投入 盐酸中。
盐酸中。
实验现象:镁与盐酸反应比铝更剧烈。
①比较金属性:
______  (选填“>”或“<”);
(选填“>”或“<”);
②利用元素周期律对上述实验结论进行解释__________ 。
(7)向 的碱性溶液中通入m单质,可得到
的碱性溶液中通入m单质,可得到 ,反应的离子方程式为:
,反应的离子方程式为:__________ 。
a | b | |||||||
c | d | e | f | |||||
g | h | i | j | k | l | m | ||
o | n | |||||||
(1)i在元素周期表中的位置是
(2)a、e、g、l形成的简单离子其半径由大到小的顺序为
(3)n与o形成的化合物为
(4)用电子式表示g和m形成化合物的过程
(5)将足量d的氢化物溶于水,再取少量
 的水溶液滴入其中,反应的离子方程式为
的水溶液滴入其中,反应的离子方程式为(6)某同学欲探究元素性质递变规律与原子结构的关系,进行如下实验:
实验操作:取已除去氧化膜且表面积相等的镁条和铝条,分别投入
 盐酸中。
盐酸中。实验现象:镁与盐酸反应比铝更剧烈。
①比较金属性:

 (选填“>”或“<”);
(选填“>”或“<”);②利用元素周期律对上述实验结论进行解释
(7)向
 的碱性溶液中通入m单质,可得到
的碱性溶液中通入m单质,可得到 ,反应的离子方程式为:
,反应的离子方程式为:
您最近一年使用:0次
2023-02-17更新
|
194次组卷
|
3卷引用:四川省眉山市2022-2023学年高一上学期期末考试化学试题
名校
9 . 原子序数由小到大排列的四种短周期元素 、
、 、
、 、
、 ,其中
,其中 、
、 、
、 与氢元素可组成
与氢元素可组成 、
、 和
和 三种共价化合物;
三种共价化合物; 与氧元素可组成
与氧元素可组成 和
和 两种离子化合物。
两种离子化合物。
(1)写出 的电子式:
的电子式:___________ 。其中含有的化学键是___________ 。
(2)用电子式表示 的形成过程
的形成过程___________ 。
(3) 、
、 、
、 三种元素的最高价氧化物对应的水化物中,稀溶液氧化性最强的是
三种元素的最高价氧化物对应的水化物中,稀溶液氧化性最强的是___________ (填化学式)。
(4) 、
、 和
和 三种化合物,其中一种与另外两种都能反应的是
三种化合物,其中一种与另外两种都能反应的是___________ (填化学式)。
(5)由 、
、 组成的化合物分子中,
组成的化合物分子中, 、
、 原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式
原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式___________ 。
 、
、 、
、 、
、 ,其中
,其中 、
、 、
、 与氢元素可组成
与氢元素可组成 、
、 和
和 三种共价化合物;
三种共价化合物; 与氧元素可组成
与氧元素可组成 和
和 两种离子化合物。
两种离子化合物。(1)写出
 的电子式:
的电子式:(2)用电子式表示
 的形成过程
的形成过程(3)
 、
、 、
、 三种元素的最高价氧化物对应的水化物中,稀溶液氧化性最强的是
三种元素的最高价氧化物对应的水化物中,稀溶液氧化性最强的是(4)
 、
、 和
和 三种化合物,其中一种与另外两种都能反应的是
三种化合物,其中一种与另外两种都能反应的是(5)由
 、
、 组成的化合物分子中,
组成的化合物分子中, 、
、 原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式
原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式
您最近一年使用:0次
2022-04-01更新
|
204次组卷
|
13卷引用:四川省成都市树德中学2021-2022学年高一下学期5月阶段性测试化学试题
四川省成都市树德中学2021-2022学年高一下学期5月阶段性测试化学试题2015-2016学年江西省金溪一中高一下期中化学试卷2015-2016学年中国石油天然气管道局中学高一下第二次月考化学试卷2016-2017学年辽宁省庄河高级中学高二上开学测化学试卷2018版化学(苏教版)高考总复习专题五课时跟踪训练--微粒之间的相互作用力与物质的多样性山西省运城市康杰中学2017-2018学年高一下学期期中考试化学试题北京四中2017-2018学年高一下学期第二次月考化学试题新疆自治区和田地区和田县喀什塔什乡中学2019届高三年级四月调研考试理综化学试题百所名校联考-必修二模块综合检测黑龙江省哈尔滨市尚志市尚志中学2021届高三10月月考化学试题(已下线)第8单元 原子结构 元素周期律(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷海南省华中师范大学海南附属中学2021届高三上学期第四次月考化学试题河南省新野县第一高级中学校2021-2022学年高一下学期第三次考试化学试题
解题方法
10 . Ⅰ.颜料是指不溶解、只能以微粒状态分散于粘合剂中的着色剂。颜料混合时的三原色是红、黄、蓝,通过三原色可以调出其他所有颜色。物质A,B,C的溶液颜色类似于这三种颜色。
含铁物质X与HSCN和NaSCN反应得到A(反应①),将固体A置于浓 上方,会逐渐失去9分子结晶水(失重23.51%)。X与含铁物质Y以及KOH反应得到B(反应②),X与HCl反应得到C(反应③),固体C为六水合物,其无水形式可以由单质反应生成。含铁的物质X和Y可以反应生成不溶于水的蓝色物质Z(
上方,会逐渐失去9分子结晶水(失重23.51%)。X与含铁物质Y以及KOH反应得到B(反应②),X与HCl反应得到C(反应③),固体C为六水合物,其无水形式可以由单质反应生成。含铁的物质X和Y可以反应生成不溶于水的蓝色物质Z( ,反应④)。1.000gY可以得到1.327gZ,用相同质量的Y可以得到1.42gB.Y在空气中放置也会生成Z,同时产生剧毒物质(反应⑤)。
,反应④)。1.000gY可以得到1.327gZ,用相同质量的Y可以得到1.42gB.Y在空气中放置也会生成Z,同时产生剧毒物质(反应⑤)。
(1)①推出物质A,B,C,X,Y,Z的化学式,A______ ,B______ ,C______ ,X______ ,Y______ ,Z______
②写出反应①、②、④、⑤的方程式。①______ ,②______ ,④______ ,⑤______
(2)指出物质A、B、C的颜色。A______ ,B______ ,C______ ,
Ⅱ.电子屏幕上千变万化的颜色则是由红、绿、蓝三原色来组成。 、
、 、
、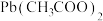 分别经一步反应生成D(青绿色,反应⑥)、E(紫色,反应⑦)、F(黄色,反应⑧)。化合物D,E,F的颜色类似于将红,绿,蓝色的光两两混合后得到。物质D和E为结晶水合物,F为不含氧的二元化合物,其金属元素的质量分数为44.95%。物质D(
分别经一步反应生成D(青绿色,反应⑥)、E(紫色,反应⑦)、F(黄色,反应⑧)。化合物D,E,F的颜色类似于将红,绿,蓝色的光两两混合后得到。物质D和E为结晶水合物,F为不含氧的二元化合物,其金属元素的质量分数为44.95%。物质D(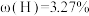 ,
, )的溶液能与银氨溶液发生反应(反应⑨)。物质E为复盐,50g2.50%的E溶液与过量硝酸钡溶液反应,生成1.165g不溶于酸和碱的白色沉淀。
)的溶液能与银氨溶液发生反应(反应⑨)。物质E为复盐,50g2.50%的E溶液与过量硝酸钡溶液反应,生成1.165g不溶于酸和碱的白色沉淀。
(3)①通过计算和推理写出物质D、E、F的化学式。D______ ,E______ ,F______ ,
②写出反应⑨的方程式。______
(4)对物质D,E,F,指出屏幕上是哪两种基本颜色的光可以形成该物质的颜色。______ ,
含铁物质X与HSCN和NaSCN反应得到A(反应①),将固体A置于浓
 上方,会逐渐失去9分子结晶水(失重23.51%)。X与含铁物质Y以及KOH反应得到B(反应②),X与HCl反应得到C(反应③),固体C为六水合物,其无水形式可以由单质反应生成。含铁的物质X和Y可以反应生成不溶于水的蓝色物质Z(
上方,会逐渐失去9分子结晶水(失重23.51%)。X与含铁物质Y以及KOH反应得到B(反应②),X与HCl反应得到C(反应③),固体C为六水合物,其无水形式可以由单质反应生成。含铁的物质X和Y可以反应生成不溶于水的蓝色物质Z( ,反应④)。1.000gY可以得到1.327gZ,用相同质量的Y可以得到1.42gB.Y在空气中放置也会生成Z,同时产生剧毒物质(反应⑤)。
,反应④)。1.000gY可以得到1.327gZ,用相同质量的Y可以得到1.42gB.Y在空气中放置也会生成Z,同时产生剧毒物质(反应⑤)。(1)①推出物质A,B,C,X,Y,Z的化学式,A
②写出反应①、②、④、⑤的方程式。①
(2)指出物质A、B、C的颜色。A
Ⅱ.电子屏幕上千变万化的颜色则是由红、绿、蓝三原色来组成。
 、
、 、
、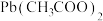 分别经一步反应生成D(青绿色,反应⑥)、E(紫色,反应⑦)、F(黄色,反应⑧)。化合物D,E,F的颜色类似于将红,绿,蓝色的光两两混合后得到。物质D和E为结晶水合物,F为不含氧的二元化合物,其金属元素的质量分数为44.95%。物质D(
分别经一步反应生成D(青绿色,反应⑥)、E(紫色,反应⑦)、F(黄色,反应⑧)。化合物D,E,F的颜色类似于将红,绿,蓝色的光两两混合后得到。物质D和E为结晶水合物,F为不含氧的二元化合物,其金属元素的质量分数为44.95%。物质D(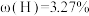 ,
, )的溶液能与银氨溶液发生反应(反应⑨)。物质E为复盐,50g2.50%的E溶液与过量硝酸钡溶液反应,生成1.165g不溶于酸和碱的白色沉淀。
)的溶液能与银氨溶液发生反应(反应⑨)。物质E为复盐,50g2.50%的E溶液与过量硝酸钡溶液反应,生成1.165g不溶于酸和碱的白色沉淀。(3)①通过计算和推理写出物质D、E、F的化学式。D
②写出反应⑨的方程式。
(4)对物质D,E,F,指出屏幕上是哪两种基本颜色的光可以形成该物质的颜色。
您最近一年使用:0次



