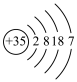
1 . Ⅰ. 元素X、Y、Z、W、Q在元素周期表中的相对位置如下图所示。
(1)元素X在周期表中的位置是第_______ 周期,第_______ 族。
(2)五种元素中离子半径最小的是_______ 。
Ⅱ. 下图是部分短周期主族元素原子半径与原子序数的关系。

(3)X的元素符号:_______ 。
(4)Y与Z形成的是_______ 化合物。(填“离子”或“共价”)
(5)上述元素的最高价含氧酸中酸性最强的是_______ (填化学式)。
Ⅲ.(6)下列关于元素及其化合物性质的判断中,正确的是_______ (填序号)
A. 元素甲的氢氧化物只有碱性,而元素乙的氢氧化物具有两性,所以金属性:甲>乙
B. 元素甲最外层只有一个电子,而乙最外层有两个电子,所以金属性:甲>乙
C. 金属元素 、
、 能分别形成+2、+3价离子,所以氧化性:
能分别形成+2、+3价离子,所以氧化性: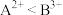
D. 因为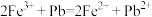 ,所以金属性:
,所以金属性:
E. 因为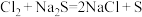 ,所以非金属性:
,所以非金属性:
F. 因为水溶液的酸性: ,所以非金属性:
,所以非金属性:
G. 是一元酸,而
是一元酸,而 是二元酸,所以酸性:
是二元酸,所以酸性: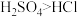
Ⅳ.(7)甲同学查阅资料知:氨气( )的分解温度在850℃以上,甲烷(
)的分解温度在850℃以上,甲烷( )的分解温度是655℃,据此得出结论:N元素的非金属性强于C元素。乙同学对此结论持怀疑态度,甲同学通过实验间接证明了自己的结论。你认为甲同学的实验方案是(请结合离子方程式简要说明):
)的分解温度是655℃,据此得出结论:N元素的非金属性强于C元素。乙同学对此结论持怀疑态度,甲同学通过实验间接证明了自己的结论。你认为甲同学的实验方案是(请结合离子方程式简要说明):_______ 。
| X | Y | ||||
| Z | W | Q |
(2)五种元素中离子半径最小的是
Ⅱ. 下图是部分短周期主族元素原子半径与原子序数的关系。

(3)X的元素符号:
(4)Y与Z形成的是
(5)上述元素的最高价含氧酸中酸性最强的是
Ⅲ.(6)下列关于元素及其化合物性质的判断中,正确的是
A. 元素甲的氢氧化物只有碱性,而元素乙的氢氧化物具有两性,所以金属性:甲>乙
B. 元素甲最外层只有一个电子,而乙最外层有两个电子,所以金属性:甲>乙
C. 金属元素
 、
、 能分别形成+2、+3价离子,所以氧化性:
能分别形成+2、+3价离子,所以氧化性: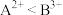
D. 因为
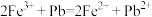 ,所以金属性:
,所以金属性:
E. 因为
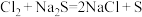 ,所以非金属性:
,所以非金属性:
F. 因为水溶液的酸性:
 ,所以非金属性:
,所以非金属性:
G.
 是一元酸,而
是一元酸,而 是二元酸,所以酸性:
是二元酸,所以酸性: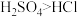
Ⅳ.(7)甲同学查阅资料知:氨气(
 )的分解温度在850℃以上,甲烷(
)的分解温度在850℃以上,甲烷( )的分解温度是655℃,据此得出结论:N元素的非金属性强于C元素。乙同学对此结论持怀疑态度,甲同学通过实验间接证明了自己的结论。你认为甲同学的实验方案是(请结合离子方程式简要说明):
)的分解温度是655℃,据此得出结论:N元素的非金属性强于C元素。乙同学对此结论持怀疑态度,甲同学通过实验间接证明了自己的结论。你认为甲同学的实验方案是(请结合离子方程式简要说明):
您最近一年使用:0次
名校
2 . 有四种短周期元素,相关信息如下表。
请根据表中信息回答:
(1)A在周期表中位于第_______ 周期第_______ 族。
(2)用电子式表示B与C形成化合物的过程:_______ 。
(3)在元素C与D的最高价氧化物对应的水化物中,酸性较强的是_______ (填化学式)。
(4)已知硒(Se)与D同主族,且位于D下一个周期,根据硒元素在元素周期表中的位置推测,硒可能具有的性质是_______ 。
a.其单质在常温下呈固态
b. 既有氧化性又有还原性
既有氧化性又有还原性
c.最高价氧化物对应的水化物的化学式为
d.非金属性比Cl元素的强
| 元素 | 相关信息 |
| A | 气态氢化物极易溶于水,且其水溶液显碱性 |
| B | 单质在焰色试验中显黄色 |
| C | 单质是淡黄绿色气体,可用于自来水消毒 |
| D | -2价阴离子的电子层结构与Ar原子相同 |
(1)A在周期表中位于第
(2)用电子式表示B与C形成化合物的过程:
(3)在元素C与D的最高价氧化物对应的水化物中,酸性较强的是
(4)已知硒(Se)与D同主族,且位于D下一个周期,根据硒元素在元素周期表中的位置推测,硒可能具有的性质是
a.其单质在常温下呈固态
b.
 既有氧化性又有还原性
既有氧化性又有还原性c.最高价氧化物对应的水化物的化学式为

d.非金属性比Cl元素的强
您最近一年使用:0次
解题方法
3 . 有A、B、C、D、E、F六种元素,试按下述所给条件推断:①A、B、C是同一周期的金属元素,已知原子核外有3个电子层,原子半径A>B>C ②D、E、F是同主族非金属元素,它们与氢化合可生成气态氢化物HD、HE、HF,在室温时,E的单质是液体是液体,F的单质是固体;D是除氢外原子半径最小的元素。
(1)A的名称是_________ ,B、C的简单离子的氧化性强弱(用离子符号表示)___________ ,C 的原子结构示意图是_____________ 。
(2)气态氢化物HD、HE、HF的稳定性由强到弱是(用分子式表示)_________ ,D、E、F离子的还原性由强到弱是(用离子符号表示)____________ 。
(3)A元素与E元素形成化合物的化学式是___________ 。
(4)下列表述中能证明E的单质氧化性强于F单质的事实是________ 。
A.E单质的熔点小于F单质的熔点
B.E单质能将F从其可溶性盐中置换出来
c.一定条件下E和F的单质都能与A的单质反应
(5)在上述七种元素中,最高价氧化物对应的水化物碱性最强的是______ (填物质化学式,下同),酸性最强的是________ ,气体氢化物最稳定的是__________ 。
(6)将C的最高价氧化物对应的水化物既能与A的最高价氧化物对应的水化物反应,也能与E的最高价氧化物对应的水化物反应。分别写出其反应的离子方程式是_______________ ;_______________ 。
(1)A的名称是
(2)气态氢化物HD、HE、HF的稳定性由强到弱是(用分子式表示)
(3)A元素与E元素形成化合物的化学式是
(4)下列表述中能证明E的单质氧化性强于F单质的事实是
A.E单质的熔点小于F单质的熔点
B.E单质能将F从其可溶性盐中置换出来
c.一定条件下E和F的单质都能与A的单质反应
(5)在上述七种元素中,最高价氧化物对应的水化物碱性最强的是
(6)将C的最高价氧化物对应的水化物既能与A的最高价氧化物对应的水化物反应,也能与E的最高价氧化物对应的水化物反应。分别写出其反应的离子方程式是
您最近一年使用:0次
名校
4 . X、Y、Z、W为原子序数依次增大的短周期主族元素。X分别与Y、Z、W结合形成质子数相同的甲、乙、丙三种分子。丁为无色气体,遇空气变红棕色;丙的水溶液可刻蚀玻璃。上述物质有如图转化关系如图所示。
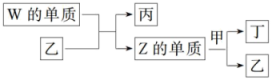
(1)Y、Z元素分别为_______ 、_______ (填元素符号)
(2)丙的水溶液刻蚀玻璃的化学反应方程式是_______
(3)X与Y还可以结合形成Y2X4分子,Y2X4的电子式为_______ ,Y的化合价为_______ 。实验室可用次氯酸钠溶液与甲反应制备Y2X4,反应的化学方程式为_______ 。
(4)下列关于元素及其化合物性质的判断中,正确的是_______ (填序号)
A.元素甲最外层只有一个电子,而乙最外层有两个电子,所以金属性:甲>乙
B.金属元素A、B能分别形成+2、+3价离子,所以氧化性:A2+<B3+
C.因为 ,所以金属性:Pb>Fe
,所以金属性:Pb>Fe
D.因为 ,所以非金属性:Cl>S
,所以非金属性:Cl>S
E.因为水溶液的酸性:HmA>HnB,所以非金属性:A>B
F.HCl是一元酸,而H2SO4是二元酸,所以酸性:H2SO4>HCl
(5)某同学查阅资料知:甲的分解温度在850℃以上,甲烷(CH4)的分解温度是655℃,据此得出结论:Y元素的非金属性强于碳元素。该同学通过实验间接证明了自己的结论。你认为该同学的实验方案是(请结合离子方程式简要说明):_______ 。

(1)Y、Z元素分别为
(2)丙的水溶液刻蚀玻璃的化学反应方程式是
(3)X与Y还可以结合形成Y2X4分子,Y2X4的电子式为
(4)下列关于元素及其化合物性质的判断中,正确的是
A.元素甲最外层只有一个电子,而乙最外层有两个电子,所以金属性:甲>乙
B.金属元素A、B能分别形成+2、+3价离子,所以氧化性:A2+<B3+
C.因为
 ,所以金属性:Pb>Fe
,所以金属性:Pb>FeD.因为
 ,所以非金属性:Cl>S
,所以非金属性:Cl>SE.因为水溶液的酸性:HmA>HnB,所以非金属性:A>B
F.HCl是一元酸,而H2SO4是二元酸,所以酸性:H2SO4>HCl
(5)某同学查阅资料知:甲的分解温度在850℃以上,甲烷(CH4)的分解温度是655℃,据此得出结论:Y元素的非金属性强于碳元素。该同学通过实验间接证明了自己的结论。你认为该同学的实验方案是(请结合离子方程式简要说明):
您最近一年使用:0次
名校
解题方法
5 . 部分短周期主族元素的原子半径和主要化合价的关系如图所示,其中E、G、T位于同一周期。回答下列问题:

(1)B位于第_______ 周期第______ 族。
(2)FDB的电子式为_______ ;T的原子结构示意图为_______ 。
(3)设计简单实验证明D的非金属性比C的强:________ 。
(4)A和D的简单氢化物相遇产生“白烟”,其生成物的化学式是_______ 。
(5)在上述元素的最高价氧化物对应的水化物中,酸性最强的是_______ (填化学式,下同),碱性最强的是_______ ;上述非金属元素的简单氢化物中,沸点最高的是_______ ,还原性最强的是_______ 。
(6)G、D的最高价氧化物对应的水化物之间发生反应的化学方程式为_______ 。

(1)B位于第
(2)FDB的电子式为
(3)设计简单实验证明D的非金属性比C的强:
(4)A和D的简单氢化物相遇产生“白烟”,其生成物的化学式是
(5)在上述元素的最高价氧化物对应的水化物中,酸性最强的是
(6)G、D的最高价氧化物对应的水化物之间发生反应的化学方程式为
您最近一年使用:0次
2023-10-27更新
|
174次组卷
|
2卷引用:湖南省炎德·英才·名校联考联合体2023-2024学年高三上学期第三次联考化学试题
6 . 现有原子序数依次增大的短周期主族元素P、Q、X、Y、Z、W。P元素的一种核素无中子,元素Q的最外层电子数是电子层数的2倍,Y原子是其所在周期中半径最大的原子,元素Z的最外层电子数是K层电子数的3倍,X能与Y可以形成一种淡黄色固体M。
(1)写出元素Q在元素周期表中的位置_______ 。
(2)写出元素P与元素X形成的18e-分子的电子式_______ 。
(3)研究发现M具有强氧化性,Z的一种氧化物具有较强的还原性,可相互反应。写出该反应的化学方程式:_______ 。
(4)为了证明非金属性W>Z,某小组设计如图装置探究元素非金属性的变化规律。C中装有Y2Z溶液,B中装有YWX3固体。A中试剂为_______ (填化学式)浓溶液,C中发生反应的离子方程式为_______ 。

(5)元素P与元素Q形成的一种物质Q2P4使溴水褪色,写出褪色过程中发生的化学反应方程式:_______ 。
(1)写出元素Q在元素周期表中的位置
(2)写出元素P与元素X形成的18e-分子的电子式
(3)研究发现M具有强氧化性,Z的一种氧化物具有较强的还原性,可相互反应。写出该反应的化学方程式:
(4)为了证明非金属性W>Z,某小组设计如图装置探究元素非金属性的变化规律。C中装有Y2Z溶液,B中装有YWX3固体。A中试剂为

(5)元素P与元素Q形成的一种物质Q2P4使溴水褪色,写出褪色过程中发生的化学反应方程式:
您最近一年使用:0次
名校
7 . A、B、C、D、E为常见的主族元素,根据下表信息回答问题。
(1)写出元素A的原子结构示意图___________ 。
(2)A、B最高价氧化物对应水化物的碱性强弱:___________ >___________ (填化学式),从原子结构角度解释原因___________ 。
(3)写出A、B最高价氧化物对应水化物二者反应的离子方程式________________ 。
(4)用电子式表示C和D形成化合物的过程:_______________ 。
(5)元素E在周期表中的位置___________ ,关于元素E及其化合物的推断中,正确的是___________ 。
a.E与D的最低负化合价相同 b.E的单质可与A和D形成的化合物的水溶液发生置换反应
c.最高价氧化物对应水化物的酸性:E>D d.氢化物稳定性:E<D
(6)D和E形成的化合物①具有氧化性,其中体现氧化性的元素是(写元素符号)___________ ,原因是________________ 。
(7)元素M与A同主族,比A多2个电子层,M与氧以2:1比例形成的化合物②的物质类别为___________ ,任意写出一个能体现②的类别通性的反应方程式_____________ 。
(8)第四周期ⅥA族的元素硒 是一种人体必需的元素,关于硒元素及其化合物的有关说法正确的是(选填序号)
是一种人体必需的元素,关于硒元素及其化合物的有关说法正确的是(选填序号)___________ 。
a.硒原子的半径比硫原子的大 b. 的稳定性比HCl的强
的稳定性比HCl的强
c. 能与NaOH溶液反应 d.
能与NaOH溶液反应 d. 可以使酸性高锰酸钾溶液褪色
可以使酸性高锰酸钾溶液褪色
| 元素 | 元素性质/原子结构信息 |
| A | 短周期元素原子半径最大(稀有气体不参与比较) |
| B | +3价阳离子的核外电子排布与氖原子相同 |
| C | 原子核外M电子层与K电子层的电子数相等 |
| D | 与A同周期,化合价有-1、+7等 |
| E | 原子结构示意图: |
(1)写出元素A的原子结构示意图
(2)A、B最高价氧化物对应水化物的碱性强弱:
(3)写出A、B最高价氧化物对应水化物二者反应的离子方程式
(4)用电子式表示C和D形成化合物的过程:
(5)元素E在周期表中的位置
a.E与D的最低负化合价相同 b.E的单质可与A和D形成的化合物的水溶液发生置换反应
c.最高价氧化物对应水化物的酸性:E>D d.氢化物稳定性:E<D
(6)D和E形成的化合物①具有氧化性,其中体现氧化性的元素是(写元素符号)
(7)元素M与A同主族,比A多2个电子层,M与氧以2:1比例形成的化合物②的物质类别为
(8)第四周期ⅥA族的元素硒
 是一种人体必需的元素,关于硒元素及其化合物的有关说法正确的是(选填序号)
是一种人体必需的元素,关于硒元素及其化合物的有关说法正确的是(选填序号)a.硒原子的半径比硫原子的大 b.
 的稳定性比HCl的强
的稳定性比HCl的强c.
 能与NaOH溶液反应 d.
能与NaOH溶液反应 d. 可以使酸性高锰酸钾溶液褪色
可以使酸性高锰酸钾溶液褪色
您最近一年使用:0次
名校
8 . 有四种短周期元素,相关信息如下表。
请根据表中信息回答:
(1)A在周期表中的位置为_______ ,B的离子结构示意图_______ 。
(2)在元素C与D的最高价氧化物对应的水化物中,酸性较强的是(填化学式)_______ 。C单质与水反应生成的具有漂白性物质的电子式_______
(3)已知硒(Se)与D同主族,且位于D下一个周期,根据硒元素在元素周期表中的位置推测,硒可能具有的性质是_______ 。
a.其单质在常温下呈固态
b.SeO2 既有氧化性又有还原性
c.最高价氧化物对应的水化物的化学式为H2SeO3
d.非金属性比C元素的强
(4)已知A的某种氢化物相对分子质量为58,写出它的所有可能结构(结构简式):_______ 。
| 元素 | 相关信息 |
| A | 自然界中形成化学物种类最多的元素 |
| B | 单质的焰色反应为黄色 |
| C | 单质是黄绿色气体,可用于自来水消毒 |
| D | −2价阴离子的电子层结构与Ar原子相同 |
(1)A在周期表中的位置为
(2)在元素C与D的最高价氧化物对应的水化物中,酸性较强的是(填化学式)
(3)已知硒(Se)与D同主族,且位于D下一个周期,根据硒元素在元素周期表中的位置推测,硒可能具有的性质是
a.其单质在常温下呈固态
b.SeO2 既有氧化性又有还原性
c.最高价氧化物对应的水化物的化学式为H2SeO3
d.非金属性比C元素的强
(4)已知A的某种氢化物相对分子质量为58,写出它的所有可能结构(结构简式):
您最近一年使用:0次
名校
9 . Q、R、X、Y、Z、A是原子序数依次增大的短周期元素,在短周期的所有元素中Q的原子半径与Z的原子半径之比最小(不包括稀有气体),R、X、Y三种元素的原子核外电子层数相同,同一周期中R的一种单质的熔点最高,Y与Q、R、X、Z均能形成多种常见化合物。元素A、Y在周期表中位于同一主族。
(1)X原子核外有_______ 种不同形状的电子云。这六种元素中,最外层有两个未成对电子的元素是_______ (用元素符号表示)。
(2)Q分别与X、Y形成的最简单化合物的稳定性_______ >_______ (用分子式表示)。
(3)Q与R两元素组成的分子构型可能是_______(填写序号)。
(4)化合物 和
和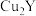 可发生如下转化(其中D是淀粉水解的最终产物):
可发生如下转化(其中D是淀粉水解的最终产物):
Cu2A 澄清溶液
澄清溶液 悬浊液
悬浊液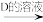 Cu2Y
Cu2Y
澄清溶液呈_______ 色,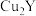 显
显_______ 色。
 的氧化性随pH的减小而增大。其在酸性介质中还原产物是
的氧化性随pH的减小而增大。其在酸性介质中还原产物是 ;在中性或碱性介质中还原产物主要是
;在中性或碱性介质中还原产物主要是 。
。
(5)应该在_______ (选填“酸性”、“碱性”或“中性”)介质中制备 。
。
(6)三氯乙烯 是地下水有机污染物的主要成分,研究显示在地下水中加入
是地下水有机污染物的主要成分,研究显示在地下水中加入 溶液可将其中的三氯乙烯除去,氧化产物只有
溶液可将其中的三氯乙烯除去,氧化产物只有 ,完成反应的化学方程式
,完成反应的化学方程式_______
_______ _______
_______ _______KCl+_______
_______KCl+_______ _______
_______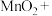 _______HCl
_______HCl
(7)加入过量的 才能将水中的三氯乙烯彻底除去。已知
才能将水中的三氯乙烯彻底除去。已知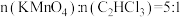 时,水样中的三氯乙烯基本完全去除。某地下水样品中三氯乙烯的质量浓度为
时,水样中的三氯乙烯基本完全去除。某地下水样品中三氯乙烯的质量浓度为 ,计算每处理
,计算每处理 该地下水,需
该地下水,需
_______ g。
(1)X原子核外有
(2)Q分别与X、Y形成的最简单化合物的稳定性
(3)Q与R两元素组成的分子构型可能是_______(填写序号)。
| A.直线型 | B.平面形 | C.三角锥形 | D.正四面体 |
 和
和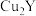 可发生如下转化(其中D是淀粉水解的最终产物):
可发生如下转化(其中D是淀粉水解的最终产物):Cu2A
 澄清溶液
澄清溶液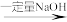 悬浊液
悬浊液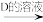 Cu2Y
Cu2Y澄清溶液呈
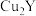 显
显 的氧化性随pH的减小而增大。其在酸性介质中还原产物是
的氧化性随pH的减小而增大。其在酸性介质中还原产物是 ;在中性或碱性介质中还原产物主要是
;在中性或碱性介质中还原产物主要是 。
。(5)应该在
 。
。(6)三氯乙烯
 是地下水有机污染物的主要成分,研究显示在地下水中加入
是地下水有机污染物的主要成分,研究显示在地下水中加入 溶液可将其中的三氯乙烯除去,氧化产物只有
溶液可将其中的三氯乙烯除去,氧化产物只有 ,完成反应的化学方程式
,完成反应的化学方程式_______
 _______
_______ _______KCl+_______
_______KCl+_______ _______
_______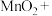 _______HCl
_______HCl(7)加入过量的
 才能将水中的三氯乙烯彻底除去。已知
才能将水中的三氯乙烯彻底除去。已知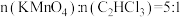 时,水样中的三氯乙烯基本完全去除。某地下水样品中三氯乙烯的质量浓度为
时,水样中的三氯乙烯基本完全去除。某地下水样品中三氯乙烯的质量浓度为 ,计算每处理
,计算每处理 该地下水,需
该地下水,需
您最近一年使用:0次
名校
10 . 表中列出了①~⑨九种元素在周期表中的位置:
请按要求回答下列问题。
(1)元素④的名称是_______ ,元素④在周期表中所处位置是_______ ,从元素原子得失电子的角度看,元素④具有_______ 性;(填“氧化性”或“还原性”)。
(2)气态氢化物的④⑥⑦的稳定性由弱到强的顺序排列是_______ ;(用化学式和“<”表示)。
(3)元素⑦的原子结构示意图是_______ ;
(4)写出元素⑤形成的单质在与水反应的化学方程式_______ ,这一反应是_______ (填“吸热”或“放热”)反应。
(5)用电子式表示①与⑨反应得到的化合物的形成过程_______ 。
(6)⑥⑦⑨的最高价氧化物对应水化物的酸性由强到弱的顺序是_______ (用化学式和“>”表示)
| ⅠA | ||||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ② | ③ | ④ | ⑧ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑨ |
(1)元素④的名称是
(2)气态氢化物的④⑥⑦的稳定性由弱到强的顺序排列是
(3)元素⑦的原子结构示意图是
(4)写出元素⑤形成的单质在与水反应的化学方程式
(5)用电子式表示①与⑨反应得到的化合物的形成过程
(6)⑥⑦⑨的最高价氧化物对应水化物的酸性由强到弱的顺序是
您最近一年使用:0次