解题方法
1 . 下表中的实线表示元素周期表的部分边界。①~⑤分别表示元素周期表中对应位置的元素。

(1)元素③④⑤的氢化物的稳定性由强到弱的顺序是____________________ (用氢化物的化学式表示)。
(2)元素③一般在化合物中显________ 价,但在与______ 形成化合物时,所显示的价态正好相反。
(3)M、N两种化合物均由①②③④四种元素组成,写出此两种化合物在水溶液中发生反应的离子方程式:____________________________________ 。
(4)X、Y、Z代表原子序数依次增大的三种短周期元素。在周期表中,Y与X相邻,Y与Z也相邻;X、Y和Z三种元素原子的最外层电子数之和为17;X、Y、Z三种元素有的是上表中编号①~⑤的元素,有的不是,请在上表中用元素符号标出不是①~⑤元素的相应位置。___________
(5)某同学受镧系、锕系元素排列方式的启发,将元素周期表设计成下列更简明的形式,把118种元素全部排列在内,表中除A、B、C、D外每个位置只表示一种元素。则该表中的A位置包含________ (填数字)种元素。C位置中的元素是否全部是金属元素________ (填“是”或“否”)。


(1)元素③④⑤的氢化物的稳定性由强到弱的顺序是
(2)元素③一般在化合物中显
(3)M、N两种化合物均由①②③④四种元素组成,写出此两种化合物在水溶液中发生反应的离子方程式:
(4)X、Y、Z代表原子序数依次增大的三种短周期元素。在周期表中,Y与X相邻,Y与Z也相邻;X、Y和Z三种元素原子的最外层电子数之和为17;X、Y、Z三种元素有的是上表中编号①~⑤的元素,有的不是,请在上表中用元素符号标出不是①~⑤元素的相应位置。
(5)某同学受镧系、锕系元素排列方式的启发,将元素周期表设计成下列更简明的形式,把118种元素全部排列在内,表中除A、B、C、D外每个位置只表示一种元素。则该表中的A位置包含

您最近一年使用:0次
解题方法
2 . A、B、C、D、E、F、G为原子序数依次增大的短周期主族元素。B、C、D均能与A形成10电子分子,E单质可用于焊接钢轨,F与D同主族,F与G同周期。
(1)F的离子结构示意图为___________ 。
(2)D、E、F的离子半径由大到小的顺序为___________ (填离子符号)。
(3)写出能证明G比F非金属性强的一个化学方程式:_________ 。
(4)F和G的一种化合物甲中所有原子均为8电子稳定结构,该化合物与水反应生成F单质、F的最高价含氧酸和G的氢化物,三种产物的物质的量之比为2∶1∶6,甲的电子式为___________ , 该反应的化学方程式为___________ 。
(5)C能分别与A和D按原子个数比1∶2形成化合物乙和丙,乙的结构式为___________ 。
(1)F的离子结构示意图为
(2)D、E、F的离子半径由大到小的顺序为
(3)写出能证明G比F非金属性强的一个化学方程式:
(4)F和G的一种化合物甲中所有原子均为8电子稳定结构,该化合物与水反应生成F单质、F的最高价含氧酸和G的氢化物,三种产物的物质的量之比为2∶1∶6,甲的电子式为
(5)C能分别与A和D按原子个数比1∶2形成化合物乙和丙,乙的结构式为
您最近一年使用:0次
名校
3 . 元素周期表中的四种元素的有关信息如下,请用合理的化学用语 填写空白。
(1)X元素周期表中的位置为_____ ,X、Y、W三种元素的简单离子半径从大到小的顺序为_______ 。
(2)足量W的最高价氧化物的水化物的稀溶液与1mol甲完全反应,放出热量QkJ,请写出表示该过程中和热的热化学方程式_____ 。
(3)下列有关W的气态氢化物丁的说法正确的有_______ (选填字母)
a、丁比氯化氢沸点高 b、丁比氯化氢稳定性好
c、丁比氟化氢还原性弱 d、丁比氟化氢酸性弱
(4)请写出丙溶于丁的水溶液的离子方程式____________ 。
| 在周期表中的区域 | 元素代号 | 有关信息 |
| 短周期元素 | X | X的最高价氧化物的水化物甲是一种胃酸中和剂,且能溶于强碱溶液 |
| Y | Y的一种氢化物可用于制造纯碱和做制冷剂 | |
| 长周期元素 | Z | Z的一种盐乙可以做净水剂, 的某种氧化物丙可以做红色涂料 的某种氧化物丙可以做红色涂料 |
| W | W元素大量存在于海藻中,它的银盐可用于人工降雨 |
(1)X元素周期表中的位置为
(2)足量W的最高价氧化物的水化物的稀溶液与1mol甲完全反应,放出热量QkJ,请写出表示该过程中和热的热化学方程式
(3)下列有关W的气态氢化物丁的说法正确的有
a、丁比氯化氢沸点高 b、丁比氯化氢稳定性好
c、丁比氟化氢还原性弱 d、丁比氟化氢酸性弱
(4)请写出丙溶于丁的水溶液的离子方程式
您最近一年使用:0次
解题方法
4 . X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。据此回答下列问题:
(1)L的常见原子组成符号为___________ ;M在元素周期表中的位置为_________________ ;五种元素的原子半径从大到小的顺序是_________________ (用具体元素符号表示)。
(2)Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为__________ ,B的结构式为__________________ 。Z和L也能组成原子数目比2∶4的分子C, 已知1 mol 液态C和液态B燃烧时生成无毒无害物质,并释放524.5 kJ的热量,试写出该反应的热化学方程式为________________ 。
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为___________ ,其最高价氧化物对应的水化物化学式为___________ 。该族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是________ (填字母代号)。
(4)用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R。写出阳极生成R的电极反应式:______________________ 。
(1)L的常见原子组成符号为
(2)Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为
| A.+99.7 kJ·mol-1 | B.+29.7 kJ·mol-1 | C.-20.6 kJ·mol-1 | D.-241.8 kJ·mol-1 |
您最近一年使用:0次
解题方法
5 . 下表为五种短周期元素的相关信息:
回答下列问题(注:涉及元素的均要用对应元素的元素符号书写作答)
(1)Y元素在周期表中的位置是第_____ 周期_____ 族。
(2)请写出X与Z元素按1:1组成的常见物质的电子式______ ,写出Q与R元素按2:1组成常见物质的电子式的形成过程________ 。
(3)由X、Y两种元素组成的18电子微粒的结构简式为______ 。
(4)Z、Q两种元素分别形成的简单离子中半径较大的是_______ ,原因是_______ 。
(5)Z、R两种元素分别形成的简单氢化物中熔沸点较高的是______ ,原因是______ ;Z、R两种元素分别形成的简单氢化物的稳定性由大到小顺序是_____ 。
(6)废印刷电路板上含有铜,用X2Z2和稀硫酸浸泡废印刷电路板既能溶解铜,又对环境无污染,试写出反应的离子方程式__________ 。
| 元素 | 元素的相关信息 |
| X | 周期表中原子半径最小的元素 |
| Y | 原子最外层电子数是次外层电子数的2倍 |
| Z | 地壳中含量最多的元素 |
| Q | 短周期中金属性最强 |
| R | 常温下,R的单质是淡黄色固体,常在火山喷口附近沉积 |
回答下列问题(注:涉及元素的均要用对应元素的元素符号书写作答)
(1)Y元素在周期表中的位置是第
(2)请写出X与Z元素按1:1组成的常见物质的电子式
(3)由X、Y两种元素组成的18电子微粒的结构简式为
(4)Z、Q两种元素分别形成的简单离子中半径较大的是
(5)Z、R两种元素分别形成的简单氢化物中熔沸点较高的是
(6)废印刷电路板上含有铜,用X2Z2和稀硫酸浸泡废印刷电路板既能溶解铜,又对环境无污染,试写出反应的离子方程式
您最近一年使用:0次
名校
6 . 短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,A的简单离子半径是同周期元素简单离子中半径最小的。请回答下列问题:

(1)描述D在元素周期表中的位置:_____________________________ 。
(2)在A、B、C、E四种元素最高价氧化物对应的水化物中酸性最强的是__________ (写化学式,下同),非金属最简单气态氢化物最不稳定的是_____________________ 。
(3)写出满足下列条件分子的结构式_________________________
①所有原子最外层是8个电子; ②C和E组成的化合物

(1)描述D在元素周期表中的位置:
(2)在A、B、C、E四种元素最高价氧化物对应的水化物中酸性最强的是
(3)写出满足下列条件分子的结构式
①所有原子最外层是8个电子; ②C和E组成的化合物
您最近一年使用:0次
2019-05-06更新
|
140次组卷
|
2卷引用:浙江省宁波市北仑中学2018-2019学年高一下学期期中考试化学试题1
名校
解题方法
7 . 结合元素周期表,完成下列问题。
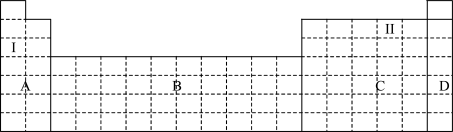
(1)在元素周期表中全部是金属元素的区域为____________ (填序号)。
a.A b.B c.C d.D
(2)Ⅰ和Ⅱ元素形成的化合物的化学式为__________________ ,写出其中含有非极性共价键的化合物的电子式_______________ 。
(3)现有甲、乙两种短周期元素,室温下,甲元素的单质在冷的浓硫酸或空气中表面都会生成致密的氧化膜,乙元素原子核外第三层与第一层上的电子数相等。
①写出甲元素周期表中对应的位置__________ 。
②甲、乙两元素中,金属性较强的是__________ (填元素名称),可以验证该结论的实验是_______________ (填序号)。
a.将在空气中放置已久的这两种元素的单质分别放入热水中
b.将这两种元素的单质粉末分别和相同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性

(1)在元素周期表中全部是金属元素的区域为
a.A b.B c.C d.D
(2)Ⅰ和Ⅱ元素形成的化合物的化学式为
(3)现有甲、乙两种短周期元素,室温下,甲元素的单质在冷的浓硫酸或空气中表面都会生成致密的氧化膜,乙元素原子核外第三层与第一层上的电子数相等。
①写出甲元素周期表中对应的位置
②甲、乙两元素中,金属性较强的是
a.将在空气中放置已久的这两种元素的单质分别放入热水中
b.将这两种元素的单质粉末分别和相同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
您最近一年使用:0次
2020-04-20更新
|
95次组卷
|
2卷引用:山东省济南外国语学校2019-2020学年高一4月月考化学试题
名校
解题方法
8 . 五种短周期元素A、B、C、D、E的原子序数依次增大。A和C同族,B和D同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物是常用的食品调味剂。
回答下列问题:
(1)写出元素D在周期表中的位置____________________________________________ 。
(2)五种元素中,原子半径最大的是________ (填元素符号),非金属最强的是________ (填元素符号)。
(3)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是________ (用化学式表示)。
(4)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为________ ,其中存在的化学键类型为_______________ 和________________ 。
(5)单质E与水反应的离子方程式为____________________________________________
回答下列问题:
(1)写出元素D在周期表中的位置
(2)五种元素中,原子半径最大的是
(3)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是
(4)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为
(5)单质E与水反应的离子方程式为
您最近一年使用:0次
9 .  、
、 、
、 、
、 、
、 、
、 、
、 是七种常见的短周期元素,其原子序数依次增大,请根据所给信息填写表中空白,并回答下列问题:
是七种常见的短周期元素,其原子序数依次增大,请根据所给信息填写表中空白,并回答下列问题:
(1)仅由表中信息还不能确定的元素是_______ (填字母序号),若要确定其是何种元素,还需要的条件是____ (填序号)。
a.单质能与氧气反应
b.最高价氧化物对应的水化物是强酸
c.单质在常温下为固体
d.简单氢化物的稳定性比 的简单氢化物强
的简单氢化物强
(2)基本信息②中,第一种元素的氧化物与 溶液反应的离子方程式为
溶液反应的离子方程式为________ 。
(3)上述某两种元素间可形成原子个数比为 及
及 的两种能与水反应的常见化合物,写出前者与
的两种能与水反应的常见化合物,写出前者与 反应的离子方程式:
反应的离子方程式:________ 。
 、
、 、
、 、
、 、
、 、
、 、
、 是七种常见的短周期元素,其原子序数依次增大,请根据所给信息填写表中空白,并回答下列问题:
是七种常见的短周期元素,其原子序数依次增大,请根据所给信息填写表中空白,并回答下列问题:| 编号 | 基本信息 | 解决的问题 |
| ① | 其中两种元素的原子核外电子层数与最外层电子数之比分别为 、 、 | 这两种元素是 |
| ② | 其中一种元素的氧化物与强酸、强碱均能反应;另一种元素是短周期主族非金属元素,其最外层电子数是次外层电子数的一半 | 这两种元素分别是 |
| ③ |  能与 能与 、 、 分别形成原子个数比均为 分别形成原子个数比均为 的分子 的分子 、 、 |  的分子式为 的分子式为 在周期表中的位置是 在周期表中的位置是 |
(1)仅由表中信息还不能确定的元素是
a.单质能与氧气反应
b.最高价氧化物对应的水化物是强酸
c.单质在常温下为固体
d.简单氢化物的稳定性比
 的简单氢化物强
的简单氢化物强(2)基本信息②中,第一种元素的氧化物与
 溶液反应的离子方程式为
溶液反应的离子方程式为(3)上述某两种元素间可形成原子个数比为
 及
及 的两种能与水反应的常见化合物,写出前者与
的两种能与水反应的常见化合物,写出前者与 反应的离子方程式:
反应的离子方程式:
您最近一年使用:0次
名校
解题方法
10 . 已知部分短周期主族元素的性质或原子结构如下表:.
(1)元素⑤的名称为_____ ;元素②在周期表中的位置为_____ 。
(2)元素①的一种核素可测定文物年代,这种核素的符号是_____ 。
(3)元素②和③所形成的简单氢化物中,稳定性较强的是_____ (填化学式)。
(4)元素③和④能形成原子个数比 1:1 的化合物,该化合物与水反应的化学方程式为_________ 。
(5)下列表述中,能证明元素⑥与元素⑤非金属性的强弱的是_____ 。
a.常温下,⑥的单质和⑤的单质状态不同
b.⑥的氢化物比⑤的氢化物稳定
c.⑥的氢化物比⑤的氢化物的酸性强
元素 | 相关信息 |
① | 最外层电子数是次外层的 2 倍 |
② | 常见单质为双原子分子且氢化物的水溶液呈碱性 |
③ | 地壳中含量最多的元素 |
④ | 短周期中原子半径最大 |
⑤ | L 层电子数是 K 层和 M 层电子数之和 |
⑥ | 元素最高价正价与最低负价的代数和为 6 |
(2)元素①的一种核素可测定文物年代,这种核素的符号是
(3)元素②和③所形成的简单氢化物中,稳定性较强的是
(4)元素③和④能形成原子个数比 1:1 的化合物,该化合物与水反应的化学方程式为
(5)下列表述中,能证明元素⑥与元素⑤非金属性的强弱的是
a.常温下,⑥的单质和⑤的单质状态不同
b.⑥的氢化物比⑤的氢化物稳定
c.⑥的氢化物比⑤的氢化物的酸性强
您最近一年使用:0次



