1 . 已知元素X位于Y的下一周期,X、Y的原子序数均不大于20。某含氧酸盐甲的化学式为XYO3。回答下列问题:
(1)常温下X的单质能与水发生反应,395℃时,甲能发生分解反应生成两种盐,其中一种是含Y元素的无氧酸盐,则X在周期表中的位置是___________ ,甲发生分解反应的化学方程式是___________ 。
(2)若甲难溶于水,且甲与盐酸反应生成能使品红溶液褪色的气体,则:
①甲为___________ (填化学式)。该气体能使酸性高锰酸钾溶液褪色,反应的离子方程式为___________ 。
②X、Y形成的简单离子的半径从大到小的顺序为___________ (用离子符号表示)。
(3)若甲能与盐酸反应,生成无色无味的气体乙,则:
①乙的电子式为___________ 。
②在水中持续加热甲,生成一种更难溶的物质并逸出气体乙,该反应的化学方程式为___________ 。
(1)常温下X的单质能与水发生反应,395℃时,甲能发生分解反应生成两种盐,其中一种是含Y元素的无氧酸盐,则X在周期表中的位置是
(2)若甲难溶于水,且甲与盐酸反应生成能使品红溶液褪色的气体,则:
①甲为
②X、Y形成的简单离子的半径从大到小的顺序为
(3)若甲能与盐酸反应,生成无色无味的气体乙,则:
①乙的电子式为
②在水中持续加热甲,生成一种更难溶的物质并逸出气体乙,该反应的化学方程式为
您最近一年使用:0次
2 . 已知短周期主族元素X、Y、Z、W在周期表中的位置关系如图所示,其中W元素的原子半径是同周期中最小的。回答下列问题:
(1)W在元素周期表中的位置___ 。
(2)上述4种元素中最高价氧化物对应的水化物酸性最强的是___ (填化学式)。
(3)X的简单气态氢化物的电子式为___ 。
(4)由Na和Y可形成具有漂白作用的物质,该物质中含有的化学键类型为___ 。
(5)取0.1mol·L-1的Na2Z溶液进行下列实验:
①用玻璃棒蘸取Na2Z溶液滴在pH试纸上,试纸呈蓝色,原因是___ (用离子方程式表示)。
②某温度下,将0.1mol·L-1的Na2Z溶液逐滴加入10mL0.1mol·L-1的CuW2溶液中,滴加过程中溶液中的Cu2+浓度与加入的Na2Z溶液的体积(V)关系如图所示。b点溶液中Na+、Z2-、W-、OH-离子浓度由大到小的顺序是___ (离子用元素符号表示);
该温度下,Ksp(CuZ)=___ 。

| X | Y | |
| Z | W |
(1)W在元素周期表中的位置
(2)上述4种元素中最高价氧化物对应的水化物酸性最强的是
(3)X的简单气态氢化物的电子式为
(4)由Na和Y可形成具有漂白作用的物质,该物质中含有的化学键类型为
(5)取0.1mol·L-1的Na2Z溶液进行下列实验:
①用玻璃棒蘸取Na2Z溶液滴在pH试纸上,试纸呈蓝色,原因是
②某温度下,将0.1mol·L-1的Na2Z溶液逐滴加入10mL0.1mol·L-1的CuW2溶液中,滴加过程中溶液中的Cu2+浓度与加入的Na2Z溶液的体积(V)关系如图所示。b点溶液中Na+、Z2-、W-、OH-离子浓度由大到小的顺序是
该温度下,Ksp(CuZ)=

您最近一年使用:0次
名校
解题方法
3 . (一)在容积为5L的密闭容器中,通入5 mol N2和8 mol H2,在一定条件下反应生成NH3,当反应进行到2 min时,测得容器内有4 mol NH3.则:
(1)2 min时,容器内n(N2)=_______ ,c(H2)= _______ 。
(2)2 min时,容器内气体的总物质的量与反应前容器内气体的总物质的量之比为_______ 。
(二)A、B、C、D四种短周期元素,它们的原子序数依次增大,其中A与C及B与D分别是同主族元素;已知B、D两元素间可形成DB2和DB3两种化合物,两者相对分子质量相差16;又知A、C两元素原子序数之和是B、D两元素原子序数之和的一半。请回答下列问题:
(1)写出由A、B、C三元素形成的化合物的电子式_______ ,
(2)由A、B、C、D四种元素形成的物质X,与盐酸反应能够生成具有刺激性气味的气体,写出X与盐酸反应的离子方程式_______ 。
(1)2 min时,容器内n(N2)=
(2)2 min时,容器内气体的总物质的量与反应前容器内气体的总物质的量之比为
(二)A、B、C、D四种短周期元素,它们的原子序数依次增大,其中A与C及B与D分别是同主族元素;已知B、D两元素间可形成DB2和DB3两种化合物,两者相对分子质量相差16;又知A、C两元素原子序数之和是B、D两元素原子序数之和的一半。请回答下列问题:
(1)写出由A、B、C三元素形成的化合物的电子式
(2)由A、B、C、D四种元素形成的物质X,与盐酸反应能够生成具有刺激性气味的气体,写出X与盐酸反应的离子方程式
您最近一年使用:0次
4 . I.有四种短周期元素,它们的结构、性质等信息如下表所述:
请根据表中信息填写:
(1)D﹣的结构示意图是___ 。
(2)C元素的气态氢化物的化学式为:___ ;其检验方法:___ 。
(3)B元素在周期表中的位置___ ;离子半径:B___ A(填“大于”或“小于”)。
(4)B的最高价氧化物对应的水化物与A的最高价氧化物对应的水化物反应的化学方程式为___ ,与D的氢化物的水化物反应的离子方程式为___ 。
II.在2L密闭容器内,800℃时反应:2NO(g)+O2(g)⇌2NO2(g)体系中,n(NO)随时间的变化如下表:

(1)NO的平衡浓度c(NO)=___ 。
(2)图中表示NO2变化的曲线是___ ,用O2表示0~2s内该反应的平均速率υ=___ 。
(3)能说明该反应已达到平衡状态的是___ 。
a.υ(NO2)=2υ(O2) b.容器内气体压强保持不变
c.υ逆(NO)=2υ正(O2) d.容器内气体的密度保持不变
| 元素 | 结构、性质等信息 |
| A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
| B | B与A同周期,其最高价氧化物的水化物呈两性 |
| C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
| D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
请根据表中信息填写:
(1)D﹣的结构示意图是
(2)C元素的气态氢化物的化学式为:
(3)B元素在周期表中的位置
(4)B的最高价氧化物对应的水化物与A的最高价氧化物对应的水化物反应的化学方程式为
II.在2L密闭容器内,800℃时反应:2NO(g)+O2(g)⇌2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |

(1)NO的平衡浓度c(NO)=
(2)图中表示NO2变化的曲线是
(3)能说明该反应已达到平衡状态的是
a.υ(NO2)=2υ(O2) b.容器内气体压强保持不变
c.υ逆(NO)=2υ正(O2) d.容器内气体的密度保持不变
您最近一年使用:0次
名校
5 . 已知元素X位于Y的下一周期,X、Y的原子序数均不大于20.某含氧酸盐甲的化学式 为XYO3。请回答:
(1)常温下X的单质能与水发生反应,395℃时,甲能发生分解反应生成两种盐,一种是 含Y元素的无氧酸盐,则X位于周期表_____ ,甲发生分解反应的化学方程式是_____ 。
(2) 若甲难溶于水,且甲与盐酸反应生成能使品红溶液褪色的气体.
①则甲为_____ (填化学式)该气体能使酸性高锰酸钾溶液褪色, 该反应的离子方程式为_____ ;
②X、Y形成简单离子半径大小关系为 > (用离子符号表示)._________
③25℃时,甲在水中的沉淀溶解平衡曲线如右图所示,若要使溶液 X2+离子沉淀完全,则 YO32-离子的最小浓度为_____ mol·L-1。
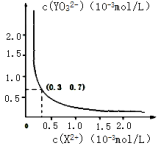
(当离子浓度小于 1×10-5mol·L-1 时,该离子沉淀完全)
(3)若甲能与盐酸反应,生成无色、无味的气体乙.则:
①乙的电子式为_____ ;
②甲在水中持续加热生成一种更难溶的物质并逸出气体乙,该反应的化学方程式为___ 。
(1)常温下X的单质能与水发生反应,395℃时,甲能发生分解反应生成两种盐,一种是 含Y元素的无氧酸盐,则X位于周期表
(2) 若甲难溶于水,且甲与盐酸反应生成能使品红溶液褪色的气体.
①则甲为
②X、Y形成简单离子半径大小关系为 > (用离子符号表示).
③25℃时,甲在水中的沉淀溶解平衡曲线如右图所示,若要使溶液 X2+离子沉淀完全,则 YO32-离子的最小浓度为

(当离子浓度小于 1×10-5mol·L-1 时,该离子沉淀完全)
(3)若甲能与盐酸反应,生成无色、无味的气体乙.则:
①乙的电子式为
②甲在水中持续加热生成一种更难溶的物质并逸出气体乙,该反应的化学方程式为
您最近一年使用:0次
解题方法
6 . 已知元素X位于Y的下一周期,X、Y的原子序数均不大于20。某含氧酸盐甲的化学式为XYO3。请回答:
(1)常温下Y的单质能与水发生反应,则X位于周期表_________ ,X、Y形成简单离子半径大小关系为X_____________ Y(填“大于”、“小于”或“等于”)。395℃时,甲能发生分解反应生成两种盐,一种是含Y元素的无氧酸盐,该反应的化学方程式是_____________ 。
(2)若甲难溶于水,且甲与盐酸反应生成能使品红溶液褪色的气体。
①则甲为___________ (填化学式)。该气体能使高锰酸钾溶液褪色,该反应的离子方程式为_______________ 。
②25℃时,甲在水中的沉淀溶解平衡曲线如下图所示,若要使溶液X2+离子沉淀完全,则加入 离子的最小浓度为
离子的最小浓度为___________ mol•L﹣1。

(3)若甲能与盐酸反应,生成无色、无味的气体乙。则:
①乙中所含化学键类型____________ 。
②甲在水中持续加热生成一种更难溶的物质并逸出气体乙,该反应的化学方程式为________________ 。
(1)常温下Y的单质能与水发生反应,则X位于周期表
(2)若甲难溶于水,且甲与盐酸反应生成能使品红溶液褪色的气体。
①则甲为
②25℃时,甲在水中的沉淀溶解平衡曲线如下图所示,若要使溶液X2+离子沉淀完全,则加入
 离子的最小浓度为
离子的最小浓度为
(3)若甲能与盐酸反应,生成无色、无味的气体乙。则:
①乙中所含化学键类型
②甲在水中持续加热生成一种更难溶的物质并逸出气体乙,该反应的化学方程式为
您最近一年使用:0次
解题方法
7 . 运用元素周期律研究元素及其化合物的性质具有重要的意义。
I.部分短周期主族元素的最高价氧化物对应水化物(浓度均为0.01mol·L-1)溶液的pH和原子序数的关系如图所示。
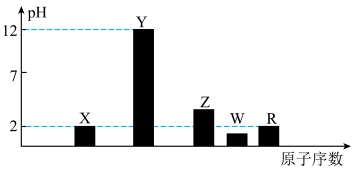
(1)元素R在周期表中的位置是_______ ;元素Z的原子结构示意图是________ 。
(2)元素Y和W形成的Y2W2型化合物中含有化学键的类型为________ 。
II.短周期元素C、O、S能形成多种化合物,如CO2、CS2、COS等。
(1)下列能说明碳、硫两种元素非金属性相对强弱的是__________ (填序号)
A. S与H2发生化合反应比C与H2化合更容易
B. 酸性:H2SO3 >H2CO3
C. CS2中碳元素为+4价,硫元素为-2价
(2)铅(Pb)、锡(Sn)、锗(Ge)与元素C同主族。常温下其单质在空气中,锡、锗不反应,而铅表面会生成一层氧化铅;锗与盐酸不反应,而锡与盐酸反应。由此可得出以下结论:
①锗的原子序数为_________ 。
②它们+4价氢氧化物的碱性由强到弱顺序为____________ (填化学式)。
(3)羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和CO2相似。羰基硫(COS)的电子式为:______________________ 。
I.部分短周期主族元素的最高价氧化物对应水化物(浓度均为0.01mol·L-1)溶液的pH和原子序数的关系如图所示。

(1)元素R在周期表中的位置是
(2)元素Y和W形成的Y2W2型化合物中含有化学键的类型为
II.短周期元素C、O、S能形成多种化合物,如CO2、CS2、COS等。
(1)下列能说明碳、硫两种元素非金属性相对强弱的是
A. S与H2发生化合反应比C与H2化合更容易
B. 酸性:H2SO3 >H2CO3
C. CS2中碳元素为+4价,硫元素为-2价
(2)铅(Pb)、锡(Sn)、锗(Ge)与元素C同主族。常温下其单质在空气中,锡、锗不反应,而铅表面会生成一层氧化铅;锗与盐酸不反应,而锡与盐酸反应。由此可得出以下结论:
①锗的原子序数为
②它们+4价氢氧化物的碱性由强到弱顺序为
(3)羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和CO2相似。羰基硫(COS)的电子式为:
您最近一年使用:0次
2011·内蒙古呼伦贝尔·二模
解题方法
8 . X、Y、Z、W为原子序数依次增大的四种短周期元素,其中X元素原子的核外电子总数等于其电子层数,Z元素的气态氢化物和它的氧化物在常温下反应生成Z单质和水,X与Y、W可分别形成YX3和XW型共价化合物,YX3极易溶于水.
(1) 化合物YX3的空间构型为____________ ; Y原子的杂化轨道类型为_______ .
(2)XW的电子式是_____________ .
(3)XW与YX3反应生成一种盐,该盐水溶液的pH________ 7(填“大于”“小于”或“等于”),其原因是(用离子方程式表示)______________________________ .
(4)Z元素氢化物的沸点比H2O________ (填“低”或“高”).Z元素的氢化物有毒,写出用CuSO4溶液吸收Z元素氢化物的离子方程式________________________________ .
(5)已知X单质和Y单质反应生成YX3的反应是可逆反应,ΔH<0.将X、Y的两种单质以等物质的量充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应.下列说法正确的是________ .
a.达到化学平衡时,任何一种物质的正反应速率与逆反应速率相等
b.反应过程中,Y单质的体积分数始终为50%
c.达到化学平衡时,X、Y两种单质在混合气体中的物质的量之比为1∶1
d.达到化学平衡的过程中气体平均相对分子质量减小
e.到达化学平衡后,升高温度,YX3的体积分数增大
(1) 化合物YX3的空间构型为
(2)XW的电子式是
(3)XW与YX3反应生成一种盐,该盐水溶液的pH
(4)Z元素氢化物的沸点比H2O
(5)已知X单质和Y单质反应生成YX3的反应是可逆反应,ΔH<0.将X、Y的两种单质以等物质的量充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应.下列说法正确的是
a.达到化学平衡时,任何一种物质的正反应速率与逆反应速率相等
b.反应过程中,Y单质的体积分数始终为50%
c.达到化学平衡时,X、Y两种单质在混合气体中的物质的量之比为1∶1
d.达到化学平衡的过程中气体平均相对分子质量减小
e.到达化学平衡后,升高温度,YX3的体积分数增大
您最近一年使用:0次
2010·宁夏银川·一模
解题方法
9 . 阅读下表中短周期主族元素的相关信息。
请回答:
(1)在一定条件下,B2与C的单质在海水中可形成原电池,为新型海水航标灯提供能源。 写出该原电池正极的电极反应式____________ 。
(2)用惰性电极电解化合物AD的水溶液,该反应的化学方程式为:____________ ,其中,阴极产物是______________________
(3)常温下,0.1 mol·L-1X溶液的pH_____ 7(填“>”、“=”或“<”),原因是_________ (用离子方程式说明)。
(4) 已知的Ksp[Cu(OH)2]=2.2×10-20、Ksp[Fe(OH)3]=4.0×10-38,Cu2+和Fe3+完全以氢氧化物沉淀时的pH分别为:6.7和3.2.现在向pH=0、浓度均为0.04mol•L-1 的Cu2+、Fe3+溶液中加入某一固体,以中和H+调节pH(设溶液体积不变),该过程中Cu2+、Fe3+的浓度与pH关系正确的是_________ (填字母代号)。
A. B.
B.
C. D.
D.
元素代号 | 相关信息 |
A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
B | B的原子量外层电子数是其内层电子数的三倍 |
C | 在第3周期元素中,C的简单离子半径最小 |
D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
E | 所有有机物中都含有E元素 |
请回答:
(1)在一定条件下,B2与C的单质在海水中可形成原电池,为新型海水航标灯提供能源。 写出该原电池正极的电极反应式
(2)用惰性电极电解化合物AD的水溶液,该反应的化学方程式为:
(3)常温下,0.1 mol·L-1X溶液的pH
(4) 已知的Ksp[Cu(OH)2]=2.2×10-20、Ksp[Fe(OH)3]=4.0×10-38,Cu2+和Fe3+完全以氢氧化物沉淀时的pH分别为:6.7和3.2.现在向pH=0、浓度均为0.04mol•L-1 的Cu2+、Fe3+溶液中加入某一固体,以中和H+调节pH(设溶液体积不变),该过程中Cu2+、Fe3+的浓度与pH关系正确的是
A.
 B.
B.
C.
 D.
D.
您最近一年使用:0次



