解题方法
1 . W、X、Y、Z是四种原子序数依次增大的短周期元素,W、X两种元素可组成W2x和W2X2两种常见的无色液体化合物,Y2X2为淡黄色固体化合物,Z的原子序数是X的原子序数的两倍。请回答下列问题:

(1)Z元素的名称是___________ 。
(2)W、X、Y三种元素形成的化合物的电子式_____________
(3)写出Y2X2中所含化学键有:___________ 。
(4)写出Y2X2和W2X反应的化学方程式:_______________
(5)W2和X2是组成某种燃料电池的两种常见物质,如图所示,通入X2的电极是___ (填“正极”或“负极”),写出通入W2的电极的电极反应式:________________

(1)Z元素的名称是
(2)W、X、Y三种元素形成的化合物的电子式
(3)写出Y2X2中所含化学键有:
(4)写出Y2X2和W2X反应的化学方程式:
(5)W2和X2是组成某种燃料电池的两种常见物质,如图所示,通入X2的电极是
您最近一年使用:0次
名校
解题方法
2 . 原子序数由小到大排列的四种短周期元素 A、B、C、D,四种元素的原子序数之和为32,B、C元素的常见单质是空气的主要成分,A 的一种同位素无中子
(1)D元素是_____________ (填元素符号)
(2)B、C、D分别与 A组成的最简单化合物中沸点最高的是__________ (填化学式) 。
(3)A、B、C三种元素能组成一种常见强酸,该强酸的稀溶液能与铜反应,写出该反应的离子方程式:____________ 。
(4)由 A、B、C、D四种元素可以组成多种离子化合物
①若离子化合物X(其各元素组成为 A5BC4D)能与足量 NaOH 浓溶液反应写出X的化学式:___________________________ .
在含有X的溶液中滴入几滴 NaOH 溶液并加热无气体生成,其可能的原因是_______________________________________ .
②若离子化合物Y(其各元素组成为 A8B2C3D)既能与盐酸反应,又能与氯水反应,写出Y与氯水反应的离子方程式:__________________ .
(5)由 A、C、D和Fe四种元素组成的相对分子质量为278的化合物Z,1molZ中含有7mol结晶水 Z的化学式为_______________________ 。
(1)D元素是
(2)B、C、D分别与 A组成的最简单化合物中沸点最高的是
(3)A、B、C三种元素能组成一种常见强酸,该强酸的稀溶液能与铜反应,写出该反应的离子方程式:
(4)由 A、B、C、D四种元素可以组成多种离子化合物
①若离子化合物X(其各元素组成为 A5BC4D)能与足量 NaOH 浓溶液反应写出X的化学式:
在含有X的溶液中滴入几滴 NaOH 溶液并加热无气体生成,其可能的原因是
②若离子化合物Y(其各元素组成为 A8B2C3D)既能与盐酸反应,又能与氯水反应,写出Y与氯水反应的离子方程式:
(5)由 A、C、D和Fe四种元素组成的相对分子质量为278的化合物Z,1molZ中含有7mol结晶水 Z的化学式为
您最近一年使用:0次
19-20高一下·江西南昌·阶段练习
解题方法
3 . X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
(1)R在元素周期表中的位置是__ ;R在自然界中有质量数为35和37的两种核素,它们之间的关系互为__ 。
(2)Z的单质与水反应的化学方程式为__ 。
(3)Y与R相比,非金属性较强的是__ (用元素符号表示),下列事实能证明这一结论的是__ (选填字母序号)。
A.常温下Y的单质呈固态,R的单质呈气态
B.稳定性:XR>YX4
C.Y与R形成的化合物中Y呈正价
(4)根据表中数据推测,Y的原子半径(用r表示)的最小范围是__ 。
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其他 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(1)R在元素周期表中的位置是
(2)Z的单质与水反应的化学方程式为
(3)Y与R相比,非金属性较强的是
A.常温下Y的单质呈固态,R的单质呈气态
B.稳定性:XR>YX4
C.Y与R形成的化合物中Y呈正价
(4)根据表中数据推测,Y的原子半径(用r表示)的最小范围是
您最近一年使用:0次
4 . 现有原子序数依次增大的A、B、C、D、E五种短周期元素。已知A、C、D三原子的最外电子层中共有10个电子,这三种元素的最高价氧化物的水化物之间,两两皆能反应。请回答下列问题:
(1)B元素的名称是_____ 。
(2)D、E两元素的最高价氧化物的水化物中,酸性较强的是_____ (填化学式)。
(3)写出A、C两元素的最高价氧化物的水化物之间反应的离子方程式:________ 。
(4)将A元素的过氧化物15.6g与足量二氧化碳完全反应,有____ mol 电子发生转移。
(1)B元素的名称是
(2)D、E两元素的最高价氧化物的水化物中,酸性较强的是
(3)写出A、C两元素的最高价氧化物的水化物之间反应的离子方程式:
(4)将A元素的过氧化物15.6g与足量二氧化碳完全反应,有
您最近一年使用:0次
名校
解题方法
5 . A、B、C为中学常见单质,其中一种为金属;通常情况下A为固体、B为黄绿色气体、C为无色气体。D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种无氧强酸溶液,E为黑色固体,H在常温下为液体。它们之间的转化如图所示(某些反应条件和部分反应产物已略去)。

(1)写出下列物质的化学式:D____________ X_______________ 。
(2)在反应①~⑦中,不属于氧化还原反应的是____________ (填编号)。
(3)反应⑥的离子方程式为:___________________________ 。
(4)往G溶液中加入NaOH溶液观察到的现象是__________________ 。
(5)反应⑦的化学方程式为______________ ;该反应中每消耗0.3mol的A,可转移电子________ mol。
(6)除去D溶液中混有的少量G的方法是:_____________________ 。

(1)写出下列物质的化学式:D
(2)在反应①~⑦中,不属于氧化还原反应的是
(3)反应⑥的离子方程式为:
(4)往G溶液中加入NaOH溶液观察到的现象是
(5)反应⑦的化学方程式为
(6)除去D溶液中混有的少量G的方法是:
您最近一年使用:0次
2016-12-09更新
|
673次组卷
|
3卷引用:2015-2016学年黑龙江省大庆铁人中学高一上期末化学试卷
6 . 已知元素X、Y均为短周期元素,X元素的一种核素常用于测文物的年代,Y元素原子半径是所有原子中最小的,元素X、Y可形成两种常见化合物M和N,已知M可以使高锰酸钾酸性溶液褪色,M分子中所含X元素的质量是Y元素质量的6倍,且M的相对分子质量为56。N是一种常用溶剂,分子式中两种元素个数比为1:1。回答下列问题:
(1)M的分子式为:______ 。
(2)任意写一种不含支链的M的结构简式______ 。
(3)如图在烧瓶a中加入N与液溴的混合液,加入铁粉可以使其发生反应:

①写出a容器中发生反应的化学方程式:______ 。
②仪器b的名称为_____ 。
(4)乙烯是重要有机化工原料。结合如图路线回答:

已知:2CH3CHO+O2 2CH3COOH
2CH3COOH
①B中官能团的名称是______ 。
②该转化关系中D生成CH3CHO的反应方程式为______ 。
③G是一种油状、有香味的物质,有以下两种制法。
制法一:实验室用D和E在浓硫酸加热条件下反应制取G。反应⑥用18O同位素标记乙醇中的氧原子,写出其化学方程式_______ 。
制法二:工业上用CH2=CH2和E直接反应获得G。该反应类型是____ 。
(1)M的分子式为:
(2)任意写一种不含支链的M的结构简式
(3)如图在烧瓶a中加入N与液溴的混合液,加入铁粉可以使其发生反应:

①写出a容器中发生反应的化学方程式:
②仪器b的名称为
(4)乙烯是重要有机化工原料。结合如图路线回答:

已知:2CH3CHO+O2
 2CH3COOH
2CH3COOH①B中官能团的名称是
②该转化关系中D生成CH3CHO的反应方程式为
③G是一种油状、有香味的物质,有以下两种制法。
制法一:实验室用D和E在浓硫酸加热条件下反应制取G。反应⑥用18O同位素标记乙醇中的氧原子,写出其化学方程式
制法二:工业上用CH2=CH2和E直接反应获得G。该反应类型是
您最近一年使用:0次
2010·安徽·一模
解题方法
7 . 已知A、B、C、D、E、F、C、H八种元素位于元素周期表前四个周期。A、B、C是三种非金属元素,A与B的原子的核外电子数之和与C原子的核外电子数相等且A、B、C能形成离子化合物。B与H位于同一主族,D的单质是中学化学常见的两性金属,E的单质是日常生活中用途最广泛的金属且其价电子数是G的两倍,F原子的最外电子层的p电子数是s电子数的两倍,D、H、F位于同一周期且原子序数依次增大,A、C、E、G、H的基态原子中未成对电子数均与其周期序数相同。请用化学用语回答以下问题:
(1)A、B、C形成的此化合物中存在的化学键的类型有_______ 。E单质在常温下遇到A、B、C形成的另一化合物的浓溶液发生钝化现象,过量的E单质在此化合物的稀溶液中发生反应的离子方程式为_________ ,E的基态电子排布式为________ ,E3+与E2+的稳定性大小为____________ 。
(2)B、C、D、H四种元素的第一电离能由大到小的顺序为__________ ,电负性由小到大的顺序为_________ 。
(3)A、C、G可形成一种相对分子质量为46的一元羧酸分子,其分子中存在的σ键和π键的数目之比为__________ ;F、G对应的氢化物中键能大小为F—H键_________ G—H键。
(4)等浓度、等体积的盐酸和氢氧化钠溶液分别与足量的D的单质反应放出的气体在常温常压下的体积比为_________ ,将所得溶液混合刚含有D元素的两种物质间发生反应的离子方程式为____________ 。
(5)由A、C、F可形成两种酸类化合物,用离子方程式说明它们的酸性强弱________ 。由A、C、F与钠四种元素按原子个数比为1∶3∶1∶1组成一种化合物,其水溶液显酸性,则该溶液中各种离子的浓度由大到小的顺序为________ ,向该溶液中滴入少量的氢氧化钡溶液时发生反应的离子方程式为___________ 。
(1)A、B、C形成的此化合物中存在的化学键的类型有
(2)B、C、D、H四种元素的第一电离能由大到小的顺序为
(3)A、C、G可形成一种相对分子质量为46的一元羧酸分子,其分子中存在的σ键和π键的数目之比为
(4)等浓度、等体积的盐酸和氢氧化钠溶液分别与足量的D的单质反应放出的气体在常温常压下的体积比为
(5)由A、C、F可形成两种酸类化合物,用离子方程式说明它们的酸性强弱
您最近一年使用:0次
解题方法
8 . A、B、C、D、E都是短周期元素,原子序数依次增大 ,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶1和1∶1分别形成两种化合物甲和乙。D、A按原子个数比3∶2形成化合物丙。E是地壳中含量最高 的金属 元素。根据以上信息回答下列问题:
(1)B元素在周期表中的位置是___________________________ 。
(2)A、B、C、D、E五种元素的原子半径由大到小的顺序是(用元素符号填写 )______________ 。
(3)写出E的最高价氧化物对应的水化物分别与A、C两元素的最高价氧化物对应的水化物反应的离子方程式:
①_________________________________ ;
②_____________________________________________ 。
(4)D、A按原子个数比3∶2形成化合物丙的化学式为____________ 。
(1)B元素在周期表中的位置是
(2)A、B、C、D、E五种元素的原子半径由大到小的顺序是(
(3)写出E的最高价氧化物对应的水化物分别与A、C两元素的最高价氧化物对应的水化物反应的离子方程式:
①
②
(4)D、A按原子个数比3∶2形成化合物丙的化学式为
您最近一年使用:0次
2016-12-09更新
|
355次组卷
|
5卷引用:2015-2016学年山东大学附中实验学校高一下第一次月考化学试卷
9 . A、B、C、D、E为原子序数递增的短周期元素,在周期表中A是原子半径最小的元素,B、C左右相邻,C、D同主族,D和E的气态氢化物具有相同的电子数,C的单质只有氧化性。
(1)写出实验室制取E2反应的离子方程式_______________________________ ;
(2)A、C元素按原子个数比为1:1形成化合物的电子式_________________ ;
(3)某小组设计如图所示的装置(图中夹持和加热装置略去),分别研究DC2和E2的性质.
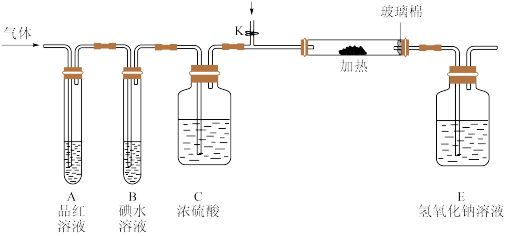
①分别通入DC2和E2,在装置A中观察到的现象是否相同(填“相同”或“不相同”)________ ;若装置D中装的是铁粉,当通入E2时D中观察到的现象为____________ ;若装置D中装的是五氧化二钒,当通入DC2时,打开K通入适量C2,化学反应方程式为________________________________ 。
②若装置B中装有5.0mL l.0×10-3mol/L的碘水,当通入足量E2完全反应后,转 移了5.0×10-5mol电子,则该反应的化学方程式为_______________________________ 。
(4)某同学将足量的DC2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入过量(填字母)_________ ,可以看到白色沉淀生成;
A、氨水 B、稀盐酸 C、稀硝酸 D、氯化钙
(5)若由元素D和C组成一2价酸根Z,Z中D和C的质量比为D:C=4:3,当E2与含Z的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化铡溶液,有白色沉淀产生.与出E2与Z的溶液完全反应产生浅黄色沉淀的离子方程式______________________________ 。
(6)A、B、C三种元素组成的碱性物质N,A、B、C、D和一种常见金属元素组成相对分子质量为392的化合物M,1molM中含有6mol结晶水,对化合物M进行如下实验:
a.取含有0.1molM的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和4.48L(标况)无色刺激性气味气体,经一段时间白色沉淀变为灰绿色,最终变为红褪色;
b.另以含有0.1molM的溶液,加入过量BaCl2溶液产生46.6g白色沉淀,加盐酸沉淀不溶解。
①M的化学式为____________________________ 。
②在25℃下,测定浓度均为amol/L的化合物N和M的混合溶液pH=7,且含金属离子的浓度为bmol/L,则溶液里除H+、金属阳离子外的阳离子浓度为__________ mol/L。
(1)写出实验室制取E2反应的离子方程式
(2)A、C元素按原子个数比为1:1形成化合物的电子式
(3)某小组设计如图所示的装置(图中夹持和加热装置略去),分别研究DC2和E2的性质.

①分别通入DC2和E2,在装置A中观察到的现象是否相同(填“相同”或“不相同”)
②若装置B中装有5.0mL l.0×10-3mol/L的碘水,当通入足量E2完全反应后,转 移了5.0×10-5mol电子,则该反应的化学方程式为
(4)某同学将足量的DC2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入过量(填字母)
A、氨水 B、稀盐酸 C、稀硝酸 D、氯化钙
(5)若由元素D和C组成一2价酸根Z,Z中D和C的质量比为D:C=4:3,当E2与含Z的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化铡溶液,有白色沉淀产生.与出E2与Z的溶液完全反应产生浅黄色沉淀的离子方程式
(6)A、B、C三种元素组成的碱性物质N,A、B、C、D和一种常见金属元素组成相对分子质量为392的化合物M,1molM中含有6mol结晶水,对化合物M进行如下实验:
a.取含有0.1molM的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和4.48L(标况)无色刺激性气味气体,经一段时间白色沉淀变为灰绿色,最终变为红褪色;
b.另以含有0.1molM的溶液,加入过量BaCl2溶液产生46.6g白色沉淀,加盐酸沉淀不溶解。
①M的化学式为
②在25℃下,测定浓度均为amol/L的化合物N和M的混合溶液pH=7,且含金属离子的浓度为bmol/L,则溶液里除H+、金属阳离子外的阳离子浓度为
您最近一年使用:0次
10-11高一下·广东惠州·期末
10 . 有W、X、Y、Z四种短周期元素,它们的核电荷数依次增大; W元素原子是所有原子中半径最小的; X元素原子L层电子数是K层电子数的3倍, Y元素原子的最外层电子数与电子层数相同;Z元素原子的最外层电子数比次外层少1。由此可知:
(1)写出它们的元素符号W_______ X______ Y_______ Z________ .
(2)X在元素周期表中的位置是____________________________ 。
(1)写出它们的元素符号W
(2)X在元素周期表中的位置是
您最近一年使用:0次



