22-23高二上·四川雅安·期中
名校
解题方法
1 . 现有A、B、C、D、E、F、G、H、I九种元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题。
A:核外电子数和电子层数相等,也是宇宙中最丰富的元素
B:形成化合物种类最多的元素
C:基态原子的核外p能级电子数比s能级电子数少1
D:基态原子的核外p轨道中有两个未成对电子
E:气态基态原子的第一至第四电离能分别是:I1=738 kJ/mol,I2=1451 kJ/mol,I3=7733 kJ/mol,I4=10540 kJ/mol
F:同周期元素的简单离子中半径最小
G:主族序数与周期数的差为4
H:前四周期主族元素中电负性最小
I:位于元素周期表中的第八列
(1)C2A4的电子式为_______ 。
(2)B元素的原子核外共有_______ 种不同运动状态的电子。
(3)某同学推断E元素基态原子的核外电子轨道表示式为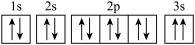 。该同学所画的轨道表示式违背了
。该同学所画的轨道表示式违背了_______ ,解释E元素原子的第一电高能大于F元素原子的第一电离能的原因:_______ 。
(4)用惰性电极电解熔融的EG2制备E单质的化学方程式为_______ 。
(5)与F元素成“对角线规则”关系的某短周期元素T的最高价氧化物的水化物具有两性,写出该两性物质与H元素的最高价氧化物的水化物反应的离子方程式:_______ ;已知T元素和Cl元素的电负性分别为1.5和3.0,则它们形成的化合物是_______ (填“离子化合物”或“共价化合物”)。
(6)与H元素同周期的基态原子中,未成对电子数与H原子相同的元素有_______ 种。
(7)I位于元素周期表中____ 区(按电子排布分区),实验室检验I3+的离子方程式为:____ 。
A:核外电子数和电子层数相等,也是宇宙中最丰富的元素
B:形成化合物种类最多的元素
C:基态原子的核外p能级电子数比s能级电子数少1
D:基态原子的核外p轨道中有两个未成对电子
E:气态基态原子的第一至第四电离能分别是:I1=738 kJ/mol,I2=1451 kJ/mol,I3=7733 kJ/mol,I4=10540 kJ/mol
F:同周期元素的简单离子中半径最小
G:主族序数与周期数的差为4
H:前四周期主族元素中电负性最小
I:位于元素周期表中的第八列
(1)C2A4的电子式为
(2)B元素的原子核外共有
(3)某同学推断E元素基态原子的核外电子轨道表示式为
 。该同学所画的轨道表示式违背了
。该同学所画的轨道表示式违背了(4)用惰性电极电解熔融的EG2制备E单质的化学方程式为
(5)与F元素成“对角线规则”关系的某短周期元素T的最高价氧化物的水化物具有两性,写出该两性物质与H元素的最高价氧化物的水化物反应的离子方程式:
(6)与H元素同周期的基态原子中,未成对电子数与H原子相同的元素有
(7)I位于元素周期表中
您最近一年使用:0次
名校
解题方法
2 . A、B、C、D、E、F、G是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如表所示,请回答下列问题。
(1)A在元素周期表中的位置为___________ ,画出基态B原子的轨道表示式___________ 。
(2)B的简单气态氢化物的沸点___________ (填“高于”或“低于”)PH3,原因是___________ 。
(3)A、B、C三种元素的电负性由高到低的排列次序为___________ (用元素符号表示)。
(4)已知元素A、B形成的 链状分子中所有的原子都满足8电子稳定结构,则其分子中
链状分子中所有的原子都满足8电子稳定结构,则其分子中 键与
键与 键数目之比为
键数目之比为___________ 。
(5)G元素可形成 、
、 ,其中较稳定的是
,其中较稳定的是 ,原因是
,原因是___________ 。
(6)短周期元素 与元素
与元素 在周期表中的位置呈现对角线关系,已知元素
在周期表中的位置呈现对角线关系,已知元素 、
、 的电负性分别为1.5和3.0,预测它们形成的化合物是
的电负性分别为1.5和3.0,预测它们形成的化合物是___________ (填“离子”或“共价”)化合物。推测 的最高价氧化物对应的水化物
的最高价氧化物对应的水化物___________ (填“能”或“不能”)与 的最高价氧化物对应水化物发生反应。
的最高价氧化物对应水化物发生反应。
| A | 原子核外有6个电子 |
| B | 原子序数比 大1 大1 |
| C | 基态原子中 电子总数与p电子总数相等 电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子价层电子排布式为3s23p1 |
| F | 基态原子的最外层p 轨道有2个电子的自旋状态与其他电子的自旋状态相反 |
| G | 生活中使用最多的一种金属,其高价氯化物的盐溶液常用于刻蚀铜制印刷电路板 |
(2)B的简单气态氢化物的沸点
(3)A、B、C三种元素的电负性由高到低的排列次序为
(4)已知元素A、B形成的
 链状分子中所有的原子都满足8电子稳定结构,则其分子中
链状分子中所有的原子都满足8电子稳定结构,则其分子中 键与
键与 键数目之比为
键数目之比为(5)G元素可形成
 、
、 ,其中较稳定的是
,其中较稳定的是 ,原因是
,原因是(6)短周期元素
 与元素
与元素 在周期表中的位置呈现对角线关系,已知元素
在周期表中的位置呈现对角线关系,已知元素 、
、 的电负性分别为1.5和3.0,预测它们形成的化合物是
的电负性分别为1.5和3.0,预测它们形成的化合物是 的最高价氧化物对应的水化物
的最高价氧化物对应的水化物 的最高价氧化物对应水化物发生反应。
的最高价氧化物对应水化物发生反应。
您最近一年使用:0次
2022-07-25更新
|
962次组卷
|
3卷引用:第一章 原子结构与性质(B卷·能力提升练)-2022-2023学年高二化学分层训练AB卷(人教版2019选择性必修2)
3 . 现有六种元素A、B、C、D、E、F,其中A、B、C、D、E为短周期主族元素,F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)某同学根据上述信息,推断A基态原子的轨道表示式为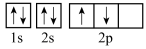 ,该同学所画的轨道表示式违背了
,该同学所画的轨道表示式违背了_______ 。
(2)B元素的电负性_______ (填“大于”“小于”或“等于”)C元素的电负性。
(3)C与D形成的化合物所含有的化学键类型为_______ 。
(4)E基态原子中能量最高的电子,其电子云在空间有_______ 个伸展方向。
(5)下列关于F原子的价电子轨道表示式正确的是_______ 。
a.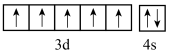 b.
b.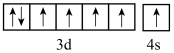
c. d.
d.
(6)基态 核外电子排布式为
核外电子排布式为_______ 。过量单质F与B的最高价氧化物对应的水化物的稀溶液完全反应,生成BC气体,该反应的离子方程式为_______ 。
| A元素形成的物质种类繁多,其形成的一种固体单质工业上常用作切割工具 |
| B元素原子的核外p电子数比s电子数少1 |
| C元素基态原子p轨道有两个未成对电子 |
D元素原子的第一至第四电离能分别是: ; ;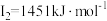 ; ;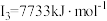 ; ; |
| E原子核外所有p轨道全满或半满 |
| F在周期表的第8纵列 |
 ,该同学所画的轨道表示式违背了
,该同学所画的轨道表示式违背了(2)B元素的电负性
(3)C与D形成的化合物所含有的化学键类型为
(4)E基态原子中能量最高的电子,其电子云在空间有
(5)下列关于F原子的价电子轨道表示式正确的是
a.
 b.
b.
c.
 d.
d.
(6)基态
 核外电子排布式为
核外电子排布式为
您最近一年使用:0次
2022-08-22更新
|
777次组卷
|
4卷引用:专题2 原子结构与元素性质 本专题达标检测
20-21高二·全国·单元测试
解题方法
4 . 现有部分短周期元素的性质或原子结构如下表:
(1)写出元素X的离子结构示意图_______ 。
(2)写出Y元素最高价氧化物的水化物与NaOH溶液反应的离子方程式_______ 。
(3)写出Z与Y的电子排布式_______ 、_______ 。
(4)元素T与氯元素相比,非金属性较强的是_______ (用元素符号表示),下列表述中能证明这一事实的是_______ 。
A.气态氢化物的挥发性和稳定性
B.单质分子中的键能
C.两元素的电负性
D.含氧酸的酸性
E.氢化物中X—H键的键长(X代表T和Cl两种元素)
F.两单质在自然界中的存在形式
(5)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是_______ (填元素符号),理由是_______ 。
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| X | L层p电子数比s电子数多2个 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | L层有三个未成对电子 |
(2)写出Y元素最高价氧化物的水化物与NaOH溶液反应的离子方程式
(3)写出Z与Y的电子排布式
(4)元素T与氯元素相比,非金属性较强的是
A.气态氢化物的挥发性和稳定性
B.单质分子中的键能
C.两元素的电负性
D.含氧酸的酸性
E.氢化物中X—H键的键长(X代表T和Cl两种元素)
F.两单质在自然界中的存在形式
(5)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的单质中化学性质明显不同于其他三种单质的是
您最近一年使用:0次
名校
解题方法
5 . 现有部分短周期元素的信息如表所示:
A、B、D三种单质(分别由X、Y、Z元素组成)和甲、乙、丙、丁、戊五种化合物之间的转化关系如图所示(某些条件已略去)。其中丁是一种筒能燃料,分子中含有18个电子,其组成元素与丙相同。
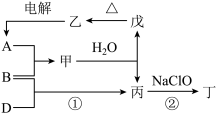
(1)元素X在周期表中的位置是______ ,其简单离子的结构示意图为______ 。
(2)单质B的电子式为______ 。
(3)丙中所含的化学键类型是______ (填序号)。
a.离子键 b.极性共价键 c.非极性共价键
(4)反应②中,0.5 mol 参加反应时转移1 mol电子,该反应的化学方程式为
参加反应时转移1 mol电子,该反应的化学方程式为______ 。
(5)一定条件下,A与 、C(石墨)反应只生成乙和碳化钛(
、C(石墨)反应只生成乙和碳化钛( ),二者均为某些高温结构陶瓷的主要成分,该反应的化学方程式为
),二者均为某些高温结构陶瓷的主要成分,该反应的化学方程式为______ 。
| 元素编号 | 元素性质或原子结构信息 |
| X | 第三周期元素中简单离子半径最小的元素 |
| Y | 其最简单氢化物丙的水溶液呈碱性 |
| Z | 原子核外电子数和所在周期数相等 |

(1)元素X在周期表中的位置是
(2)单质B的电子式为
(3)丙中所含的化学键类型是
a.离子键 b.极性共价键 c.非极性共价键
(4)反应②中,0.5 mol
 参加反应时转移1 mol电子,该反应的化学方程式为
参加反应时转移1 mol电子,该反应的化学方程式为(5)一定条件下,A与
 、C(石墨)反应只生成乙和碳化钛(
、C(石墨)反应只生成乙和碳化钛( ),二者均为某些高温结构陶瓷的主要成分,该反应的化学方程式为
),二者均为某些高温结构陶瓷的主要成分,该反应的化学方程式为
您最近一年使用:0次
名校
6 . X、Y、Z、W是原子序数由小到大顺序排列的四种短周期元素,其中X、Z、W可分别与氢元素组成共价化合物 、
、 和
和 ;Y与氧元素可组成离子化合物
;Y与氧元素可组成离子化合物 和
和 。
。
(1)写出 的电子式:
的电子式:_______ ,其中含有的化学键类型是__________ 。
(2)Z元素在元素周期表中的位置是第________ 周期第_______ 族。X和Z形成的一种二元化合物会导致温室效应,其相对分子质量在170~190之间,且Z的质量分数约为70%,该化合物的化学式为____ 。
(3) 、
、 和
和 三种化合物,其中一种与另外两种都能反应,该化合物是
三种化合物,其中一种与另外两种都能反应,该化合物是______ (填化学式)。
(4)由X、W组成的化合物分子中,X、W原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出该反应的化学方程式:_______________ 。
 、
、 和
和 ;Y与氧元素可组成离子化合物
;Y与氧元素可组成离子化合物 和
和 。
。(1)写出
 的电子式:
的电子式:(2)Z元素在元素周期表中的位置是第
(3)
 、
、 和
和 三种化合物,其中一种与另外两种都能反应,该化合物是
三种化合物,其中一种与另外两种都能反应,该化合物是(4)由X、W组成的化合物分子中,X、W原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出该反应的化学方程式:
您最近一年使用:0次
2020-09-03更新
|
859次组卷
|
4卷引用:人教版(2019)高一必修第一册 第四章素养检测
7 . W、X、Y、Z是元素周期表中的四种短周期元素,其相关信息及原子半径与原子序数的关系如表所示。请回答下列问题:
(1)W在元素周期表中的位置是___ ,W与X形成的含有共价键的常见化合物的电子式为___ 。
(2)X、Z的简单离子的半径大小为__ (用离子符号表示)。
(3)Y的最高价氧化物与单质碳在高温下反应的化学方程式为__ ;Z的简单氢化物与X的最高价氧化物对应的水化物反应的离子方程式为__ 。
(4)最高价氧化物对应水化物的酸性:Y__ (填“大于”或“小于”,下同)磷;第一电离能:Y__ 磷。
| 元素 | 相关信息 | 原子半径与原子序数的关系 |
| W | 其一种核素的质量数为18,中子数为10 |  |
| X | 其原子与电子排布式为1s22s22p6的原子的核外电子数相差1 | |
| Y | 其单质是一种常见的半导体材料 | |
| Z | 电负性在同周期元素中最大 |
(2)X、Z的简单离子的半径大小为
(3)Y的最高价氧化物与单质碳在高温下反应的化学方程式为
(4)最高价氧化物对应水化物的酸性:Y
您最近一年使用:0次
2021-04-14更新
|
511次组卷
|
2卷引用:第一章原子结构与性质(提升卷)
21-22高二·全国·单元测试
8 . 有四种短周期元素,它们的结构或性质等信息如表所述。
请根据表中信息填写:
(1)A原子的核外电子排布式:___________ 。
(2)B元素在周期表中的位置:___________ ;离子半径:B___________ (填“大于”或“小于”)A。
(3)C原子的核外电子轨道表示式是___________ ,其原子核外有___________ 个未成对电子。
(4)D原子的核外电子排布式为___________ ,D-的结构示意图是___________ 。
| 元素 | 结构或性质 |
| A | A是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
| B | B与A同周期,其最高价氧化物的水化物呈两性 |
| C | 元素的气态氢化物极易溶于水,其单质可用作制冷剂 |
| D | D是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
(1)A原子的核外电子排布式:
(2)B元素在周期表中的位置:
(3)C原子的核外电子轨道表示式是
(4)D原子的核外电子排布式为
您最近一年使用:0次
名校
9 . A、B、C、D、E五种短周期元素,A与D同周期,A的单质既可与盐酸反应,又可与NaOH溶液反应,B的单质在放电条件下能与氧气反应,C的常见离子不含电子,D元素原子的最外层电子数是其次外层电子数的 ,E元素原子的最外层电子数是其次外层电子数的3倍。
,E元素原子的最外层电子数是其次外层电子数的3倍。
(1)A的简单离子结构示意图为___________ ,E元素在周期表的位置是___________ 。
(2)用电子式表示C的氧化物的形成过程:___________ 。
(3)B、D、E的简单氢化物的沸点由高到低的顺序为___________ 。
(4)化合物甲由元素A、B组成,具有绝缘性。化合物甲能与水缓慢反应生成化合物乙。乙分子中含有10个电子,写出该反应的化学方程式:___________ 。
(5)化学家鲍林在研究含氧酸的酸性强弱时,提出了一个定性规则:含氧酸分子中的非羟基(注:羟基是—OH)氧原子数与酸性强弱有关。设含氧酸化学式为HnROm,则非羟基氧原子数为m-n,其数值越大,该含氧酸的酸性越强。鲍林认为含氧酸的酸性强弱与非羟基氧原子数(m-n)有如下关系:
①根据规则判断H2CrO4、HMnO4酸性由强到弱的顺序为___________ 。
②As为第VA族元素,H3AsO3为弱酸,H3PO3为中强酸,试推断H3AsO3分子的结构简式为___________ ,H3PO3分子的结构简式为___________ 。
 ,E元素原子的最外层电子数是其次外层电子数的3倍。
,E元素原子的最外层电子数是其次外层电子数的3倍。(1)A的简单离子结构示意图为
(2)用电子式表示C的氧化物的形成过程:
(3)B、D、E的简单氢化物的沸点由高到低的顺序为
(4)化合物甲由元素A、B组成,具有绝缘性。化合物甲能与水缓慢反应生成化合物乙。乙分子中含有10个电子,写出该反应的化学方程式:
(5)化学家鲍林在研究含氧酸的酸性强弱时,提出了一个定性规则:含氧酸分子中的非羟基(注:羟基是—OH)氧原子数与酸性强弱有关。设含氧酸化学式为HnROm,则非羟基氧原子数为m-n,其数值越大,该含氧酸的酸性越强。鲍林认为含氧酸的酸性强弱与非羟基氧原子数(m-n)有如下关系:
| m-n | 0 | 1 | 2 | 3 |
| 含氧酸强度 | 弱 | 中强 | 强 | 很强 |
| 实例 | HClO | H3PO4 | HNO3 | HClO4 |
②As为第VA族元素,H3AsO3为弱酸,H3PO3为中强酸,试推断H3AsO3分子的结构简式为
您最近一年使用:0次
2021-01-12更新
|
521次组卷
|
4卷引用:专题1 揭示物质结构的奥秘 本专题达标检测
专题1 揭示物质结构的奥秘 本专题达标检测(已下线)【知识图鉴】单元讲练测选择性必修2第二章03单元测【全国百强校】辽宁省沈阳市东北育才学校2018-2019学年高一下学期期中考试化学试题专题5 本专题达标检测-高中化学苏教2019版必修第一册
名校
解题方法
10 . 下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:
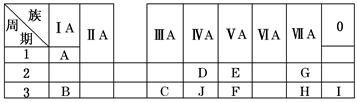
(1)表中元素,化学性质最不活泼的是________ ,只有负价而无正价的元素是________ 。
(2)C元素在元素周期表中的位置是第三周期第________ 族。
(3)最高价氧化物的水化物酸性最强的是________ ,呈两性的是________ 。
(4)A分别与E、G、H形成的化合物中,最稳定的是________ 。
(5)在B、C、E、F中,原子半径最大的是________ 。
(6)B、H两种元素所形成的化合物所含的化学键类型为________________ 。
(7)写出C的最高价氧化物与H的氢化物之间反应的离子方程式:__________________________ 。
(8)写出B与C两种元素的最高价氧化物对应的水化物相互反应的化学方程式:________________________________________________________________________ 。

(1)表中元素,化学性质最不活泼的是
(2)C元素在元素周期表中的位置是第三周期第
(3)最高价氧化物的水化物酸性最强的是
(4)A分别与E、G、H形成的化合物中,最稳定的是
(5)在B、C、E、F中,原子半径最大的是
(6)B、H两种元素所形成的化合物所含的化学键类型为
(7)写出C的最高价氧化物与H的氢化物之间反应的离子方程式:
(8)写出B与C两种元素的最高价氧化物对应的水化物相互反应的化学方程式:
您最近一年使用:0次
2018-02-11更新
|
1887次组卷
|
5卷引用:人教版2017-2018学年高一化学必修二同步训练:第一章 物质结构 元素周期律



