名校
解题方法
1 . 元素周期表的形式多种多样,如图是扇形元素周期表的一部分,回答下列问题:
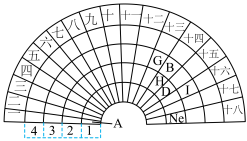
(1)已知 的最外层电子数为2,则
的最外层电子数为2,则 的原子结构示意图为
的原子结构示意图为___________ 。
(2)元素B的最高价氧化物能溶于一种酸,发生反应的化学方程式为___________ ;元素 的最高价氧化物的电子式为
的最高价氧化物的电子式为___________ 。
(3)下列不能证明非金属性: 的是
的是___________ (填字母)。
a.气态氢化物的稳定性:
b.含氧酸的酸性:
c.气态氢化物的还原性:
(4)用A、D、G表示上述周期表中相应元素形成的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物。戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应。丁是一种高能燃料,其组成元素与丙相同, 丁分子中含有
丁分子中含有 电子。
电子。
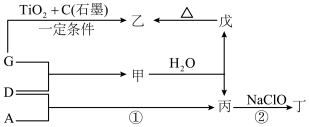
①戊的化学式为___________ 。
②丁中所含化学键类型是___________ 。
③甲被大量用于制造电子元件,工业上用乙、H的单质和D的单质在高温下制备甲,其中乙和H单质的物质的量之比为 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。

(1)已知
 的最外层电子数为2,则
的最外层电子数为2,则 的原子结构示意图为
的原子结构示意图为(2)元素B的最高价氧化物能溶于一种酸,发生反应的化学方程式为
 的最高价氧化物的电子式为
的最高价氧化物的电子式为(3)下列不能证明非金属性:
 的是
的是a.气态氢化物的稳定性:

b.含氧酸的酸性:

c.气态氢化物的还原性:

(4)用A、D、G表示上述周期表中相应元素形成的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物。戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应。丁是一种高能燃料,其组成元素与丙相同,
 丁分子中含有
丁分子中含有 电子。
电子。
①戊的化学式为
②丁中所含化学键类型是
③甲被大量用于制造电子元件,工业上用乙、H的单质和D的单质在高温下制备甲,其中乙和H单质的物质的量之比为
 ,该反应的化学方程式为
,该反应的化学方程式为
您最近半年使用:0次
2 . 回答下列问题:
(1)氟原子激发态的电子排布式有______ ,其中能量较高的是______ 。(填标号)
a.1s22s22p43s1 b.1s22s22p43d2 c.1s22s12p5 d.1s22s22p33p2
(2)某元素原子的位于周期表的第四周期,元素原子的最外层只有一个电子,其次外层内的所以轨道电子均成对。该元素位于周期表的______ 区,写出该基态原子电子排布式为______ 。
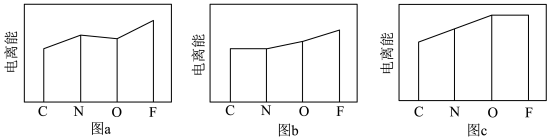
(3)图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是______ (填标号),判断的根据是______ ;第三电离能的变化图是______ (填标号)。
(4)短周期元素X、Y、Z、W的原子序数依次增大。根据表中信息完成下列空白。
①元素的电负性:Z______ W(填“大于”“小于”或“等于”)。
②简单离子半径:W______ Y(填“大于”“小于”或“等于”)。
③氢化物的稳定性:X______ Z(填“大于”“小于”或“等于”)。
(1)氟原子激发态的电子排布式有
a.1s22s22p43s1 b.1s22s22p43d2 c.1s22s12p5 d.1s22s22p33p2
(2)某元素原子的位于周期表的第四周期,元素原子的最外层只有一个电子,其次外层内的所以轨道电子均成对。该元素位于周期表的
(3)图a、b、c分别表示C、N、O和F的逐级电离能I变化趋势(纵坐标的标度不同)。第一电离能的变化图是

(4)短周期元素X、Y、Z、W的原子序数依次增大。根据表中信息完成下列空白。
| 元素 | X | Y | Z | W |
| 最高价氧化物的水化物 | H3ZO4 | |||
| 0.1 mol∙L−1溶液对应的pH(25℃) | 1.00 | 13.00 | 1.57 | 0.70 |
②简单离子半径:W
③氢化物的稳定性:X
您最近半年使用:0次
2023-01-03更新
|
420次组卷
|
2卷引用:天津市和平区2022-2023学年高二上学期期末质量调查化学试卷
3 . 短周期主族元素 、
、 、
、 、
、 的原子序数依次增大,
的原子序数依次增大, 的简单氢化物可用作制冷剂,
的简单氢化物可用作制冷剂, 的原子半径是所有短周期主族元素中最大的。由
的原子半径是所有短周期主族元素中最大的。由 、
、 和
和 三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。则
三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。则 、
、 、
、 、
、 分别为
分别为_______ 。
 、
、 、
、 、
、 的原子序数依次增大,
的原子序数依次增大, 的简单氢化物可用作制冷剂,
的简单氢化物可用作制冷剂, 的原子半径是所有短周期主族元素中最大的。由
的原子半径是所有短周期主族元素中最大的。由 、
、 和
和 三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。则
三种元素形成的一种盐溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。则 、
、 、
、 、
、 分别为
分别为
您最近半年使用:0次
4 . 下图是元素周期表的一部分,所列的字母分别代表一种化学元素。试回答下列问题:
(1)基态n原子中,核外电子占据最高能层的符号是_______ ,占据该能层的电子云轮廓图形状为_______ 。
(2)h的单质在空气中燃烧发出耀眼的白光,从原子结构角度解释是涉及电子从能量较高的轨道跃迁到能量较低的轨道时,以光(子)的形式释放能量,以下现象与该原理一样的是_______ 。
A.燃放焰火 B.棱镜分出的光 C.霓虹灯射出五颜六色的光
(3)o、p(序号)两元素的部分电离能数据列于下表:
①o元素价电子的轨道表示式为_______ 。
②比较两元素的 、
、 可知,气态
可知,气态 再失去一个电子比气态
再失去一个电子比气态 再失去一个电子难。对此,你认为原因可能是
再失去一个电子难。对此,你认为原因可能是_______ 。
(4)元素的基态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能,c、d、e三元素中,电子亲和能从大到小的顺序为_______ (填元素符号)。
(5)表中所列的某主族元素的电离能情况如图所示,写出该元素的最高价氧化物对应的水化物与g的最高价氧化物对应的水化物反应的离子方程式_______ 。
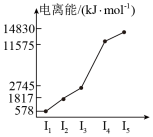
| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | o | p | |||||||||||||||
(2)h的单质在空气中燃烧发出耀眼的白光,从原子结构角度解释是涉及电子从能量较高的轨道跃迁到能量较低的轨道时,以光(子)的形式释放能量,以下现象与该原理一样的是
A.燃放焰火 B.棱镜分出的光 C.霓虹灯射出五颜六色的光
(3)o、p(序号)两元素的部分电离能数据列于下表:
| 元素 | o | p | |
电离能 |  | 717 | 759 |
 | 1509 | 1561 | |
 | 3248 | 2957 | |
②比较两元素的
 、
、 可知,气态
可知,气态 再失去一个电子比气态
再失去一个电子比气态 再失去一个电子难。对此,你认为原因可能是
再失去一个电子难。对此,你认为原因可能是(4)元素的基态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能,c、d、e三元素中,电子亲和能从大到小的顺序为
(5)表中所列的某主族元素的电离能情况如图所示,写出该元素的最高价氧化物对应的水化物与g的最高价氧化物对应的水化物反应的离子方程式

您最近半年使用:0次
5 . 组成A、B、C、D分子的元素原子序数均小于10,它们之间能发生如下图所示的反应。其中A的水溶液能使酚酞试液变红,组成B的元素的电负性在周期表中最大。请写出A、B、C、D的化学式:
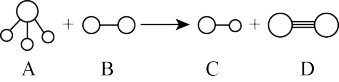
A_______ ;B_______ ;C_______ ;D_______ 。

A
您最近半年使用:0次
6 . 根据相应信息回答有关问题。
I.物质结构和规律推断
如图为周期表中短周期的一部分,已知A是地壳中含量最多的元素。
(1)比较A、C的原子半径大小_______ (用原子符号表示)。
(2)比较C、D的简单氢化物的稳定性_______ (用化学式表示)。
II.实验操作和现象分析
(3)配制100ml0.1mol/L的NaOH溶液时,若仰视定容,则所配溶液的物质的量浓度_______ (填“偏大”、“偏小”或“不变")。
(4)将适量Ba(OH)2•8H2O晶体与NH4Cl晶体放入烧杯中,用玻璃棒快速搅拌,试着拿起烧杯观察,晶体变成糊状,此外还可观察到_______ 等现象。
III物质性质和成分探究
(5)将二氧化硫气体通入到品红溶液中,溶液褪色,体现了二氧化硫的_______ 性。
(6)在实验室,浓硝酸保存在棕色试剂瓶中,因浓硝酸见光或受热易分解,产生有刺激性气味的红棕色气体,该气体为_______ (用化学式表示)。
I.物质结构和规律推断
如图为周期表中短周期的一部分,已知A是地壳中含量最多的元素。
| A | ||
| B | C | D |
(1)比较A、C的原子半径大小
(2)比较C、D的简单氢化物的稳定性
II.实验操作和现象分析
(3)配制100ml0.1mol/L的NaOH溶液时,若仰视定容,则所配溶液的物质的量浓度
(4)将适量Ba(OH)2•8H2O晶体与NH4Cl晶体放入烧杯中,用玻璃棒快速搅拌,试着拿起烧杯观察,晶体变成糊状,此外还可观察到
III物质性质和成分探究
(5)将二氧化硫气体通入到品红溶液中,溶液褪色,体现了二氧化硫的
(6)在实验室,浓硝酸保存在棕色试剂瓶中,因浓硝酸见光或受热易分解,产生有刺激性气味的红棕色气体,该气体为
您最近半年使用:0次
名校
7 . 为纪念元素周期表诞生150周年,IUPAC等向世界介绍118位优秀青年化学家,并形成一张“青年化学家元素周期表”。中国学者雷晓光、姜雪峰、刘庄分别成为“N、S、Hg”元素的代言人。请回答下列问题:
(1)据汞的原子结构示意图 ,汞在第
,汞在第____ 周期。
(2)NH3、H2O、H2S分别为氮、氧、硫3种元素对应的氢化物,其中沸点最高的是____ 。
(3)下列有关性质的比较能用元素周期律解释的是____ (填字母,下同)。
a.酸性:HCl>H2SO3 b.非金属性:O>S
c.碱性:NaOH>Mg(OH)2 d.热稳定性:Na2CO3>NaHCO3
(4)硒(Se)与硫位于同一主族,均是生命必需元素。下列推断正确的是____ 。
a.硒元素的最低负化合价为-2
b.二氧化硒(SeO2)具有还原性
c.硒的氧化物对应的水化物属于强酸
(5)科学家合成了一种新化合物(如图所示),其中R、X、Y、Z为同一短周期元素,Z核外最外层电子数是Y核外电子数的一半。

①R的元素符号为____ 。
②X的氢化物的电子式:____ 。
③写出Y的最高价氧化物的一种用途____ 。
(1)据汞的原子结构示意图
 ,汞在第
,汞在第(2)NH3、H2O、H2S分别为氮、氧、硫3种元素对应的氢化物,其中沸点最高的是
(3)下列有关性质的比较能用元素周期律解释的是
a.酸性:HCl>H2SO3 b.非金属性:O>S
c.碱性:NaOH>Mg(OH)2 d.热稳定性:Na2CO3>NaHCO3
(4)硒(Se)与硫位于同一主族,均是生命必需元素。下列推断正确的是
a.硒元素的最低负化合价为-2
b.二氧化硒(SeO2)具有还原性
c.硒的氧化物对应的水化物属于强酸
(5)科学家合成了一种新化合物(如图所示),其中R、X、Y、Z为同一短周期元素,Z核外最外层电子数是Y核外电子数的一半。

①R的元素符号为
②X的氢化物的电子式:
③写出Y的最高价氧化物的一种用途
您最近半年使用:0次
名校
8 . R是短周期主族元素,其氧化物通式为 。根据下列信息,回答相关问题:
。根据下列信息,回答相关问题:
(1)若R的单质是黄绿色气体(常温常压下), 是绿色环保型饮用水消毒剂,则
是绿色环保型饮用水消毒剂,则 的化学式为
的化学式为_______ 。
(2)若 在常温常压下为红棕色气体。则实验室用铜和某酸制备
在常温常压下为红棕色气体。则实验室用铜和某酸制备 的离子方程式为
的离子方程式为_______ 。实验室用_______ (填化学式)溶液吸收尾气中 。
。
(3)若 用作光导纤维的原料,其单质R是半导体材料。工业上,以
用作光导纤维的原料,其单质R是半导体材料。工业上,以 为原料制备其单质R的化学方程式为
为原料制备其单质R的化学方程式为_______ 。 能与烧碱溶液反应,其离子方程式为
能与烧碱溶液反应,其离子方程式为_______ 。
(4)若向空气中大量排放 会形成酸雨,则
会形成酸雨,则 的化学式可能是
的化学式可能是_______ 。随着“酸雨”在空气中放置时间延长, 下降,其主要原因是
下降,其主要原因是_______ 。
(5)若空气中大量排放 会导致温室效应加剧,但
会导致温室效应加剧,但 又是温室里作物生长的肥料。固态
又是温室里作物生长的肥料。固态 外形与冰相似,俗名是
外形与冰相似,俗名是_______ 。
 。根据下列信息,回答相关问题:
。根据下列信息,回答相关问题:(1)若R的单质是黄绿色气体(常温常压下),
 是绿色环保型饮用水消毒剂,则
是绿色环保型饮用水消毒剂,则 的化学式为
的化学式为(2)若
 在常温常压下为红棕色气体。则实验室用铜和某酸制备
在常温常压下为红棕色气体。则实验室用铜和某酸制备 的离子方程式为
的离子方程式为 。
。(3)若
 用作光导纤维的原料,其单质R是半导体材料。工业上,以
用作光导纤维的原料,其单质R是半导体材料。工业上,以 为原料制备其单质R的化学方程式为
为原料制备其单质R的化学方程式为 能与烧碱溶液反应,其离子方程式为
能与烧碱溶液反应,其离子方程式为(4)若向空气中大量排放
 会形成酸雨,则
会形成酸雨,则 的化学式可能是
的化学式可能是 下降,其主要原因是
下降,其主要原因是(5)若空气中大量排放
 会导致温室效应加剧,但
会导致温室效应加剧,但 又是温室里作物生长的肥料。固态
又是温室里作物生长的肥料。固态 外形与冰相似,俗名是
外形与冰相似,俗名是
您最近半年使用:0次
2022-04-22更新
|
205次组卷
|
2卷引用:江西省名校2021-2022学年高一下学期期中调研化学试题
名校
解题方法
9 . a、b、c、d为四种由短周期元素构成的中性粒子,它们都有14个电子,且粒子内部以共价键结合。请回答下列问题。
(1)a单质由原子组成,a单质可用作半导体材料,a原子核外电子排布式为____ 。
(2)b是双核化合物,常温下为无色无味气体。b的化学式为____ 。人一旦吸入b气体后,就易引起中毒,是因为____ 。
(3)c是双核单质,写出其电子式:____ 。分子中所含共价键的类型为____ (填“极性键”或“非极性键”)。
(4)d是四核化合物,其结构式为____ ;d分子内σ键与π键的强度大小关系为σ___ π(填“>”“<”或“=”),原因是____ 。
(1)a单质由原子组成,a单质可用作半导体材料,a原子核外电子排布式为
(2)b是双核化合物,常温下为无色无味气体。b的化学式为
(3)c是双核单质,写出其电子式:
(4)d是四核化合物,其结构式为
您最近半年使用:0次
名校
解题方法
10 . 氢是宇宙中最轻的元素,其单质、化合物有许多独特的功能或用途.
(1)“人造太阳”可为人类提供用之不尽的清洁能源,我国在“人造太阳”领域的研究走在世界的前列,其工作原理可表示为 。下列有关上述变化的说法错误的是_______(填序号)。
。下列有关上述变化的说法错误的是_______(填序号)。
(2)下列五种含氢元素的物质:① 、②
、② 、③
、③ 、④
、④ 、⑤
、⑤ ,其中只含有极性键的物质是
,其中只含有极性键的物质是_______ (填序号,下同),含有共价键的离子化合物是_______ , 的结构式为
的结构式为_______ ,NaH的电子式为_______ 。
(3) 是一种温室气体,热稳定性:
是一种温室气体,热稳定性:
_______  (填“>”或“<”).若将
(填“>”或“<”).若将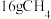 与
与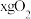 混合点燃,当二者恰好反应完时,得到
混合点燃,当二者恰好反应完时,得到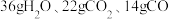 ,写出该燃烧反应的化学方程式:
,写出该燃烧反应的化学方程式:_______ 。
(4)氢元素与X、Y两种短周期主族元素可形成多种三元化合物,已知X、Y的价电子数之和为13且X的原子半径小于Y。写出上述Y呈最高正价时的三元化合物的化学式:_______ ,举例说明非金属性 :
:_______ 。
(1)“人造太阳”可为人类提供用之不尽的清洁能源,我国在“人造太阳”领域的研究走在世界的前列,其工作原理可表示为
 。下列有关上述变化的说法错误的是_______(填序号)。
。下列有关上述变化的说法错误的是_______(填序号)。| A.是化学变化 | B.释放出大量的热量 | C.R是 | D. 是中子 是中子 |
 、②
、②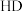 、③
、③ 、④
、④ 、⑤
、⑤ ,其中只含有极性键的物质是
,其中只含有极性键的物质是 的结构式为
的结构式为(3)
 是一种温室气体,热稳定性:
是一种温室气体,热稳定性:
 (填“>”或“<”).若将
(填“>”或“<”).若将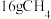 与
与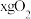 混合点燃,当二者恰好反应完时,得到
混合点燃,当二者恰好反应完时,得到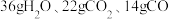 ,写出该燃烧反应的化学方程式:
,写出该燃烧反应的化学方程式:(4)氢元素与X、Y两种短周期主族元素可形成多种三元化合物,已知X、Y的价电子数之和为13且X的原子半径小于Y。写出上述Y呈最高正价时的三元化合物的化学式:
 :
:
您最近半年使用:0次
2022-04-05更新
|
215次组卷
|
2卷引用:河南省商丘市虞城县高级中学2021-2022学年高一上学期期末考试化学试题



