解题方法
1 . X、Y、Z、W、R是短周期元素,原子序数依次增大。X原子核外各层电子数之比为1:2,Y原子和Z原子的核外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。
请回答下列问题:
(1)元素W在周期表中的位置是________ ,XR2的电子式为____ 。
(2)单质X和元素Y的最高价氧化物对应水化物的浓溶液发生反应的化学方程式为___________ 。Y、W的氢化物沸点高的是_______ (写化学式),原因是___________________ 。
(3)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1:3,则该反应的化学方程式为___________ 。
请回答下列问题:
(1)元素W在周期表中的位置是
(2)单质X和元素Y的最高价氧化物对应水化物的浓溶液发生反应的化学方程式为
(3)Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1:3,则该反应的化学方程式为
您最近一年使用:0次
名校
2 . X、Y、Z、W是元素周期表中前四周期原子序数依次增大的四种元素:
(1)W位于元素周期表第________ 周期第__________ 族,其基态原子价电子排布式为__________
(2)与Z同周期且依次相邻的两种元素的原子与Z比较,三者第一电离能的大小顺序为________ (用元素符号表示);Y的氢化物在同族的氢化物中沸点反常,其原因是_________________ 。
(3)XY2的电子式为______ ,该分子的形状为_________ ,含有_____ 个σ键和_________ 个π键。
(4)写出W的单质在潮湿的空气中生成绿色锈斑的化学方程式,并标出电子转移的方向和数目________ 。
| 元素 | 相关信息 |
| X | X的基态原子核外只有三个能级,且各能级电子数相等 |
| Y | Y的基态原子最外层电子数是其内层电总子数的3倍 |
| Z | Z的基态原子价电子排布为nsn-1 |
| W | W的单质是一种常见的红色金属,在潮湿的空气中易生成绿色的锈斑 |
(2)与Z同周期且依次相邻的两种元素的原子与Z比较,三者第一电离能的大小顺序为
(3)XY2的电子式为
(4)写出W的单质在潮湿的空气中生成绿色锈斑的化学方程式,并标出电子转移的方向和数目
您最近一年使用:0次
解题方法
3 . 主族元素A、B、C、D都属于短周期元素,A与D同主族,B与C在同一周期,A、D原子的最外层电子数都是1,C原子最外层电子数比B原子少2个,且C最外层电子数是次外层电子数的2倍。A、B单质在常温下均为气体,它们在高温下以体积比2∶1完全反应,生成物在常温下是液体M。此液体与D单质能剧烈反应生成A的单质。所得溶液滴入酚酞显红色,同时溶液中含有与氖原子的电子层结构相同的阳离子。回答下列问题:
(1)写出B的单核阴离子结构示意图__________ 。
(2)A、B单质在高温下反应生成的液体M的结构式___________ ,写出C在足量B单质中充分反应后生成物的电子式___________ 。
(3)以C的一种单质为电极材料,写出用A、B的单质和KOH溶液构成的原电池的正、负极电极反应式,负极___________ ,正极__________ 。
(4)写出B、D的单质在加热条件下形成化合物的电子式_________ ,其中含有的化学键有__________ 。用电子式表示B、D的单质在常温下反应生成的化合物的形成过程:__________ 。
(1)写出B的单核阴离子结构示意图
(2)A、B单质在高温下反应生成的液体M的结构式
(3)以C的一种单质为电极材料,写出用A、B的单质和KOH溶液构成的原电池的正、负极电极反应式,负极
(4)写出B、D的单质在加热条件下形成化合物的电子式
您最近一年使用:0次
解题方法
4 . 已知A﹣O分别代表一种物质,它们之间的转化关系如图所示(反应条件略去)。A、B、H分别是由短周期元素组成的单质。B与冷水缓慢反应,与沸水迅速反应,放出氢气。D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱。C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀。
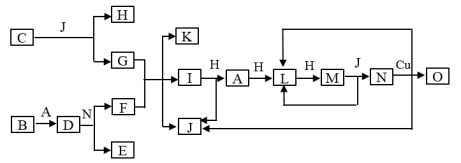
请回答下列问题:
(1)组成B单质的元素位于周期表中___________ ;化合物C的电子式为___________ 。
(2)J的沸点比硒化氢(H2Se)的沸点高,其原因是___________ 。
(3)写出I与H在点燃条件下反应生成A和J的化学方程式:___________ 。
(4)写出D与足量的N反应生成E和F的化学方程式:___________ 。
(5)写出N与铜反应的离子方程式___________ 。
(6)上图中,在同一反应里一种物质作氧化剂,又作还原剂,这样的反应共有___________ 个。

请回答下列问题:
(1)组成B单质的元素位于周期表中
(2)J的沸点比硒化氢(H2Se)的沸点高,其原因是
(3)写出I与H在点燃条件下反应生成A和J的化学方程式:
(4)写出D与足量的N反应生成E和F的化学方程式:
(5)写出N与铜反应的离子方程式
(6)上图中,在同一反应里一种物质作氧化剂,又作还原剂,这样的反应共有
您最近一年使用:0次
解题方法
5 . 随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。根据判断出的元素回答下列问题:
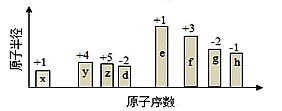
(1)f 在元素周期表的位置是____________________ 。
(2)比较y、g、h最高价氧化物对应水化物的酸性强弱是:____________________ _______>________>_______。(用化学式表示)
(3)由表中两种元素的原子按1:1组成的化合物A和B,A中既含离子键又含非极性共价键,其电子式为____________________ ;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为____________________ 。(填序号)
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

①X溶液与Y溶液反应的离子方程式为____________________
②常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至____________________
(5)上述元素可组成盐R:zx4f(gd4)2,向盛有10 mL 1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀的物质的量随NaOH溶液体积变化如图所示:

①写出m点反应的离子方程式____________________ 。
②若R溶液中改加20mL 1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为____________________ mol。

(1)f 在元素周期表的位置是
(2)比较y、g、h最高价氧化物对应水化物的酸性强弱是:
(3)由表中两种元素的原子按1:1组成的化合物A和B,A中既含离子键又含非极性共价键,其电子式为
| A.MnO2 | B.FeCl3 | C.Na2SO3 | D.KMnO4 |
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

①X溶液与Y溶液反应的离子方程式为
②常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至
(5)上述元素可组成盐R:zx4f(gd4)2,向盛有10 mL 1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀的物质的量随NaOH溶液体积变化如图所示:

①写出m点反应的离子方程式
②若R溶液中改加20mL 1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为
您最近一年使用:0次
解题方法
6 . 有A、B、C、D、E、F六种元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D、F为常见金属元素。A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759 g·L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族。均含D元素的乙(金属阳离子)、丙、丁微粒间的转化全为非氧化还原反应,均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应。请回答下列问题:

(1)单质B的结构式:_____ ____。
(2)F元素周期表中的位置:_____ _____。
(3)均含有F元素的乙与丁在溶液中发生反应的离子方程式 。均含有D元素的乙与丁在溶液中发生反应的离子方程式_______ 。
(4)由A、C元素组成的化合物庚和A、E元素组成的化合物辛,相对分子质量均为34。其中庚的熔沸点比辛_________(填“高”或“低”),原因是___________________。

(1)单质B的结构式:_____ ____。
(2)F元素周期表中的位置:_____ _____。
(3)均含有F元素的乙与丁在溶液中发生反应的离子方程式 。均含有D元素的乙与丁在溶液中发生反应的离子方程式_______ 。
(4)由A、C元素组成的化合物庚和A、E元素组成的化合物辛,相对分子质量均为34。其中庚的熔沸点比辛_________(填“高”或“低”),原因是___________________。
您最近一年使用:0次
2016-12-09更新
|
173次组卷
|
3卷引用:2016届山西省晋中市四校高三上学期期中联考化学试卷
名校
解题方法
7 . a、b、c、d代表四种短周期主族元素。已知:a、b、c同周期,且原子序数之和为22;元素b的最简单氢化物与元素a的氢化物可化合生成离子化合物M;d是短周期中金属性最强的元素.b的最高和最低化合价的代数和为2。
请回答下列问题:
(1)a、b、c的元素符号依次为_______ 、_______ 、_______ 。d在氧气中燃烧产物的电子式为 _____________ 。
(2)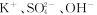 三种常见离子,在化合物M的水溶液中不能大量存在的是
三种常见离子,在化合物M的水溶液中不能大量存在的是________________ (填离子符号)。
(3)元素e为a的同主族短周期元素,e的单质可与水反应,写出反应的离子方程式:______________
(4)c的一种氢化物的相对分子质量为78,是英国科学家法拉第在1825年首先发现的,分子中两种元素的原子个数比为1:1,该氢化物的分子中有____________ 个原子共平面,写出该氢化物与e的单质在氯化铁催化作用下发生取代反应的化学方程式:_____________________ 。
请回答下列问题:
(1)a、b、c的元素符号依次为
(2)
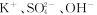 三种常见离子,在化合物M的水溶液中不能大量存在的是
三种常见离子,在化合物M的水溶液中不能大量存在的是(3)元素e为a的同主族短周期元素,e的单质可与水反应,写出反应的离子方程式:
(4)c的一种氢化物的相对分子质量为78,是英国科学家法拉第在1825年首先发现的,分子中两种元素的原子个数比为1:1,该氢化物的分子中有
您最近一年使用:0次
2016-12-09更新
|
302次组卷
|
2卷引用:山西省忻州市第一中学2017-2018学年高二上学期摸底考试化学试题
13-14高一·全国·课时练习
8 . 短周期元素A、B、C、D、E、F六种元素,它们的原子序数由A到F依次增大。在周期表中,A的原子半径最小。B元素的原子最外层电子数是内层电子数的两倍,C为地壳中含量最多的元素,D是原子半径最大的短周期主族元素,D单质燃烧时呈现黄色火焰,D的单质在高温下与C的单质充分反应,可以得到与E单质颜色相同的淡黄色固态化合物。D与F形成的离子化合物DF是常用的调味品。试根据以上叙述回答:
(1)元素名称:
A________ 、B________ 、C________ 、D________ 。
(2)E在元素周期表中的位置:_________________________________________________ 。
(3)F离子结构示意图:_____________________________________________________ 。
(4)A、B组成的最简单化合物的名称是____________________________________________ 。
(5)C、D按原子个数比1∶1组成的一种化合物与水发生反应的化学方程式为___________________________________________________________ 。
(6)能说明E的非金属性比F的非金属性____ (填“强”或“弱”)的事实是________ (举一例)。
(1)元素名称:
A
(2)E在元素周期表中的位置:
(3)F离子结构示意图:
(4)A、B组成的最简单化合物的名称是
(5)C、D按原子个数比1∶1组成的一种化合物与水发生反应的化学方程式为
(6)能说明E的非金属性比F的非金属性
您最近一年使用:0次
2016-12-09更新
|
1172次组卷
|
3卷引用:山西省忻州市第一中学人教版高一化学必修二同步检测:1.2.1元素周期律第1课时原子核外的电子排布元素周期律
山西省忻州市第一中学人教版高一化学必修二同步检测:1.2.1元素周期律第1课时原子核外的电子排布元素周期律(已下线)2014年高一化学人教版必修二 1-2-2元素周期律练习卷吉林省长春外国语学校2020-2021学年高二上学期期初考试化学试题
2014高三·全国·专题练习
名校
9 . 为保持街道整洁、湿润,在路面或广场上喷洒含化学式为XY2的溶液作保湿剂。X原子的结构示意图为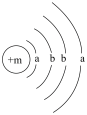 ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
(1)m=____ ,该保湿剂的化学式为____
(2)Z、W元素的名称为____ 、____
(3)下列说法中正确的是____
A.XY2和WZ2都为离子化合物
B.XY2中仅含离子键,WZ2中仅含极性共价键
C.H2Z比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是____
A.XY2的电子式: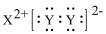
B.WZ2的结构式:Z=W=Z
C.Y元素的单质与H2Z水溶液反应的离子方程式为:Y2+Z2-=2Y-+Z↓
D.用电子式表示XY2的形成过程为: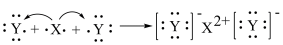
 ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。(1)m=
(2)Z、W元素的名称为
(3)下列说法中正确的是
A.XY2和WZ2都为离子化合物
B.XY2中仅含离子键,WZ2中仅含极性共价键
C.H2Z比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是
A.XY2的电子式:
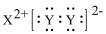
B.WZ2的结构式:Z=W=Z
C.Y元素的单质与H2Z水溶液反应的离子方程式为:Y2+Z2-=2Y-+Z↓
D.用电子式表示XY2的形成过程为:
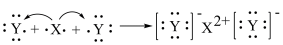
您最近一年使用:0次
2016-12-09更新
|
1023次组卷
|
6卷引用:山西省怀仁县第一中学2016-2017学年高一下学期期中考试化学试题
13-14高三·全国·课时练习
名校
解题方法
10 . 短周期主族元素A、B、C、D、E、F的原子序数依次增大,它们的原子核外电子层数之和为13;B的化合物种类繁多,数目庞大;C、D 是空气中含量最多的两种元素,D、E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素。试回答以下问题:
(1)写出D与E以1:1的原子个数比形成的化合物的电子式:_______ ,F的原子结构示意图为_______ 。
(2)B、D形成的化合物 BD2中存在的化学键为_______ 键(填“离子”或“共价”,下同),A、C、F三种元素形成的化合物CA4F为_______ 化合物。
(3)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性,则甲、乙反应的离子方程式为_______ 。
(4)A、C、D、E的原子半径由大到小的顺序是_______ (用元素符号表示)。
(5)元素B和F的非金属性强弱,B的非金属性_______ 于F(填“强”或“弱”),并用化学方程式证明上述结论_______ 。
(1)写出D与E以1:1的原子个数比形成的化合物的电子式:
(2)B、D形成的化合物 BD2中存在的化学键为
(3)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性,则甲、乙反应的离子方程式为
(4)A、C、D、E的原子半径由大到小的顺序是
(5)元素B和F的非金属性强弱,B的非金属性
您最近一年使用:0次
2016-12-09更新
|
1823次组卷
|
8卷引用:山西省运城市永济涑北中学2019-2020学年高一下学期3月月考化学试题



