1 . 有四种短周期元素,它们的结构、性质等信息如表所述:
(1)X元素在周期表中的位置_____ ;其相对分子质量最小的气态氢化物常用作_____ 。
(2)用电子式表示X最高价氧化物的形成过程_____________________ 。
(3)Y的最高价氧化物对应水化物的电子式________ 。
(4)Z的单质和氧化铁反应可用于野外焊接钢轨,写出反应的化学方程式为______________ 。
(5)举出实例说明M的非金属性比X强:_____________ 。
元素 | 结构、性质等信息 |
X | 构成有机物的核心元素,该元素的一种氧化物和气态氢化物都是典型的温室气体 |
Y | 短周期中(除稀有气体外)原子半径最大的元素,该单质与冷水剧烈反应 |
Z | 与Y同周期,其最高价氧化物的水化物呈两性 |
M | 海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒剂和杀菌剂 |
(2)用电子式表示X最高价氧化物的形成过程
(3)Y的最高价氧化物对应水化物的电子式
(4)Z的单质和氧化铁反应可用于野外焊接钢轨,写出反应的化学方程式为
(5)举出实例说明M的非金属性比X强:
您最近一年使用:0次
名校
2 . 现有A、B、C、D四种短周期主族元素,A分别与B、C、D结合生成甲、乙、丙三种化合物,且甲、乙、丙三分子均为10电子粒子,C、D结合生成化合物丁。有关元素的单质和甲、乙、丙、丁四种化合物的转化关系如图所示。

(1)根据以上条件可以确定A、B、C、D四种元素中的三种元素。不能被确定的第四种元素是____ (填A、B、C、D中的一种)。
(2)依据下列条件可以进一步确定上述第四种元素:①甲与丙以及乙与丙均能够发生反应;②甲、丙都是无色、有刺激性气味的物质。据此,写出C+丙=乙+丁的化学方程式:___________ 。
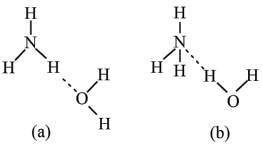
(3)NH3•H2O的电离方程式为NH3•H2O NH4++OH-,试判断NH3溶于水后形成的NH3•H2O的合理结构
NH4++OH-,试判断NH3溶于水后形成的NH3•H2O的合理结构 ________ (填字母代号)。

(1)根据以上条件可以确定A、B、C、D四种元素中的三种元素。不能被确定的第四种元素是
(2)依据下列条件可以进一步确定上述第四种元素:①甲与丙以及乙与丙均能够发生反应;②甲、丙都是无色、有刺激性气味的物质。据此,写出C+丙=乙+丁的化学方程式:
(3)NH3•H2O的电离方程式为NH3•H2O
 NH4++OH-,试判断NH3溶于水后形成的NH3•H2O的合理结构
NH4++OH-,试判断NH3溶于水后形成的NH3•H2O的合理结构 
您最近一年使用:0次
2019-05-10更新
|
417次组卷
|
2卷引用:【全国百强校】山西省晋中市平遥中学2018-2019学年高一下学期期中考试化学试题
3 . 下表列出前20号元素中的某些元素性质的一些数据:
试回答下列问题:
(1)以上10种元素中第一电离能最小的是____ (填编号)。比元素B原子序数大10的元素在元素周期表中的位置:第____ 周期第____ 族,其基态原子的核外电子排布式是___________ 。
(2)由上述C、E、G三种元素中的某两种元素形成的化合物中,每个原子的最外层都满足8电子稳定结构的可能是____ (写分子式,写出两种即可),元素G、I分别和J形成的两种化合物的晶体类型分别是 _________ 、___________ 。
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。 其分子中共形成____ 个σ键,____ 个π键。
(4)短周期某主族元素K的电离能情况如图(A)所示。则K元素位于周期表的第_____ 周期、第____ 族。

图(B)是研究部分元素的氢化物的沸点变化规律的图象,折线c可以表达出第____ 族元素氢化物的沸点的变化规律。不同同学对某主族元素的氢化物的沸点变化趋势画出了两条折线——折线a和折线b,你认为正确的是____ ,理由是_______________ 。
| 元素 | A | B | C | D | E | F | G | H | I | J |
| 原子半径 (10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高价态 | +6 | +1 | — | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低价态 | -2 | — | -2 | — | -4 | -3 | -1 | — | -3 | -4 |
(1)以上10种元素中第一电离能最小的是
(2)由上述C、E、G三种元素中的某两种元素形成的化合物中,每个原子的最外层都满足8电子稳定结构的可能是
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。 其分子中共形成
(4)短周期某主族元素K的电离能情况如图(A)所示。则K元素位于周期表的第

图(B)是研究部分元素的氢化物的沸点变化规律的图象,折线c可以表达出第
您最近一年使用:0次
18-19高一下·山西·阶段练习
名校
4 . 随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小,最高正价或最低负价的变化如下图所示。
根据判断出的元素回答问题:
(1)g元素的元素名称为:___________ ;g和d形成的最简单氢化物沸点较高的是:___________ (填化学式);原因是______________________ 。
(2)x分别和d、e形成的个数比为1:1化合物中,所含化学键类型______________ (填“相同”或“不相同”)。
(3)x和e也可以形成化合物,写出其电子式:___________ ;该物质遇水会剧烈反应,生成一种强碱或一种清洁能源气体,写出该反应化学方程式:___________ 。
(4)上述元素可组成盐R: zx4f(gd4)2,向盛有lOmL1mol·L-1R溶液的烧杯中滴加某浓度NaOH溶液,沉淀物质的过随NaOH溶液体积的变化示意图如图:
①写出m点反应的离子方程式:_________________________________ 。
②NaOH溶液浓度为:______________________ 。
③若在R溶液中改加20mL1.2mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为___________ mol。
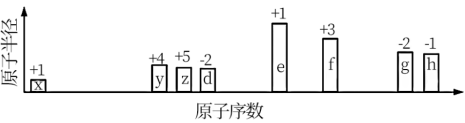
根据判断出的元素回答问题:
(1)g元素的元素名称为:
(2)x分别和d、e形成的个数比为1:1化合物中,所含化学键类型
(3)x和e也可以形成化合物,写出其电子式:
(4)上述元素可组成盐R: zx4f(gd4)2,向盛有lOmL1mol·L-1R溶液的烧杯中滴加某浓度NaOH溶液,沉淀物质的过随NaOH溶液体积的变化示意图如图:
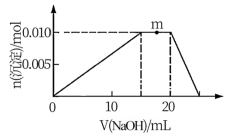
①写出m点反应的离子方程式:
②NaOH溶液浓度为:
③若在R溶液中改加20mL1.2mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为
您最近一年使用:0次
5 . A、B、C、D、E五种短周期主族元素,原子序数依次增大,A原子的最外层上有4个电子;C的阴离子和D的阳离子具有相同的电子层结构,两种元素的单质反应,可生成一种淡黄色的固体F,E的L层电子数等于K、M层电子数之和。
(1)E在元素周期表中的位置__________ ,B常见氢化物的电子式为_______ ;F的电子式为________ 。
(2)B、C、D、E元素的简单离子半径由大到小的顺序为__________________ (用离子符号表示,下同)。A、B、C元素气态氢化物的稳定性由强到弱的顺序为_______________ 。
(3)已知A、E两种元素形成的化合物X,X结构与干冰相似,属于_________ (填“离子”或“共价”)化合物。
(4)用电子式表示D与E化合形成D2E的过程:_____________________ 。
(5)C和E分别能与氢形成18个电子的化合物,这两种化合物发生反应,可生成E单质,其反应的化学方程式为_____________ 。
(1)E在元素周期表中的位置
(2)B、C、D、E元素的简单离子半径由大到小的顺序为
(3)已知A、E两种元素形成的化合物X,X结构与干冰相似,属于
(4)用电子式表示D与E化合形成D2E的过程:
(5)C和E分别能与氢形成18个电子的化合物,这两种化合物发生反应,可生成E单质,其反应的化学方程式为
您最近一年使用:0次
10-11高一下·山西大同·期中
解题方法
6 . 有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C在空气中燃烧时呈现黄色火焰, C的单质在高温下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物, 试根据以上叙述回答:
(1)D元素位于周期表中______ 周期______ 族。
(2)写出C2B的水化物与Al(OH)3反应的离子反应方程式______ 。
(3)画出B的原子结构简图______ 。
(4)电子式表示化合物 C2D 的形成过程:______ 。
(1)D元素位于周期表中
(2)写出C2B的水化物与Al(OH)3反应的离子反应方程式
(3)画出B的原子结构简图
(4)电子式表示化合物 C2D 的形成过程:
您最近一年使用:0次
10-11高三·甘肃·阶段练习
名校
解题方法
7 . A、B、C、D、E、F六种短周期元素,原子序数依次增大,A、E同主族,D、F同主族,A元素的原子半径是所有原子中最小的,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E、F五种元素都能与D元素形成原子个数比不相同的常见化合物。回答下列问题:
(1)F元素在周期表中的位置__________ ,在以上元素最高价氧化物的水化物中,碱性最强的化合物的电子式是:__________ 。
(2)D、F的气态氢化物,沸点较高的是___________ (填分子式)。
(3)A单质与C单质在一定条件下可化合为Z,常温下,向pH=a的Z的水溶液中加入等体积pH=b的X的水溶液,且a+b=14,充分作用后,溶液pH______ 7(填“>”“<”或“=”),原因是_________________________________________________ 。
(1)F元素在周期表中的位置
(2)D、F的气态氢化物,沸点较高的是
(3)A单质与C单质在一定条件下可化合为Z,常温下,向pH=a的Z的水溶液中加入等体积pH=b的X的水溶液,且a+b=14,充分作用后,溶液pH
您最近一年使用:0次
名校
解题方法
8 . 随原子序数的递增,八种短周期元素(用英文小写字母表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
(1)f在元素周期表的位置是_________________ 。
(2)比较d、e简单离子的半径大小(用化学式表示,下同)_____________ ;比较g、h的最高价氧化物对应的水化物的酸性强弱是______________ 。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式________________ 。
(4)已知1mol e的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:____________________________________________ 。
(5)由元素f、h形成的物质X与由元素x、z形成的化合物Y可发生以下反应:

①写出X溶液与Y溶液反应的离子方程式____________________________________ ;
②写出工业上制备f的单质的化学方程式____________________________________ 。

根据判断出的元素回答问题:
(1)f在元素周期表的位置是
(2)比较d、e简单离子的半径大小(用化学式表示,下同)
(3)任选上述元素组成一种四原子共价化合物,写出其电子式
(4)已知1mol e的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:
(5)由元素f、h形成的物质X与由元素x、z形成的化合物Y可发生以下反应:

①写出X溶液与Y溶液反应的离子方程式
②写出工业上制备f的单质的化学方程式
您最近一年使用:0次
名校
解题方法
9 . 下表是元素周期表的前四周期,请回答有关问题:(相关均用具体化学用语回答)
(1)元素⑤⑥⑦的简单离子半径大小顺序__________ ;②在元素周期表位置________ ;③的简单氢化物和⑧的氢化物混合形成的化合物电子式__________ 。
(2)⑤其最高价氧化物水合物和⑥的最高价氧化物反应的离子方程式_______
(3)用电子式表示元素①和⑧形成的化合物的形成过程__________ 。
(4)④、⑧、⑩的氢化物沸点最高的是__________ ,原因是__________ 。
(5)由②和①组成最简单物质与O2和⑨的最高价氧化物对应的水化物的水溶液组成燃料电池,写出电池的负极反应式__________ 。
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 4 | ⑨ | ⑩ | ||||||
(2)⑤其最高价氧化物水合物和⑥的最高价氧化物反应的离子方程式
(3)用电子式表示元素①和⑧形成的化合物的形成过程
(4)④、⑧、⑩的氢化物沸点最高的是
(5)由②和①组成最简单物质与O2和⑨的最高价氧化物对应的水化物的水溶液组成燃料电池,写出电池的负极反应式
您最近一年使用:0次
2018-07-16更新
|
426次组卷
|
4卷引用:山西省运城市临猗县临晋中学2019-2020学年高一下学期开学复课摸底考试化学试题
名校
解题方法
10 . 如表是a~m九种元素在周期表中的位置,请回答下列问题:

(1)m的阴离子结构示意图为____________ 。
(2)b的最高价氧化物的电子式为____________ ;用电子式表示f2 d2的形成过程_______________________ 。
(3)d、g、n形成的简单离子的半径由大到小的顺序为___________ (用离子符号填写)。
(4)f、g、p的最高价氧化物的水化物碱性从强到弱的顺序为__________ (填化学式)。
(5)p和n两种元素最高价氧化物的水化物相互反应的化学反应方程式为___________ 。
(6)c的氢化物和c的最高价氧化物对应水化物之间反应的化学方程式为__________ 。
(7)k的氧化物与氢氧化钠溶液反应的离子方程式为________________________ 。
(8)以上元素组成的物质有下列框图中的转化关系,其中甲为10电子微粒。
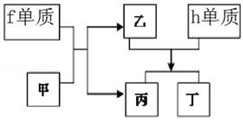
①丁属于_____________ (选填“离子化合物”或“共价化合物”)。
②请写出h单质与乙反应的化学方程式_____________ 。

(1)m的阴离子结构示意图为
(2)b的最高价氧化物的电子式为
(3)d、g、n形成的简单离子的半径由大到小的顺序为
(4)f、g、p的最高价氧化物的水化物碱性从强到弱的顺序为
(5)p和n两种元素最高价氧化物的水化物相互反应的化学反应方程式为
(6)c的氢化物和c的最高价氧化物对应水化物之间反应的化学方程式为
(7)k的氧化物与氢氧化钠溶液反应的离子方程式为
(8)以上元素组成的物质有下列框图中的转化关系,其中甲为10电子微粒。

①丁属于
②请写出h单质与乙反应的化学方程式
您最近一年使用:0次
2018-05-10更新
|
261次组卷
|
2卷引用:山西省太原市六十六中2020届高三上学期第一次月考化学试题



