名校
解题方法
1 . 元素周期表与元素周期律在学习、研究中有很重要的作用。下表所示为某5种元素的相关信息,已知W、X都位于第三周期。
回答下列问题:
(1)W在元素周期表中的位置为_______ ,X的最高价氧化物对应水化物的化学式为_______ 。
(2)用电子式表示X2Q的形成过程:_______ 。
(3)金属性Y_______ (填“>”或“<”)X,从原子结构角度解释原因_______ 。
(4)下列对于Z及其化合物的推断中正确的是_______(填标号)。
(5)将X元素的单质在Q元素的单质中点燃生成M,预测将M投入硫酸亚铁溶液中,主要的反应现象是_______ 。
| 元素 | 信息 |
| Q | 地壳中含量最高的元素 |
| W | 最高化合价为+7价 |
| X | 最高价氧化物对应的水化物在本周期中碱性最强 |
| Y | 焰色试验(透过蓝色钴玻璃)的火焰为紫色 |
| Z | 原子结构示意图为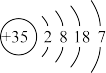 |
(1)W在元素周期表中的位置为
(2)用电子式表示X2Q的形成过程:
(3)金属性Y
(4)下列对于Z及其化合物的推断中正确的是_______(填标号)。
| A.Z的化合价中只有+7价 |
| B.Z的最高价氧化物对应水化物的酸性弱于w的最高价氧化物对应水化物的酸性 |
| C.Z元素单质的氧化性强于W元素单质的氧化性 |
| D.Z与X形成的化合物中只存在离子键 |
您最近一年使用:0次
名校
2 . 原子序数由小到大排列的四种短周期元素 、
、 、
、 、
、 ,其中
,其中 、
、 、
、 与氢元素可组成
与氢元素可组成 、
、 和
和 三种共价化合物;
三种共价化合物; 与氧元素可组成
与氧元素可组成 和
和 两种离子化合物。
两种离子化合物。
(1)写出 的电子式:
的电子式:___________ 。其中含有的化学键是___________ 。
(2)用电子式表示 的形成过程
的形成过程___________ 。
(3) 、
、 、
、 三种元素的最高价氧化物对应的水化物中,稀溶液氧化性最强的是
三种元素的最高价氧化物对应的水化物中,稀溶液氧化性最强的是___________ (填化学式)。
(4) 、
、 和
和 三种化合物,其中一种与另外两种都能反应的是
三种化合物,其中一种与另外两种都能反应的是___________ (填化学式)。
(5)由 、
、 组成的化合物分子中,
组成的化合物分子中, 、
、 原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式
原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式___________ 。
 、
、 、
、 、
、 ,其中
,其中 、
、 、
、 与氢元素可组成
与氢元素可组成 、
、 和
和 三种共价化合物;
三种共价化合物; 与氧元素可组成
与氧元素可组成 和
和 两种离子化合物。
两种离子化合物。(1)写出
 的电子式:
的电子式:(2)用电子式表示
 的形成过程
的形成过程(3)
 、
、 、
、 三种元素的最高价氧化物对应的水化物中,稀溶液氧化性最强的是
三种元素的最高价氧化物对应的水化物中,稀溶液氧化性最强的是(4)
 、
、 和
和 三种化合物,其中一种与另外两种都能反应的是
三种化合物,其中一种与另外两种都能反应的是(5)由
 、
、 组成的化合物分子中,
组成的化合物分子中, 、
、 原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式
原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式
您最近一年使用:0次
2022-04-01更新
|
206次组卷
|
13卷引用:山西省运城市康杰中学2017-2018学年高一下学期期中考试化学试题
山西省运城市康杰中学2017-2018学年高一下学期期中考试化学试题2015-2016学年江西省金溪一中高一下期中化学试卷2015-2016学年中国石油天然气管道局中学高一下第二次月考化学试卷2016-2017学年辽宁省庄河高级中学高二上开学测化学试卷2018版化学(苏教版)高考总复习专题五课时跟踪训练--微粒之间的相互作用力与物质的多样性北京四中2017-2018学年高一下学期第二次月考化学试题新疆自治区和田地区和田县喀什塔什乡中学2019届高三年级四月调研考试理综化学试题百所名校联考-必修二模块综合检测黑龙江省哈尔滨市尚志市尚志中学2021届高三10月月考化学试题(已下线)第8单元 原子结构 元素周期律(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷海南省华中师范大学海南附属中学2021届高三上学期第四次月考化学试题河南省新野县第一高级中学校2021-2022学年高一下学期第三次考试化学试题四川省成都市树德中学2021-2022学年高一下学期5月阶段性测试化学试题
解题方法
3 . X、Y、Z、L、M五种元素的原子序数依次增大,X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量较高的金属元素,回答下列问题:
(1)L的元素符号为___________ ;五种元素的原子半径从大到小的顺序为___________ (用元素符号表示)。
(2)Z、X两元素原子数目比1:3和2:4构成分子A和B,A的电子式为___________ ,B的结构式为___________ 。
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的E原子序数为___________ ,其最高价氧化物对应的水化物的化学式为___________ 。
(4)Z的最简单气态氢化物甲的水溶液显碱性,在微电子工业中,甲的水溶液可作刻蚀剂 的清除剂,且产物不污染环境,该过程发生反应的化学方程式为
的清除剂,且产物不污染环境,该过程发生反应的化学方程式为___________ 。
(1)L的元素符号为
(2)Z、X两元素原子数目比1:3和2:4构成分子A和B,A的电子式为
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的E原子序数为
(4)Z的最简单气态氢化物甲的水溶液显碱性,在微电子工业中,甲的水溶液可作刻蚀剂
 的清除剂,且产物不污染环境,该过程发生反应的化学方程式为
的清除剂,且产物不污染环境,该过程发生反应的化学方程式为
您最近一年使用:0次
4 . 下表为元素周期表的一部分,表中的一个序号代表一种元素。某种融雪剂在机场、高速公路等地被广泛使用,该融雪剂的主要成分是由下表中部分元素(①~①)组成的化合物A(化学式为 )。Y、X、Z、M的原子序数依次递增,Y与M位于同一主族,X的最外层电子数是电子层数的2倍,Z是地壳中含量最多的元素,含元素M的物质在酒精灯外焰上灼烧呈紫色火焰。请结合信息回答下列问题。
)。Y、X、Z、M的原子序数依次递增,Y与M位于同一主族,X的最外层电子数是电子层数的2倍,Z是地壳中含量最多的元素,含元素M的物质在酒精灯外焰上灼烧呈紫色火焰。请结合信息回答下列问题。
(1)A的化学式为___________ ,该化合物中存在的化学键类型有___________ ;元素M在周期表中位置为___________ 。
(2)X、Z和③的原子半径由大到小的顺序为___________ (用元素符号表示)。
(3)⑥的单质在④的单质中燃烧的现象为___________ ,生成物的电子式为___________ 。
(4)⑥⑦①三种元素的氢氧化物,碱性由强到弱的顺序为___________ (填化学式)。
(5)元素⑨的单质和元素⑩的最高价氧化物的水化物反应的离子方程式为___________ 。
(6)我们可以利用如图装置通过实验比较元素②和⑧的非金属性强弱;从下列选项中选出实验所需的物质(已知: 不溶于水):
不溶于水):
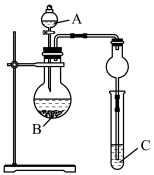
a.稀盐酸 b.稀硫酸
c.碳酸钙 d. 溶液
溶液
试剂A为___________ (填字母,下同);试剂C为___________ 。请指出该装置存在的一个缺陷:___________ 。
 )。Y、X、Z、M的原子序数依次递增,Y与M位于同一主族,X的最外层电子数是电子层数的2倍,Z是地壳中含量最多的元素,含元素M的物质在酒精灯外焰上灼烧呈紫色火焰。请结合信息回答下列问题。
)。Y、X、Z、M的原子序数依次递增,Y与M位于同一主族,X的最外层电子数是电子层数的2倍,Z是地壳中含量最多的元素,含元素M的物质在酒精灯外焰上灼烧呈紫色火焰。请结合信息回答下列问题。| 族 周期 | Ⅰ A | 0 | |||||||
| 1 | ① | Ⅱ A | Ⅲ A | Ⅳ A | Ⅴ A | Ⅵ A | Ⅶ A | ||
| 2 | ② | ③ | ④ | ⑤ | |||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | |||||
| 4 | ⑩ | ||||||||
(2)X、Z和③的原子半径由大到小的顺序为
(3)⑥的单质在④的单质中燃烧的现象为
(4)⑥⑦①三种元素的氢氧化物,碱性由强到弱的顺序为
(5)元素⑨的单质和元素⑩的最高价氧化物的水化物反应的离子方程式为
(6)我们可以利用如图装置通过实验比较元素②和⑧的非金属性强弱;从下列选项中选出实验所需的物质(已知:
 不溶于水):
不溶于水):
a.稀盐酸 b.稀硫酸
c.碳酸钙 d.
 溶液
溶液试剂A为
您最近一年使用:0次
名校
解题方法
5 . X、Y、Z、W四种短周期主族元素,原子序数依次递增,X原子中有3个能量相等且自旋方向相同的电子,Y是地壳中含量最多的元素,Y与W同主族,Z在短周期主族元素中金属性最强。回答下列问题:
(1)X、Y、Z、W四种元素的原子半径从大到小的顺序为___ (填元素符号)。
(2)元素Y的原子轨道表示式为___ 。
(3)元素X与元素Y的简单气态氢化物中,稳定性较强的是___ (填电子式)。
(4)Z原子的结构示意图为___ ;化合物Z2Y2的电子式为____ 。
(5)W元素在元素周期表中的位置为___ ,其价电子排布式为____ 。
(1)X、Y、Z、W四种元素的原子半径从大到小的顺序为
(2)元素Y的原子轨道表示式为
(3)元素X与元素Y的简单气态氢化物中,稳定性较强的是
(4)Z原子的结构示意图为
(5)W元素在元素周期表中的位置为
您最近一年使用:0次
6 . 元素周期律和周期表是我们研究、预测物质性质的重要工具。下表是元素周期表中前四周期的5种元素的相关信息。
回答下列问题:
(1)D在元素周期表中的位置是___________ 。
(2)BH4的分子结构模型为___________ ,其气态氢化物的稳定性BH4___________ HD(填写“大于”“小于”或“等于”)。
(3)少量E的单质加入水中剧烈反应,反应的化学方程式是___________ ;将一块C单质加入上述形成的强碱溶液中反应的离子方程式是___________ ;元素A、E的最高价氧化物对应的水化物中,碱性更强的物质是___________ (填写化学式)。
(4)下列曲线分别表示元素的某种性质(用Y表示)与核电荷数(用Z表示)的关系。请将正确曲线的图象标号填入相应的空格中:
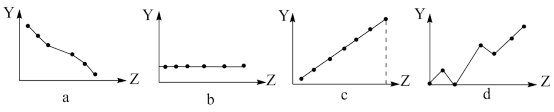
第IIA族元素的最外层电子数____ ,第三周期主族元素的最高正化合价___ 。
| 元素 | 元素性质或原子结构 |
| A | 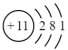 |
| B | B能形成多种单质,其中一种单质是硬度最大的物质 |
| C | 地壳中含量最高的金属元素,其合金可用于制造飞机外壳 |
| D | D的单质是一种黄绿色气体 |
| E | 用E的碳酸盐做焰色试验时火焰为紫色(透过蓝色钴玻璃片) |
(1)D在元素周期表中的位置是
(2)BH4的分子结构模型为
(3)少量E的单质加入水中剧烈反应,反应的化学方程式是
(4)下列曲线分别表示元素的某种性质(用Y表示)与核电荷数(用Z表示)的关系。请将正确曲线的图象标号填入相应的空格中:

第IIA族元素的最外层电子数
您最近一年使用:0次
7 . 现有U、V、Z、Y、X、W共6种短周期主族元素,其原子半径依次增大,部分信息如下表:
回答下列问题:
(1)上述元素中,属于s区的元素有___________ (填元素符号),其余的元素属于___________ 区。
(2)X元素的基态原子核外最高能级的电子自旋状态有___________ 种,与X的化学性质相近但位于不同主族的短周期元素是___________ (填元素符号),V元素的原子核外共有___________ 种不同运动状态的电子。
(3)某同学写了基态Y原子价电子的两种表示方式,分析其分别违背了什么原理:
① :
:___________ ;
② :
:___________ 。
(4)V、W、Z的简单离子半径由大到小的顺序为___________ (填离子符号)。
(5)检验W元素的方法是___________ ,请用原子结构的知识解释产生此现象的原因:___________ 。
| U | 基态原子的p能级上无电子,元素最高正价与最低负价的绝对值相同 |
| V | 基态原子核外2p轨道上有1个电子的自旋方向与2p轨道上其他电子的自旋方向相反 |
| W | 最内层电子数是最外层电子数的2倍,单质与 反应可生成两种物质 反应可生成两种物质 |
| X | 基态原子的价层电子排布式为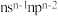 |
| Y | 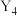 为正四面体结构,易自燃 为正四面体结构,易自燃 |
| Z | Z的单质为黄色晶体,它的一种氧化物能使品红溶液褪色 |
(1)上述元素中,属于s区的元素有
(2)X元素的基态原子核外最高能级的电子自旋状态有
(3)某同学写了基态Y原子价电子的两种表示方式,分析其分别违背了什么原理:
①
 :
:②
 :
:(4)V、W、Z的简单离子半径由大到小的顺序为
(5)检验W元素的方法是
您最近一年使用:0次
8 . X、Y、Z、W、R五种元素的性质或结构信息如表,根据表中的信息回答下列问题:
(1)写出元素R在元素周期表中的位置:_______ 。
(2)由X、Z、R三种元素形成的化合物XRZ的结构式为_______ ;化合物WR的电子式为_______ 。
(3)Y、Z的最简单氢化物中较稳定的是_______ (填化学式),判断依据是_______ 。由Y和Z组成且Y和Z的质量之比为7:4的化合物的分子式是_______ 。
(4)写出少量X的单质在盛满R的单质的集气瓶中燃烧的现象:_______ ,燃烧片刻后取出燃烧管,迅速将集气瓶倒扣在过量的烧碱溶液中,可能产生的现象是_______ ,所得溶液中存在的溶质除了过量的NaOH外,还含有的是_______ (填化学式)。
| 元素 | X | Y | Z | W | R |
| 性质或结构信息 | 是原子半径最小的元素 | 常见单质为空气中的主要成分之一 | 是海水中质量分数最大的元素 | 原子核内有11个质子 | 原子核外有3个电子层,常见单质为气体 |
(2)由X、Z、R三种元素形成的化合物XRZ的结构式为
(3)Y、Z的最简单氢化物中较稳定的是
(4)写出少量X的单质在盛满R的单质的集气瓶中燃烧的现象:
您最近一年使用:0次
2022-01-19更新
|
259次组卷
|
7卷引用:山西省吕梁市2021-2022学年高一上学期期末考试化学试题
名校
解题方法
9 . X、Y、Z、W、Q是原子序数依次增大的5种短周期主族元素。Y在同周期中原子半径最大,W与X同主族,能形成WX3化合物。已知Z是金属,其氧化物和氢氧化物均显两性。
(1)元素Z在元素周期表中的位置为__ ,Y、Z、W、Q的离子半径从大到小顺序为__ (用离子符号表示)。
(2)Y2X2的电子式为__ ,其化学键类型为__ 。
(3)硒(Se)是人体必需的微量元素,与W同主族,比W多一个电子层。则Se的原子序数为__ ;其最高价氧化物对应的水化物的化学式为__ ,其酸性比硫酸___ (填“强”或“弱”)。
(4)写出Z的氧化物与Y的最高价氧化物对应水化物的溶液反应的离子方程式__ 。
(5)QX2是现在常用的自来水消毒剂,工业上可用稀硫酸和WX2处理NaClO3制得,写出该反应的离子方程式__ 。
(1)元素Z在元素周期表中的位置为
(2)Y2X2的电子式为
(3)硒(Se)是人体必需的微量元素,与W同主族,比W多一个电子层。则Se的原子序数为
(4)写出Z的氧化物与Y的最高价氧化物对应水化物的溶液反应的离子方程式
(5)QX2是现在常用的自来水消毒剂,工业上可用稀硫酸和WX2处理NaClO3制得,写出该反应的离子方程式
您最近一年使用:0次
2022-01-05更新
|
80次组卷
|
2卷引用:山西省运城市新绛中学校2022届高三10月月考化学试题
10 . A、B、C、D、E、F为原子序数依次增大的短周期主族元素。B、F原子的最外层电子数均为其电子层数的两倍,D、F元素原子的最外层电子数相等。X、Y、Z、W、甲、乙六种物质由上述元素的两种或三种元素组成,元素B形成的单质M均能与甲、乙的浓溶液反应(相对分子质量甲<乙),转化关系如图(反应条件略去),元素E形成的单质是“21世纪的能源”,是目前应用最多的半导体材料。请回答下列问题:
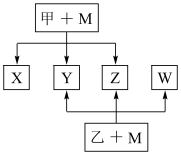
(1)下列事实不能证明元素F的非金属性弱于元素D的是___________ (填标号)。
a.D和F的最简单氢化物的稳定性:F<D
b.常温下F的单质呈固态,D的单质呈气态;
c.D与F形成的化合物中,F显正价
d.D和F的单质氧化性:F<D
(2)写出M与甲的浓溶液加热时反应的化学方程式___________ ;
(3)X、Y、Z、W属于同一类物质,X、Y、W都能与Z反应,4种化合物中沸点最高的是_____ (填化学式);
(4)化合物ED2与M在高温下能发生置换反应,若反应中有1mol电子发生转移,则参加反应的化合物ED2的质量为___________ g;
(5)元素C能分别与元素A和D均按原子个数比1:2形成化合物丙和丁,丙的结构式为______ ;常温下,液体丙与气体丁反应生成两种无污染的物质,该反应的氧化产物与还原产物的物质的量之比为_________ 。

(1)下列事实不能证明元素F的非金属性弱于元素D的是
a.D和F的最简单氢化物的稳定性:F<D
b.常温下F的单质呈固态,D的单质呈气态;
c.D与F形成的化合物中,F显正价
d.D和F的单质氧化性:F<D
(2)写出M与甲的浓溶液加热时反应的化学方程式
(3)X、Y、Z、W属于同一类物质,X、Y、W都能与Z反应,4种化合物中沸点最高的是
(4)化合物ED2与M在高温下能发生置换反应,若反应中有1mol电子发生转移,则参加反应的化合物ED2的质量为
(5)元素C能分别与元素A和D均按原子个数比1:2形成化合物丙和丁,丙的结构式为
您最近一年使用:0次



