名校
1 . 随着原子序数的递增,8种短周期元素(用英文字母表示)原子半径的相对大小、最高正化合价或最低负化合价的变化如图所示。

(1)元素y在元素周期表中的位置是___________ 。
(2)元素x、z可形成含10电子的分子,其分子式为___________ 。元素d、e形成的简单离子,半径较大的离子是___________ (填离子符号)。
(3)元素g、h的最高价氧化物的水化物的酸性较强的是___________ (填化学式)。
(4)元素e、f的最高价氧化物的水化物之间发生反应的离子方程式为___________ 。
(5)化合物e3z遇水反应生成氨气(NH3)和一种强碱,反应的化学方程式为___________ 。

(1)元素y在元素周期表中的位置是
(2)元素x、z可形成含10电子的分子,其分子式为
(3)元素g、h的最高价氧化物的水化物的酸性较强的是
(4)元素e、f的最高价氧化物的水化物之间发生反应的离子方程式为
(5)化合物e3z遇水反应生成氨气(NH3)和一种强碱,反应的化学方程式为
您最近一年使用:0次
2023-09-24更新
|
131次组卷
|
2卷引用:江苏省南京航空航天大学苏州附属中学2022-2023学年高一上学期12月月考化学试题
名校
解题方法
2 . X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的气态氢化物具有相同的电子数,X元素可以组成M和N两种气态单质,常用反应:M+2I-+2H+=I2+N+H2O做M的鉴定反应,也可用带火星的木条检验M。
(1)写出实验室制取W2的离子方程式_______ 。
(2)某化学兴趣小组设计如图所示的实验装置(图中夹持和加热装置略去),分别探究YX2和W2的性质。
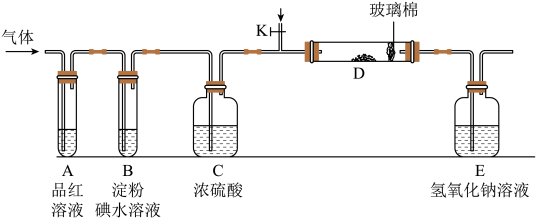
①若装置D中装的是铁粉,当通入W2时,灼热D时观察到_______ 现象。若装置D中装的是五氧化二钒(V2O5),当通入YX2时,打开K放入适量的氧气,灼热D装置,发生反应的化学方程式为_______ 。
②若装置B中装有5.0mL1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,该反应的化学方程为_______ 。
③某同学将足量的YX2通入一支装有BaCl2溶液的试管,未见沉淀生成,向该试管中加入适量_______ (填字母),可以看到白色沉淀产生。
A.氨水 B.稀盐酸 C.稀硝酸 D.CaCl2溶液
④物质Y2W2是有恶臭,毒性的液体,各原子满足8电子稳定结构,写出Y2W2的结构式_______ 。
(1)写出实验室制取W2的离子方程式
(2)某化学兴趣小组设计如图所示的实验装置(图中夹持和加热装置略去),分别探究YX2和W2的性质。

①若装置D中装的是铁粉,当通入W2时,灼热D时观察到
②若装置B中装有5.0mL1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,该反应的化学方程为
③某同学将足量的YX2通入一支装有BaCl2溶液的试管,未见沉淀生成,向该试管中加入适量
A.氨水 B.稀盐酸 C.稀硝酸 D.CaCl2溶液
④物质Y2W2是有恶臭,毒性的液体,各原子满足8电子稳定结构,写出Y2W2的结构式
您最近一年使用:0次
解题方法
3 . X、Y、Z、M为原子序数依次增大的短周期主族元素,这四种元素原子的最外层电子数之和等于12。A~G是由上述四种元素组成的化合物,其转化关系如图所示,其中C是一种强碱,焰色试验呈黄色。

回答下列问题:
(1)元素Y在元素周期表中的位置是___________ 。
(2)Y、Z、M三种元素的原子半径由大到小的顺序为___________ (用元素符号表示)。
(3)能说明Z的非金属性强于Y的依据是___________ (写一点即可)。
(4)写出反应①的离子方程式___________ 。
(5)去除A溶液中混有的少量B的方法是___________ 。
(6)3.9g固体D与足量F反应转移的电子数目为___________ 。
(7)下列实验方案中,能测定出物质A和B的混合物中B的质量分数的是___________ (填标号)。
a.取mg混合物充分加热,质量减少ng
b.取mg混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到ng固体
c.取mg混合物与足量NaOH溶液充分反应,得到ng溶液
d.取mg混合物与足量稀硫酸充分反应,逸出气体经干燥后用碱石灰吸收,质量增加ng

回答下列问题:
(1)元素Y在元素周期表中的位置是
(2)Y、Z、M三种元素的原子半径由大到小的顺序为
(3)能说明Z的非金属性强于Y的依据是
(4)写出反应①的离子方程式
(5)去除A溶液中混有的少量B的方法是
(6)3.9g固体D与足量F反应转移的电子数目为
(7)下列实验方案中,能测定出物质A和B的混合物中B的质量分数的是
a.取mg混合物充分加热,质量减少ng
b.取mg混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到ng固体
c.取mg混合物与足量NaOH溶液充分反应,得到ng溶液
d.取mg混合物与足量稀硫酸充分反应,逸出气体经干燥后用碱石灰吸收,质量增加ng
您最近一年使用:0次
名校
解题方法
4 . 短周期元素A、B、C、D、E原子序数依次增大。A是周期表中原子半径最小的元素,B原子的价电子数等于该元素最低化合价的绝对值,C与D能形成D2C和D2C2两种化合物,而D是同周期中金属性最强的元素,E的负一价离子与C和A形成的某种化合物分子含有相同的电子数。
(1)A、C、D形成的化合物的电子式为___________ 。
(2)已知:① ;△
;△
② ;
;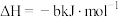
③ ;
; (“•”表示形成共价键所提供的电子)
(“•”表示形成共价键所提供的电子)
写出298 K时,A2与E2反应的热化学方程式___________ 。
(3)在某温度下、容积均为2 L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应: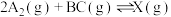 ;
;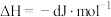 (
(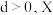 为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
①在该温度下,假设甲容器从反应开始到平衡所需时间为4 min,则该时间段内A2的平均反应速率为___________ 。
②该温度下此反应的平衡常数K的值为___________ 。
③三个容器中的反应分别达平衡时各组数据关系正确的是___________ (填序号)。
A.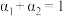 B.
B. C.
C.
D.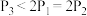 E.
E. F.
F.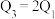
(4)近年来,我国科研人员研制出一种一种室温下“可呼吸”的Na-CO2电池装置如图所示,电池的总反应为: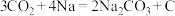 。
。
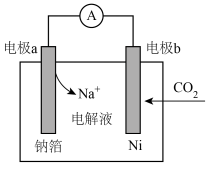
①电极a为___________ 极(填“正”或“负”)。
②电极b发生的电极反应为___________ 。
(1)A、C、D形成的化合物的电子式为
(2)已知:①
 ;△
;△
②
 ;
;
③
 ;
; (“•”表示形成共价键所提供的电子)
(“•”表示形成共价键所提供的电子)写出298 K时,A2与E2反应的热化学方程式
(3)在某温度下、容积均为2 L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:
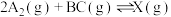 ;
;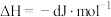 (
(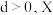 为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2 mol A2、1 mol BC | 1 mol X | 4 mol A2、2 mol BC |
| 平衡时n(X) | 0.5 mol | n2 | n3 |
| 反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | 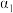 | 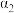 |  |
②该温度下此反应的平衡常数K的值为
③三个容器中的反应分别达平衡时各组数据关系正确的是
A.
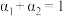 B.
B. C.
C.
D.
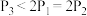 E.
E. F.
F.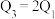
(4)近年来,我国科研人员研制出一种一种室温下“可呼吸”的Na-CO2电池装置如图所示,电池的总反应为:
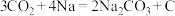 。
。
①电极a为
②电极b发生的电极反应为
您最近一年使用:0次
2023-08-11更新
|
135次组卷
|
2卷引用:湖北省十堰市等5地十堰市郧阳中学等2校2022-2023学年高二上学期10月月考化学试题
名校
解题方法
5 . 有四种短周期元素,它们的结构、性质等信息如下表所述,请根据表中信息填写:
(1)A原子的核外电子排布式___________ 。
(2)离子半径:B___________ A(填“大于”或“小于”)。
(3)C原子的外围电子轨道式___________ ,其原子核外有 ___________ 个未成对电子,能量最高的电子为___________ 轨道上的电子,其轨道呈___________ 形。
(4)D原子占据最高能层符号为___________ ,能量不同的电子数为___________ ,空间运动状态不同电子数为___________ ,运动状态不同电子数为___________ 。
| 元素 | 结构、性质等信息 |
| A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
| B | B与A同周期,其最高价氧化物的水化物呈两性 |
| C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
| D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
(2)离子半径:B
(3)C原子的外围电子轨道式
(4)D原子占据最高能层符号为
您最近一年使用:0次
解题方法
6 . a、b、c、d、e为前四周期元素(除稀有气体),原子序数依次增大。a的基态原子价电子层有3个未成对电子;b元素常见的盐可用于纺织、制皂、制玻璃和焙制糕点;c元素的氧化物为共价晶体,具有硬度高、熔点高、难溶于水、化学性质稳定等特点;d元素原子在同周期元素中原子半径最小;e元素在地壳中的含量排在第四位;回答下列问题:
(1)写出e元素在周期表中位置___________ 。a、c、d最高价氧化物水化物的酸性有弱到强的顺序为___________ (用化学式表示)
(2)将一定量 通入b的最高价氧化物对应水化物的溶液中,经一系列操作得到两种固态盐的混合物。现取mg固体混合物充分加热,质量减少ng。则mg固体混合物中热稳定性较低的物质的质量分数为
通入b的最高价氧化物对应水化物的溶液中,经一系列操作得到两种固态盐的混合物。现取mg固体混合物充分加热,质量减少ng。则mg固体混合物中热稳定性较低的物质的质量分数为___________ 。
(3)c元素与d形成化合物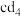 ,
,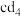 在潮湿空气中可产生白色烟雾,反应剧烈,且不可逆,反应的化学方程式为
在潮湿空气中可产生白色烟雾,反应剧烈,且不可逆,反应的化学方程式为___________ 。
(1)写出e元素在周期表中位置
(2)将一定量
 通入b的最高价氧化物对应水化物的溶液中,经一系列操作得到两种固态盐的混合物。现取mg固体混合物充分加热,质量减少ng。则mg固体混合物中热稳定性较低的物质的质量分数为
通入b的最高价氧化物对应水化物的溶液中,经一系列操作得到两种固态盐的混合物。现取mg固体混合物充分加热,质量减少ng。则mg固体混合物中热稳定性较低的物质的质量分数为(3)c元素与d形成化合物
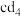 ,
,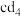 在潮湿空气中可产生白色烟雾,反应剧烈,且不可逆,反应的化学方程式为
在潮湿空气中可产生白色烟雾,反应剧烈,且不可逆,反应的化学方程式为
您最近一年使用:0次
2023-07-15更新
|
55次组卷
|
2卷引用:山东省泰安市宁阳县2022-2023学年高三上学期11月期中考试化学试题
名校
7 . 锂离子电池让电动汽车飞速发展,有利于实现节能减排。LiCoO2、LiFePO4、Li4Ti5O12常用作电池的电极材料,LiPF6、LiAsF6常用作锂离子聚合物电池的载体材料。
(1)在周期表中,与Li的化学性质最相似的邻族元素是_______ ,LiCoO2中基态Co原子核外电子的空间运动状态有_______ 种。
(2)含氧酸的通式可写为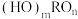 ,,根据含氧酸的结构规律,下列酸中酸性与H3PO4相近的有_______(填字母)。
,,根据含氧酸的结构规律,下列酸中酸性与H3PO4相近的有_______(填字母)。
(3)电池工作时,Li+计可在电解质LiPF6或LiAsF6中发生迁移,相同条件下,Li+在_______ (填“LiPF6”或“LiAsF6”)中迁移较快,原因是_______ 。
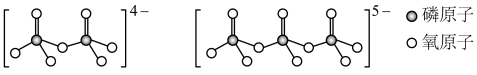
(4)LiFePO4中P的_______ 杂化轨道与O的2p轨道形成 键。LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示,这类磷酸根离子的化学式可用通式表示为
键。LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示,这类磷酸根离子的化学式可用通式表示为_______ (用n代表P原子数)。
(5)Li4Ti5O12中Ti元素的化合物TiO2是一种重要的瓷器釉料。研究表明,在TiO2中通过氮掺杂反应可生成TiO2-aNb,能使TiO2对可见光具有活性,掺杂过程如图所示。
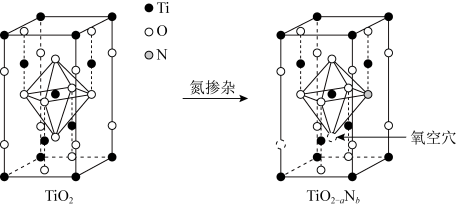
则TiO2-aNb晶体中a=_______ ,b=_______ 。
(1)在周期表中,与Li的化学性质最相似的邻族元素是
(2)含氧酸的通式可写为
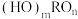 ,,根据含氧酸的结构规律,下列酸中酸性与H3PO4相近的有_______(填字母)。
,,根据含氧酸的结构规律,下列酸中酸性与H3PO4相近的有_______(填字母)。| A.HClO | B.H2SO4 | C.HNO2 | D.HNO3 |
(4)LiFePO4中P的
 键。LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示,这类磷酸根离子的化学式可用通式表示为
键。LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如下图所示,这类磷酸根离子的化学式可用通式表示为
(5)Li4Ti5O12中Ti元素的化合物TiO2是一种重要的瓷器釉料。研究表明,在TiO2中通过氮掺杂反应可生成TiO2-aNb,能使TiO2对可见光具有活性,掺杂过程如图所示。

则TiO2-aNb晶体中a=
您最近一年使用:0次
8 . D、E、W、R、X、Y均为元素周期表前20号主族元素。根据所学知识,回答下列问题:
(1)化合物 是一种常见的干燥剂,其阳离子和阴离子的电子层结构相同,且
是一种常见的干燥剂,其阳离子和阴离子的电子层结构相同,且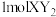 含有
含有 电子。则
电子。则 的化学式是
的化学式是_______ 。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是_______ ;D与E能形成一种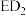 的三原子分子,且每个原子均达到了
的三原子分子,且每个原子均达到了 稳定结构,该分子的结构式为
稳定结构,该分子的结构式为_______ ,化学键类型为_______ (填“离子键”或“共价键”)。
(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中反应时有两种产物:加热时生成_______ ,其化学键类型为_______ ,电子式为_______ 。元素R是地壳中含量最多的金属元素,写出R的单质与Z的最高价氧化物对应水化物反应的离子方程式:_______ 。
(1)化合物
 是一种常见的干燥剂,其阳离子和阴离子的电子层结构相同,且
是一种常见的干燥剂,其阳离子和阴离子的电子层结构相同,且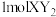 含有
含有 电子。则
电子。则 的化学式是
的化学式是(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是
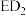 的三原子分子,且每个原子均达到了
的三原子分子,且每个原子均达到了 稳定结构,该分子的结构式为
稳定结构,该分子的结构式为(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中反应时有两种产物:加热时生成
您最近一年使用:0次
9 . R、W、X、Y、Z是原子序数依次增大的前四周期元素,其中R与W位于同一周期,且R元素的第一电离能大于氧,W的单质在暗处与 能剧烈化合,常温下X的单质为淡黄色固体,含Y元素的物质灼烧时焰色为紫色,基态Z原子有5个未成对电子。请回答下列问题:
能剧烈化合,常温下X的单质为淡黄色固体,含Y元素的物质灼烧时焰色为紫色,基态Z原子有5个未成对电子。请回答下列问题:
(1)基态Z原子的价层电子排布式为__________ ,该元素位于元素周期表中的__________ 区。
(2)基态R原子中有__________ 个未成对电子,其中能量最高的电子所在原子轨道的电子云轮廓图为__________ 形。
(3)R、W、X三种元素中第一电离能由大到小的顺序为____ (用元素符号表示),原因是________ 。
(4)R、W、X、Y、Z中非金属元素形成的最简单气态氢化物的稳定性由强到弱的顺序是__________ (填化学式)。
(5)X、Y两种元素组成的化合物 的电子式为
的电子式为__________ ,其中含有的化学键类型为__________ 。
 能剧烈化合,常温下X的单质为淡黄色固体,含Y元素的物质灼烧时焰色为紫色,基态Z原子有5个未成对电子。请回答下列问题:
能剧烈化合,常温下X的单质为淡黄色固体,含Y元素的物质灼烧时焰色为紫色,基态Z原子有5个未成对电子。请回答下列问题:(1)基态Z原子的价层电子排布式为
(2)基态R原子中有
(3)R、W、X三种元素中第一电离能由大到小的顺序为
(4)R、W、X、Y、Z中非金属元素形成的最简单气态氢化物的稳定性由强到弱的顺序是
(5)X、Y两种元素组成的化合物
 的电子式为
的电子式为
您最近一年使用:0次
2023-02-15更新
|
169次组卷
|
2卷引用:河北省邢台市2022-2023学年高二上学期教学质量检测(期末)化学试题
解题方法
10 . 短周期主族元素X、Y、Z、M、Q原子序数依次增大,X、Q的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,Z在同周期主族元素中原子半径最大,M是地壳中含量最多的金属元素。
(1)Y在周期表中的位置是_______ ;Q的元素名称是_______ 。
(2)Z、M、Q的简单离子半径由小到大的顺序为_______ (用离子符号表示)。
(3)将含有M的简单离子的盐溶液与足量Z的最高价氢氧化物的溶液混合,反应的离子方程式为_______ ;
(4)可以比较Z、M两元素金属性强弱的实验是____________。
(5)R是第四周期与Q同主族的元素,下列说法正确的是____________。
(1)Y在周期表中的位置是
(2)Z、M、Q的简单离子半径由小到大的顺序为
(3)将含有M的简单离子的盐溶液与足量Z的最高价氢氧化物的溶液混合,反应的离子方程式为
(4)可以比较Z、M两元素金属性强弱的实验是____________。
| A.比较这两种元素最高价氧化物的水化物的碱性 |
| B.将Z的单质投入到M的硫酸盐溶液中 |
| C.将这两种元素单质分别放入冷水中 |
| D.比较这两种元素的单质与酸反应时失电子的数目 |
| A.R的最高化合价为+7 |
| B.简单气态氢化物稳定性:R>Q |
| C.简单离子的还原性:R<Q |
| D.R的单质在常温下可与氢气化合 |
您最近一年使用:0次
2023-02-14更新
|
406次组卷
|
3卷引用:山东省聊城市2022-2023学年高一上学期期末考试化学试题
山东省聊城市2022-2023学年高一上学期期末考试化学试题山东省聊城市2022-2023学年高一上学期期末教学质量抽测化学试题(已下线)专题08 元素周期表与元素周期律-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册)



