名校
解题方法
1 . 按下列要求填空。
Ⅰ.有下列物质:①Cl2②Na2O2③NaOH④HCl⑤H2O2⑥MgF2⑦NH4Cl
(1)只含共价键的物质是_______ (填序号,下同)。
(2)由离子键和非极性键构成的物质是_______ 。
(3)写出⑤的电子式_______ 。
Ⅱ.下列变化中:①蔗糖溶于水②硫酸氢钾熔化③氨气液化④NaCl溶于水⑤Na2O2溶于水⑥HBr溶于水
(4)只有离子键被破坏的是_______ ,只有共价键被破坏的是_______ 。
(5)既有离子键被破坏,又有共价键被破坏的是_______ 。
Ⅲ.有下列微粒或物质:
①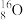 、
、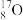 、
、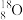 ②石墨、金刚石③35Cl2、37Cl2④
②石墨、金刚石③35Cl2、37Cl2④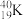 、
、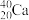 、
、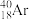
(6)互为同位素的是_______ 。
(7)互为同素异形体的是_______ 。
Ⅰ.有下列物质:①Cl2②Na2O2③NaOH④HCl⑤H2O2⑥MgF2⑦NH4Cl
(1)只含共价键的物质是
(2)由离子键和非极性键构成的物质是
(3)写出⑤的电子式
Ⅱ.下列变化中:①蔗糖溶于水②硫酸氢钾熔化③氨气液化④NaCl溶于水⑤Na2O2溶于水⑥HBr溶于水
(4)只有离子键被破坏的是
(5)既有离子键被破坏,又有共价键被破坏的是
Ⅲ.有下列微粒或物质:
①
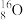 、
、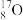 、
、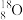 ②石墨、金刚石③35Cl2、37Cl2④
②石墨、金刚石③35Cl2、37Cl2④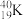 、
、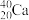 、
、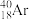
(6)互为同位素的是
(7)互为同素异形体的是
您最近一年使用:0次
2023-01-19更新
|
700次组卷
|
3卷引用:重庆市第八中学校2021-2022学年高一下学期期中考试化学试题
名校
解题方法
2 . 填写下列空白:
(1)写出表示含有8个质子、10个中子的原子的化学符号:________ 。
(2)周期表中位于第8纵行的铁元素属于第________ 族。
(3)下列几种物质:①Ca(OH)2②H2O2③He④H2S ⑤MgCl2 ,只含有离子键的是(选填序号,下同)_________ ;只含有极性共价键的化合物是________ ;
(4)HClO的结构式______ ,I2的电子式______ 。
(5)下列变化中:①干冰气化;②硝酸钾熔化;③KHSO4熔融;④蔗糖溶液水⑤硫酸溶于水;未破坏化学键的是_____ ;
(6)下列不能说明氯元素原子得电子能力比硫元素原子得电子能力强的是_____________
①HCl的溶解度比H2S的大 ②HCl的酸性比H2S的强 ③HCl的稳定性比H2S的强④Cl2与铁反应生成FeCl3,而S与铁反应生成FeS ⑤HClO4的酸性比H2SO4的强 ⑥Cl2能与H2S反应生成S
(1)写出表示含有8个质子、10个中子的原子的化学符号:
(2)周期表中位于第8纵行的铁元素属于第
(3)下列几种物质:①Ca(OH)2②H2O2③He④H2S ⑤MgCl2 ,只含有离子键的是(选填序号,下同)
(4)HClO的结构式
(5)下列变化中:①干冰气化;②硝酸钾熔化;③KHSO4熔融;④蔗糖溶液水⑤硫酸溶于水;未破坏化学键的是
(6)下列不能说明氯元素原子得电子能力比硫元素原子得电子能力强的是
①HCl的溶解度比H2S的大 ②HCl的酸性比H2S的强 ③HCl的稳定性比H2S的强④Cl2与铁反应生成FeCl3,而S与铁反应生成FeS ⑤HClO4的酸性比H2SO4的强 ⑥Cl2能与H2S反应生成S
您最近一年使用:0次
2020-07-16更新
|
669次组卷
|
3卷引用:重庆市杨家坪中学2020-2021学年高一上学期1月月考化学试题
名校
解题方法
3 . 按要求填空:
(1)写出下列物质的电子式:Na2O2_____ NH3_____ 。
(2)2.2g铵根14N2H4+的中子数是___ ,核外电子数是____ ,某微粒含有一个原子核,核中有 17个质子,20个中子,核外有 18个电子,该粒子的化学符号是____ 。
(3)已知断开 1mol H—H 键、1mol I—I 键、1mol H—I 键分别需要吸收的能量为 436kJ、151kJ、299kJ,则由 1mol H2和 1mol I2生成 2mol HI会_____ (“放出”或“吸收”)_____ kJ 的热量。
(4)现有下列物质:①H2 ②Na2O2 ③NaOH ④H2O2 ⑤CaCl2 ⑥NH4NO3 ⑦H2S,只由离子键构成的物质是_____ (填序号,同下),由离子键和共价键构成的物质是_________ ,属于共价化合物的是_____ 。
(1)写出下列物质的电子式:Na2O2
(2)2.2g铵根14N2H4+的中子数是
(3)已知断开 1mol H—H 键、1mol I—I 键、1mol H—I 键分别需要吸收的能量为 436kJ、151kJ、299kJ,则由 1mol H2和 1mol I2生成 2mol HI会
(4)现有下列物质:①H2 ②Na2O2 ③NaOH ④H2O2 ⑤CaCl2 ⑥NH4NO3 ⑦H2S,只由离子键构成的物质是
您最近一年使用:0次
2020-05-28更新
|
111次组卷
|
3卷引用:重庆市黔江新华中学校2019-2020高一下学期期中考试化学试题
重庆市黔江新华中学校2019-2020高一下学期期中考试化学试题(已下线)第二节 元素周期率(二)-2020-2021学年高一化学必修第一册课时同步练(新人教)西藏自治区拉萨市那曲第二高级中学2019-2020学年高一下学期期末考试化学试题
真题
名校
4 . 某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,受热分解产生N2和Na,N2的电子式为______ 。
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为______ (已知该反应为置换反应).
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O。KClO4含有化学键的类型为______ ,K的原子结构示意图为_____ 。
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为__________ 。
(5)100g上述产气药剂产生的气体通过碱石灰后得到N2 33.6L(标准状况)。
①用碱石灰除去的物质为_____ ;
②该产气药剂中NaN3的质量分数为______ 。
(1)NaN3是气体发生剂,受热分解产生N2和Na,N2的电子式为
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O。KClO4含有化学键的类型为
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为
(5)100g上述产气药剂产生的气体通过碱石灰后得到N2 33.6L(标准状况)。
①用碱石灰除去的物质为
②该产气药剂中NaN3的质量分数为
您最近一年使用:0次
2019-01-30更新
|
2694次组卷
|
16卷引用:2015年全国普通高等学校招生统一考试化学(重庆卷)
2015年全国普通高等学校招生统一考试化学(重庆卷)2017届重庆市育才中学高三上12月考前测试化学卷2015-2016学年宁夏六盘山中学高二下第一次月考化学卷2015-2016学年宁夏六盘山高中高一下期中化学试卷2015-2016学年辽宁省大连市瓦房店高中高二下期末化学试卷2017届宁夏固原市第一中学高三下学期第一次月考理综化学试卷22017届宁夏固原市第一中学高三下学期第一次月考理综化学试卷陕西省黄陵中学2018届高三(重点班)上学期期中考试化学试题(已下线)【中等生百日捷进提升系列-基础练测】专题2.4 氧化还原反应【全国校级联考】新疆维吾尔自治区昌吉市教育共同体2019届高三上学期9月月考化学试题【全国百强校】四川省阆中中学新区2018-2019学年高二上学期第一次月考化学试题百所名校联考-必修一模块综合检测鲁科版(2019)高一必修第二册 第2章 化学键 反应规律 微项目 研究车用燃料及安全气囊吉林省松原市油田第十一中学2021届高三第一次阶段考试化学试题(已下线)第8单元 原子结构 元素周期律(B卷 滚动提升检测)-2021年高考化学一轮复习单元滚动双测卷2017届宁夏固原市第一中学高三下学期第一次月考理综化学试卷1



