11-12高二上·四川成都·期中
1 . 四种短周期元素的性质或结构信息如下表。请根据信息回答下列问题。
(1)B元素在周期表中的位置是____ 区 ,写出A离子的电子排布式_______________
(2)写出C单质与水反应的离子方程式___________________________________
(3)A、B、C、 D四种元素的第一电离能由大到小的顺序______________________
(4)A、B两元素非金属性较强的是(写元素符号)________ 。写出证明这一结论的一个实验事实 _________________________________________________________________
| 元素 | A | B | C | D |
| 性质 结构 信息 | 室温下单质呈粉末状固体,加热易熔化。单质在纯氧中燃烧,发出明亮的蓝紫色火焰。 | 单质常温、常压下是气体,能溶于水。原子的M层有1个未成对的p电子。 | 单质质软、银白色固体、导电性强。单质在空气中燃烧发出黄色的火焰。 | 原子最外电子层上s电子数等于p电子数,等于电子层数。 |
(1)B元素在周期表中的位置是
(2)写出C单质与水反应的离子方程式
(3)A、B、C、 D四种元素的第一电离能由大到小的顺序
(4)A、B两元素非金属性较强的是(写元素符号)
您最近半年使用:0次
2 . 依据原子结构知识回答下列问题。
(1)下列有关说法错误的是___________。
(2)基态V原子中具有___________ 种不同能量的电子,具有___________ 种不同空间运动状态的电子,具有___________ 种不同运动状态的电子。
(3)基态Cu原子的简化电子排布式为___________ ,基态Se原子的价电子轨道表示式为___________ ,基态Mn2+的价电子排布式为___________ 。
(1)下列有关说法错误的是___________。
| A.简单离子的还原性:P3->O2->F- |
| B.在元素周期表第二周期中元素原子的第一电离能介于硼和氮之间的元素有两种 |
| C.焰色试验与电子跃迁有关 |
| D.基态铝原子占据的最高能级的电子云轮廓图的形状为球形 |
(3)基态Cu原子的简化电子排布式为
您最近半年使用:0次
3 . 依据原子结构知识回答下列问题。
(1)下列有关说法错误的是_______。
(2)基态氟原子的第一电离能_______ 基态氮原子的第一电离能(填大于、小于或等于)的原因是_______ 。
(3)基态Mn2+的价电子排布式为_______ 。
(4)Li2O是离子晶体,其形成过程中的能量变化如图(a)所示。
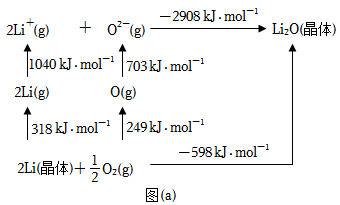
可知,Li原子的第一电离能为_______ kJ·mol-1,O=O键键能为_______ kJ·mol-1。
(1)下列有关说法错误的是_______。
| A.简单离子的还原性: P3->O2->F- |
| B.在元素周期表第二周期中元素原子的第一电离能介于硼和氮之间的元素有两种 |
| C.焰色试验与电子跃迁有关 |
| D.基态铝原子占据的最高能级的电子云轮廓图的形状为球形 |
(3)基态Mn2+的价电子排布式为
(4)Li2O是离子晶体,其形成过程中的能量变化如图(a)所示。
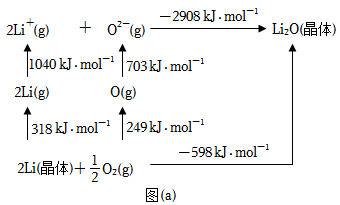
可知,Li原子的第一电离能为
您最近半年使用:0次
4 . 依据原子结构知识回答下列问题。
(1)下列有关说法错误的是_______。
(2)基态V原子中具有_______ 种不同能量的电子,具有_______ 种不同空间运动状态的电子,具有_______ 种不同运动状态的电子。
(3)基态Cu原子的简化电子排布式为_______ ,基态Se原子的价电子轨道表示式为_______ ,基态Mn2+的价电子排布式为_______ 。
(4)Li2O是离子晶体,其形成过程中的能量变化如图(a)所示。

可知,Li原子的第一电离能为_______ kJ·mol-1,O=O键键能为_______ kJ·mol-1。
(1)下列有关说法错误的是_______。
| A.简单离子的还原性:P3->O2->F- |
| B.在元素周期表第二周期中元素原子的第一电离能介于硼和氮之间的元素有两种 |
| C.焰色试验与电子跃迁有关 |
| D.基态铝原子占据的最高能级的电子云轮廓图的形状为球形 |
(3)基态Cu原子的简化电子排布式为
(4)Li2O是离子晶体,其形成过程中的能量变化如图(a)所示。

可知,Li原子的第一电离能为
您最近半年使用:0次
2022-04-04更新
|
566次组卷
|
3卷引用:湖南省湖南师范大学附属中学2021-2022学年高二上学期期末考试化学试题
湖南省湖南师范大学附属中学2021-2022学年高二上学期期末考试化学试题四川省成都市武侯高级中学2021-2022学年高二下学期期中考试化学试题(已下线)寒假作业10 原子结构与性质-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)
解题方法
5 . 如图为元素周期表中部分元素某种性质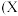 值
值 随原子序数变化的关系。
随原子序数变化的关系。
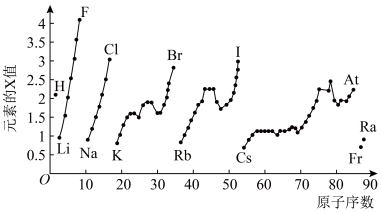
(1)短周期中原子核外p能级上电子总数与s能级上电子总数相等的元素是______  填元素符号
填元素符号 。
。
(2)同周期,随着原子序数的增大,X值变化趋势为______ 再结合同主族不同元素的X值变化的特点,体现了元素性质的______ 变化规律。
(3)X值较小的元素集中在元素周期表的______  填序号
填序号
A.左下角 右上角
右上角 分界线附近
分界线附近
(4)下列关于元素此性质的说法中正确的是______  填序号
填序号 。
。
A.X值可反映元素最高正化合价的变化规律
B.X值可反映原子在分子中吸引电子的能力
C.X值的大小可用来衡量元素金属性和非金属性的强弱
(5)SiHCl3与水发生的化学反应可认为是广义的水解反应,根据图中数据,该反应的化学方程式为______
 值
值 随原子序数变化的关系。
随原子序数变化的关系。
(1)短周期中原子核外p能级上电子总数与s能级上电子总数相等的元素是
 填元素符号
填元素符号 。
。(2)同周期,随着原子序数的增大,X值变化趋势为
(3)X值较小的元素集中在元素周期表的
 填序号
填序号
A.左下角
 右上角
右上角 分界线附近
分界线附近(4)下列关于元素此性质的说法中正确的是
 填序号
填序号 。
。A.X值可反映元素最高正化合价的变化规律
B.X值可反映原子在分子中吸引电子的能力
C.X值的大小可用来衡量元素金属性和非金属性的强弱
(5)SiHCl3与水发生的化学反应可认为是广义的水解反应,根据图中数据,该反应的化学方程式为
您最近半年使用:0次
2013·上海浦东新·二模
6 . 化学的魅力之一来自于许许多多的“最”。例如熔点最高的金属是钨,硬度最大的金属是铬,密度最大的金属是锇……。根据下面的“最”回答问题:
(1)空气中含量最多的元素与原子核外电子数最少的元素组成的简单物质的电子式_______ ,该分子属
于___________ (填“极性”或“非极性”)分子。
(2)海水中含量最多的四种元素,除了O、H外,另外二种元素的原子半径由大到小的顺序
_____ (填元素符号),其中任意三种元素组成的物质中肯定含有的化学键是______ 键。
(3)就物理性质而言,第二周期原子序数最小的元素的单质是_________ 最小的金属,其相邻元素R的化学性质与地壳中含量最多的金属元素的化学性质相似,写出R的最高价氧化物对应水化物与NaOH溶液反应的化学方程式:______________________________ 。
(4)关于人体内含量最多的元素M和最硬非金属单质的组成元素N的说法中,正确的是___ 。
a.M和N组成的物质中,M显负价,故M的非金属性强于N
b.M的氢化物的熔沸点必定比N的氢化物的熔沸点高
c.M原子的核外电子云形状种类比N原子的核外电子云形状种类要多
d.M原子的核外未成对电子数和N原子的核外未成对电子数目相等
(1)空气中含量最多的元素与原子核外电子数最少的元素组成的简单物质的电子式
于
(2)海水中含量最多的四种元素,除了O、H外,另外二种元素的原子半径由大到小的顺序
(3)就物理性质而言,第二周期原子序数最小的元素的单质是
(4)关于人体内含量最多的元素M和最硬非金属单质的组成元素N的说法中,正确的是
a.M和N组成的物质中,M显负价,故M的非金属性强于N
b.M的氢化物的熔沸点必定比N的氢化物的熔沸点高
c.M原子的核外电子云形状种类比N原子的核外电子云形状种类要多
d.M原子的核外未成对电子数和N原子的核外未成对电子数目相等
您最近半年使用:0次



