名校
1 . 磷酸铁锂(LiFePO4)电极材料主要用于各种锂离子电池。下列说法正确的是
| A.Fe位于周期表ds区 |
B.基态Fe2+价层电子的轨道表示式为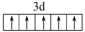 |
| C.P的基态原子含有15种不同空间运动状态的电子 |
| D.基态О原子核外电子占据的最高能级的电子云轮廓图为哑铃形 |
您最近一年使用:0次
名校
2 . I. 和
和 在工农业、科研等方面应用广泛。
在工农业、科研等方面应用广泛。
(1) (氨硼烷)是具有广泛应用前景的储氢材料。
(氨硼烷)是具有广泛应用前景的储氢材料。
① 中存在配位键,提供空轨道的原子是
中存在配位键,提供空轨道的原子是___________ 。
② 的沸点高于
的沸点高于 的可能原因是
的可能原因是___________ 。
(2)工业合成 时用到含铁催化剂。
时用到含铁催化剂。
① 元素在周期表第
元素在周期表第___________ 族,基态 原子电子的空间运动状态有
原子电子的空间运动状态有___________ 种。
②从结构的角度分析 容易被氧化成
容易被氧化成 的原因是
的原因是___________ 。
(3) 合金是储氢密度很高的材料之一,其晶胞结构如图所示。若该晶体储氢时,
合金是储氢密度很高的材料之一,其晶胞结构如图所示。若该晶体储氢时, 分子在晶胞的体心和棱的中心位置。
分子在晶胞的体心和棱的中心位置。 合金中,每个
合金中,每个 原子周围与它最近且相等距离的
原子周围与它最近且相等距离的 原子有
原子有___________ 个。
②要储存
 ,至少需要
,至少需要___________ 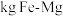 合金。
合金。
II.请回答:
(4)下列说法中正确的有___________ 。
①金属晶体的导电性、导热性均与自由电子有关
②若晶体中有阳离子,必然有阴离子
③分子晶体的熔点一定比金属晶体低
④共价键的强弱决定分子晶体熔、沸点的高低
⑤共价晶体中一定含有共价键
⑥含有离子的晶体一定是离子晶体
⑦硬度由大到小:金刚石>碳化硅>晶体硅
⑧ 和
和 晶体中,阴离子周围紧邻的阳离子数均为8
晶体中,阴离子周围紧邻的阳离子数均为8
 和
和 在工农业、科研等方面应用广泛。
在工农业、科研等方面应用广泛。(1)
 (氨硼烷)是具有广泛应用前景的储氢材料。
(氨硼烷)是具有广泛应用前景的储氢材料。①
 中存在配位键,提供空轨道的原子是
中存在配位键,提供空轨道的原子是②
 的沸点高于
的沸点高于 的可能原因是
的可能原因是(2)工业合成
 时用到含铁催化剂。
时用到含铁催化剂。①
 元素在周期表第
元素在周期表第 原子电子的空间运动状态有
原子电子的空间运动状态有②从结构的角度分析
 容易被氧化成
容易被氧化成 的原因是
的原因是(3)
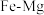 合金是储氢密度很高的材料之一,其晶胞结构如图所示。若该晶体储氢时,
合金是储氢密度很高的材料之一,其晶胞结构如图所示。若该晶体储氢时, 分子在晶胞的体心和棱的中心位置。
分子在晶胞的体心和棱的中心位置。
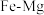 合金中,每个
合金中,每个 原子周围与它最近且相等距离的
原子周围与它最近且相等距离的 原子有
原子有②要储存
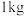
 ,至少需要
,至少需要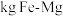 合金。
合金。II.请回答:
(4)下列说法中正确的有
①金属晶体的导电性、导热性均与自由电子有关
②若晶体中有阳离子,必然有阴离子
③分子晶体的熔点一定比金属晶体低
④共价键的强弱决定分子晶体熔、沸点的高低
⑤共价晶体中一定含有共价键
⑥含有离子的晶体一定是离子晶体
⑦硬度由大到小:金刚石>碳化硅>晶体硅
⑧
 和
和 晶体中,阴离子周围紧邻的阳离子数均为8
晶体中,阴离子周围紧邻的阳离子数均为8
您最近一年使用:0次
名校
3 . 下列说法中正确的是
A.聚丙烯的结构简式为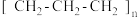 |
B.分子的极性: |
C. 、 、 、 、 都是含有极性键的非极性分子 都是含有极性键的非极性分子 |
D. 键的电子云图形是镜面对称的,而 键的电子云图形是镜面对称的,而 键的电子云图形是轴对称的 键的电子云图形是轴对称的 |
您最近一年使用:0次
4 . 下列关于原子结构的说法不正确的是
A.电子由3d能级跃迁至4p能级,其光谱为吸收光谱 |
| B.s电子云是在空间各个方向上伸展程度相同的对称形状 |
| C.元素周期表每一周期原子的最外层电子排布均是从ns1过渡到ns2np6 |
| D.日常生活中的焰火、LED灯都与原子核外电子跃迁释放能量有关 |
您最近一年使用:0次
5 . 下列说法正确的是
| A.s电子云呈球形,表示电子绕原子核做圆周运动 |
| B.电子云图中的小黑点密度大,说明该原子核外空间电子数目多 |
C.p电子的电子云轮廓图可表示为 |
D.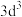 表示的电子排布图为 表示的电子排布图为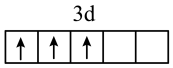 |
您最近一年使用:0次
6 . 我国在新材料领域研究的重大突破,为“天宫”空间站的建设提供了坚实的物质基础。“天宫”空间站使用的材料中含有B、C、N、P、Ni、Fe、Mn等元素。回答下列问题:
(1)下列不同状态的硼中,用光谱仪可捕捉到发射光谱的是_______ 。(填标号)
(2)镍能形成多种配合物,其中Ni(CO)4是无色挥发性液体,K2[Ni(CN)4]是红黄色单斜晶体。K2[Ni(CN)4]的熔点高于Ni(CO)4的原因是_______ 。
(3)氮化硼(BN)晶体有多种结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,质地软,可作润滑剂。立方相氮化硼与金刚石相似,是超硬材料,有优异的耐磨性。它们的晶体结构及晶胞如图所示。_______ 。
②立方相氮化硼晶体中“一般共价键”与配位键的数目之比为_______ 。
(4)FeSO4•7H2O的结构如图所示,FeSO4•7H2O中∠1、∠2、∠3由大到小的顺序是_______ 。_______ 。
②该锰的硅化物的化学式为_______ 。
(1)下列不同状态的硼中,用光谱仪可捕捉到发射光谱的是
A. |
B. |
C. |
D. |
(3)氮化硼(BN)晶体有多种结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,质地软,可作润滑剂。立方相氮化硼与金刚石相似,是超硬材料,有优异的耐磨性。它们的晶体结构及晶胞如图所示。

②立方相氮化硼晶体中“一般共价键”与配位键的数目之比为
(4)FeSO4•7H2O的结构如图所示,FeSO4•7H2O中∠1、∠2、∠3由大到小的顺序是


②该锰的硅化物的化学式为
您最近一年使用:0次
7 . 下列化学用语或图示表达错误的是
A.顺-2-丁烯的分子结构模型: |
B.基态 原子的价层电子轨道表示式: 原子的价层电子轨道表示式: |
C. 电子云图: 电子云图: |
D.2-甲基-3-乙基戊烷的键线式: |
您最近一年使用:0次
名校
8 . X、Y、Z、W、E、F、G是原子序数小于36的七种元素,且原子序数依次增大。X元素基态原子的价电子排布式为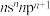 ;Z元素为最活泼的非金属元素;W元素原子核外有三个电子层,其最外层电子数是核外电子总数的1/6;E元素基态正三价离子的3d轨道为半充满状态;F元素基态原子的内层全充满,N层只有一个电子;G是周期表中第33号元素。
;Z元素为最活泼的非金属元素;W元素原子核外有三个电子层,其最外层电子数是核外电子总数的1/6;E元素基态正三价离子的3d轨道为半充满状态;F元素基态原子的内层全充满,N层只有一个电子;G是周期表中第33号元素。
(1)E元素基态原子的电子排布式为________ 。基态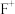 的电子排布式为
的电子排布式为________ 。
(2)Z、W形成的简单离子半径较小的是________ (填离子符号)。
(3)比较X、Y的第一电离能大小并说明理由:________ 。
(4)F元素位于元素周期表的________ 区。
(5)G元素在周期表中的位置是________ ,其可能具有的性质是________ (填字母)。
A.其单质具有较强的导电性 B.其最高价氧化物对应水化物的化学式为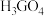
C.其原子半径大于锗 D.其第一电离能小于硒
(6)元素X基态原子能量最高的电子所处原子轨道的形状为________ 形,若氢原子与这些电子所处的轨道采用“头碰头”的方式成键,则所得分子中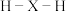 的键角理论上为
的键角理论上为________ 。
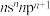 ;Z元素为最活泼的非金属元素;W元素原子核外有三个电子层,其最外层电子数是核外电子总数的1/6;E元素基态正三价离子的3d轨道为半充满状态;F元素基态原子的内层全充满,N层只有一个电子;G是周期表中第33号元素。
;Z元素为最活泼的非金属元素;W元素原子核外有三个电子层,其最外层电子数是核外电子总数的1/6;E元素基态正三价离子的3d轨道为半充满状态;F元素基态原子的内层全充满,N层只有一个电子;G是周期表中第33号元素。(1)E元素基态原子的电子排布式为
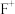 的电子排布式为
的电子排布式为(2)Z、W形成的简单离子半径较小的是
(3)比较X、Y的第一电离能大小并说明理由:
(4)F元素位于元素周期表的
(5)G元素在周期表中的位置是
A.其单质具有较强的导电性 B.其最高价氧化物对应水化物的化学式为
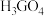
C.其原子半径大于锗 D.其第一电离能小于硒
(6)元素X基态原子能量最高的电子所处原子轨道的形状为
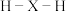 的键角理论上为
的键角理论上为
您最近一年使用:0次
7日内更新
|
23次组卷
|
2卷引用:江苏省南京市第九中学2023-2024学年高一下学期教学质量调研(二)化学试题
名校
解题方法
9 . 材料是人类文明进步的阶梯,第IIIA、IVA、VA族元素是组成特殊材料的重要元素。请回答下列问题:
(1)基态As原子核外能量最高能级的电子云形状为___________ 。
(2)M与 位于同周期,
位于同周期, 的一种配合物组成为
的一种配合物组成为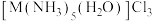 。
。
①下列有关 、
、 的说法正确的是
的说法正确的是___________ (填字母)。
a.分子空间构型相同 b.中心原子杂化类型相同 c.键角大小相同
② 含
含___________ molσ键。
③配合物T与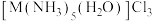 组成元素相同,中心离子的配位数相同。
组成元素相同,中心离子的配位数相同。 溶于水,加入足量
溶于水,加入足量 溶液可生成
溶液可生成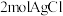 ;且T溶于水加强碱再加热不产生氨气。则T的化学式为
;且T溶于水加强碱再加热不产生氨气。则T的化学式为___________ 。
(3)常压、180℃时, 升华形成的二聚体
升华形成的二聚体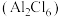 的结构如图所示。
的结构如图所示。___________ 。 的配位数为
的配位数为___________ 。
(4)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞结构如右图所示,该晶胞中B原子填在P原子所围成的___________ (填“立方体”“正四面体”或“正八面体”)空隙中;若该晶体的密度为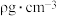 ,
, 是阿伏伽德罗常数的值。BP晶胞中面心上6个P原子相连构成正八面体,该正八面体的边长为
是阿伏伽德罗常数的值。BP晶胞中面心上6个P原子相连构成正八面体,该正八面体的边长为___________  (列式即可)。
(列式即可)。
(1)基态As原子核外能量最高能级的电子云形状为
(2)M与
 位于同周期,
位于同周期, 的一种配合物组成为
的一种配合物组成为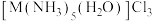 。
。①下列有关
 、
、 的说法正确的是
的说法正确的是a.分子空间构型相同 b.中心原子杂化类型相同 c.键角大小相同
②
 含
含③配合物T与
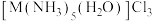 组成元素相同,中心离子的配位数相同。
组成元素相同,中心离子的配位数相同。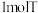 溶于水,加入足量
溶于水,加入足量 溶液可生成
溶液可生成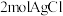 ;且T溶于水加强碱再加热不产生氨气。则T的化学式为
;且T溶于水加强碱再加热不产生氨气。则T的化学式为(3)常压、180℃时,
 升华形成的二聚体
升华形成的二聚体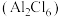 的结构如图所示。
的结构如图所示。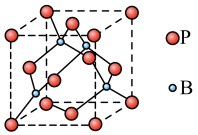
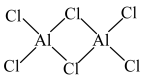
 的配位数为
的配位数为(4)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞结构如右图所示,该晶胞中B原子填在P原子所围成的
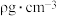 ,
, 是阿伏伽德罗常数的值。BP晶胞中面心上6个P原子相连构成正八面体,该正八面体的边长为
是阿伏伽德罗常数的值。BP晶胞中面心上6个P原子相连构成正八面体,该正八面体的边长为 (列式即可)。
(列式即可)。
您最近一年使用:0次
名校
10 . 下列共价键的示意图中,属于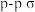 键的是
键的是
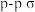 键的是
键的是A. | B. | C. | D. |
您最近一年使用:0次



