名校
解题方法
1 . A、B、C、D、E、F均是短周期元素,其原子序数依次增大,A和B同周期,A和E同主族,A原子最外层电子数是内层电子数的二倍,B元素族序数是周期数的三倍,B的阴离子与C、D的阳离子电子层结构相同,C与B可生成C2B或C2B2,D的阳离子半径是同周期最小的,F的原子半径是所在周期中最小的。请回答:
(1)E在元素周期表中的位置是_______ 。
(2)C所在周期电负性最强的是_______ ;AB2的结构式是_______ 。
(3)B、C、F的离子半径由大到小的顺序为_______ (用化学式回答,下同);A、D、E元素的最高价氧化物对应水化物中,酸性最强的是_______ 。
(4)B的简单氢化物比H2S沸点高的原因是_______ 。
(5)C与D两元素的最高价氧化物对应水化物反应的离子方程式:_______ 。
(6)用一个离子方程式证明A、E的非金属性强弱:_______ 。
(1)E在元素周期表中的位置是
(2)C所在周期电负性最强的是
(3)B、C、F的离子半径由大到小的顺序为
(4)B的简单氢化物比H2S沸点高的原因是
(5)C与D两元素的最高价氧化物对应水化物反应的离子方程式:
(6)用一个离子方程式证明A、E的非金属性强弱:
您最近一年使用:0次
2 . ①~⑥六种元素在元素周期表中的位置如下表。
回答下列问题:
(1)①的元素名称是_______ 。
(2)①、②的简单氢化物中,熔沸点较高的是_______ (填化学式)。
(3)③、④、⑤三种元素中,电负性最大的是_______ (填元素符号)。
(4)③、④两种元素的原子中,第一电离能较大的是_______ (填元素符号)。
(5)⑥的基态原子的核外电子排布式是_______ 。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | ① | ② | |||||
| 3 | ③ | ④ | ⑤ | ||||
| 4 | ⑥ |
(1)①的元素名称是
(2)①、②的简单氢化物中,熔沸点较高的是
(3)③、④、⑤三种元素中,电负性最大的是
(4)③、④两种元素的原子中,第一电离能较大的是
(5)⑥的基态原子的核外电子排布式是
您最近一年使用:0次
解题方法
3 . 已知A、B、C、D、E是原子序数依次增大的前四周期元素,A的基态原子中s电子是p电子的两倍,C原子最外层电子数是次外层电子数的3倍,D的某种固体单质Dn为正四面体构型,其燃点接近常温,E原子的M能层全充满,其最外层只有一个电子。请回答下列问题:
(1)A、B、C三种元素的电负性由小到大的顺序为_____ (用元素符号回答),E元素位于周期表的___ 区。
(2)Dn中D的杂化方式为__ 杂化,若F是与D同族的D的下一周期元素,则F的原子序数为__ 。
(3)B的氢化物在工业生产中用途广泛。
BH3极易溶于水的原因之一是BH3和水都为极性分子,相似相溶;原因之二是__________ 。
B的另一种氢化物B2H4是一种高能燃料,写出它的电子式________ ,它的性质与BH3相似,易溶于水,可发生如下电离过程:
I、B2H4+H2O B2H
B2H +OH-
+OH-
II、B2H +H2O
+H2O B2H
B2H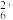 +OH-
+OH-
已知在相同条件下过程I的进行程度大于过程II进行的程度。常温下,若0.2 mol/LB2H4溶液与0.1 mol/L HCl溶液等体积混合,则溶液中B2H 、Cl-、OH-、H+粒子浓度由大到小的顺序为
、Cl-、OH-、H+粒子浓度由大到小的顺序为____ 。
(4)E2C为红色固体,取一定量的E2C的固体加入到足量的稀硫酸中,充分搅拌后溶液呈蓝色,溶液中仍然残留红色固体。请写出该过程的离子方程式______________ 。
(1)A、B、C三种元素的电负性由小到大的顺序为
(2)Dn中D的杂化方式为
(3)B的氢化物在工业生产中用途广泛。
BH3极易溶于水的原因之一是BH3和水都为极性分子,相似相溶;原因之二是
B的另一种氢化物B2H4是一种高能燃料,写出它的电子式
I、B2H4+H2O
 B2H
B2H +OH-
+OH- II、B2H
 +H2O
+H2O B2H
B2H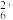 +OH-
+OH-已知在相同条件下过程I的进行程度大于过程II进行的程度。常温下,若0.2 mol/LB2H4溶液与0.1 mol/L HCl溶液等体积混合,则溶液中B2H
 、Cl-、OH-、H+粒子浓度由大到小的顺序为
、Cl-、OH-、H+粒子浓度由大到小的顺序为(4)E2C为红色固体,取一定量的E2C的固体加入到足量的稀硫酸中,充分搅拌后溶液呈蓝色,溶液中仍然残留红色固体。请写出该过程的离子方程式
您最近一年使用:0次



