解题方法
1 . 副族元素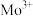 、
、 等元素较
等元素较 更易形成配合物,但是二环己烷并—18—冠(醚)—6在高锰酸钾溶液
更易形成配合物,但是二环己烷并—18—冠(醚)—6在高锰酸钾溶液_______ ;锰在周期表中的_______ 区。
(2)“超分子”中各元素(除H外)电负性由大到小的顺序为_______ 。
(3)副族元素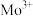 、
、 等元素比
等元素比 更易形成配合物,其原因是
更易形成配合物,其原因是_______ ; 与配体
与配体 形成共价键,提供孤电子对的原子是
形成共价键,提供孤电子对的原子是_______ (填元素符号),其中配体中C原子的杂化方式为_______ , 结合1个O和1个
结合1个O和1个 得到一种常见微粒,其空间构型为
得到一种常见微粒,其空间构型为_______ 。
(4)冠醚能够提升高锰酸钾氧化己烯的速率的原因是_______ 。
(5)氮化钼晶胞结构如图所示,N原子填充Mo围成的八面体空隙中,填充率为100%。_______ ;
② 的熔点
的熔点_______ (填“>”、“<”或“=”) ;
;
③若该八面体边长为 ,则晶胞的密度为
,则晶胞的密度为
_______  (
( 表示啊伏伽德罗常数)。
表示啊伏伽德罗常数)。
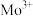 、
、 等元素较
等元素较 更易形成配合物,但是二环己烷并—18—冠(醚)—6在高锰酸钾溶液
更易形成配合物,但是二环己烷并—18—冠(醚)—6在高锰酸钾溶液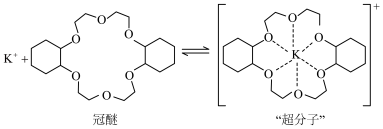
(2)“超分子”中各元素(除H外)电负性由大到小的顺序为
(3)副族元素
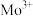 、
、 等元素比
等元素比 更易形成配合物,其原因是
更易形成配合物,其原因是 与配体
与配体 形成共价键,提供孤电子对的原子是
形成共价键,提供孤电子对的原子是 结合1个O和1个
结合1个O和1个 得到一种常见微粒,其空间构型为
得到一种常见微粒,其空间构型为(4)冠醚能够提升高锰酸钾氧化己烯的速率的原因是
(5)氮化钼晶胞结构如图所示,N原子填充Mo围成的八面体空隙中,填充率为100%。

②
 的熔点
的熔点 ;
;③若该八面体边长为
 ,则晶胞的密度为
,则晶胞的密度为
 (
( 表示啊伏伽德罗常数)。
表示啊伏伽德罗常数)。
您最近一年使用:0次
解题方法
2 . 含氟化合物 、三氟乙酰胺(
、三氟乙酰胺( )、
)、 等在生产、生活中都有重要用途。
等在生产、生活中都有重要用途。
(1)写出 中基态锰离子的价电子排布式
中基态锰离子的价电子排布式________ 。
(2)三氟乙酰胺中各元素电负性由大到小的顺序是________ 。
(3)三氟乙酰胺中碳原子的杂化方式是________ 。
(4)三氟乙酰胺分子中 键数和孤电子对数之比为
键数和孤电子对数之比为________ 。
(5) 的熔点为129℃,沸点为114℃(升华),推测
的熔点为129℃,沸点为114℃(升华),推测 晶体类型是
晶体类型是________ 。
(6) 晶体属四方晶系,晶胞参数如下图所示,晶胞棱边夹角均为90°,该晶胞中有
晶体属四方晶系,晶胞参数如下图所示,晶胞棱边夹角均为90°,该晶胞中有________ 个 分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为
分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为 。已知
。已知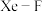 键长为
键长为 ,则B点原子的分数坐标为
,则B点原子的分数坐标为________ ;晶胞中A、B间距离
________ pm。
 、三氟乙酰胺(
、三氟乙酰胺( )、
)、 等在生产、生活中都有重要用途。
等在生产、生活中都有重要用途。(1)写出
 中基态锰离子的价电子排布式
中基态锰离子的价电子排布式(2)三氟乙酰胺中各元素电负性由大到小的顺序是
(3)三氟乙酰胺中碳原子的杂化方式是
(4)三氟乙酰胺分子中
 键数和孤电子对数之比为
键数和孤电子对数之比为(5)
 的熔点为129℃,沸点为114℃(升华),推测
的熔点为129℃,沸点为114℃(升华),推测 晶体类型是
晶体类型是(6)
 晶体属四方晶系,晶胞参数如下图所示,晶胞棱边夹角均为90°,该晶胞中有
晶体属四方晶系,晶胞参数如下图所示,晶胞棱边夹角均为90°,该晶胞中有 分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为
分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为 。已知
。已知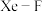 键长为
键长为 ,则B点原子的分数坐标为
,则B点原子的分数坐标为

您最近一年使用:0次
3 . 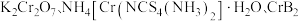 均是铬的重要化合物,回答下列问题:
均是铬的重要化合物,回答下列问题: 原子有
原子有___________ 种能量不同的电子,价电子排布式为___________ 。
(2)已知电子亲和能(E)是基态的气态原子得到电子变为气态阴离子所放出的能量, 。氧的第一电子亲和能
。氧的第一电子亲和能 为
为___________  ;
; ,其原因是
,其原因是___________ 。
(3)雷氏盐的化学式为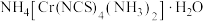 。
。
①H、C、N、O四种元素的电负性由大到小的顺序为___________ 。
②雷氏盐中所含化学键类型___________ 。
A.离子键 B.共价键 C.配位键 D.金属键 E.氢键
③配体之一 分子的
分子的 模型名称为
模型名称为___________ ,与配体 互为等电子体的分子和离子有
互为等电子体的分子和离子有___________ 、___________ (各写1种)。
(4) 的晶体密度为
的晶体密度为 ,晶体结构(如图)为六棱柱,底边边长为
,晶体结构(如图)为六棱柱,底边边长为 ,高为
,高为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则
,则
___________ (列出计算式)。
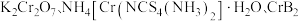 均是铬的重要化合物,回答下列问题:
均是铬的重要化合物,回答下列问题: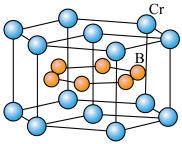
 原子有
原子有(2)已知电子亲和能(E)是基态的气态原子得到电子变为气态阴离子所放出的能量,
 。氧的第一电子亲和能
。氧的第一电子亲和能 为
为 ;
; ,其原因是
,其原因是(3)雷氏盐的化学式为
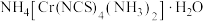 。
。①H、C、N、O四种元素的电负性由大到小的顺序为
②雷氏盐中所含化学键类型
A.离子键 B.共价键 C.配位键 D.金属键 E.氢键
③配体之一
 分子的
分子的 模型名称为
模型名称为 互为等电子体的分子和离子有
互为等电子体的分子和离子有(4)
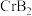 的晶体密度为
的晶体密度为 ,晶体结构(如图)为六棱柱,底边边长为
,晶体结构(如图)为六棱柱,底边边长为 ,高为
,高为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则
,则
您最近一年使用:0次
名校
4 . 2023年诺贝尔化学奖授予蒙吉·G·巴文迪等三位科学家,以表彰他们在发现和合成量子点方面所作出的贡献,碳量子点是一类具有显著荧光性能的零维碳纳米材料,其结构如图所示。回答下列问题:_______ 区,图中C的杂化方式为_______ 。
(2)碳量子点结构包含的元素中电负性由大到小排列为:_______ 。
(3)碳量子点水溶性_______ (选填“>”“<”“=”)石墨水溶性,理由是:_______ 。
(4)高压合成金刚石的原料是廉价的石墨,用高压釜持续施加高温高压并加入金属镍等金属催化剂,石墨可转化为金刚石。基态镍原子核外电子的空间运动状态有_______ 种,比较二者C-C共价键的键长:石墨_______ 金刚石(选填“>”“<”“=”)。
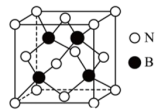
(5)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,其中一种结构为立方氮化硼(如图),类似于金刚石。_______ ,则立方氮化硼晶体密度为_______ g·cm-3(列出计算式,阿伏加德罗常数的值为NA)。

(2)碳量子点结构包含的元素中电负性由大到小排列为:
(3)碳量子点水溶性
(4)高压合成金刚石的原料是廉价的石墨,用高压釜持续施加高温高压并加入金属镍等金属催化剂,石墨可转化为金刚石。基态镍原子核外电子的空间运动状态有
(5)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,其中一种结构为立方氮化硼(如图),类似于金刚石。
您最近一年使用:0次
名校
解题方法
5 . 锰(Mn)、钴(Co)、镍(Ni)等过渡金属元素化合物的应用研究是前沿科学之一,回答下列问题:
(1) 的价电子排布式为
的价电子排布式为_______ 。金属锰可导电、导热,有金属光泽和延展性,这些性质都可以用“_______ 理论”解释。
(2)已知金属锰有多种晶型,γ型锰的面心立方晶胞俯视图符合下列_______ (填序号),Mn原子的配位数为_______ 。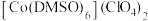 是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为
是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为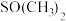 。DMSO中硫原子的杂化轨道类型为
。DMSO中硫原子的杂化轨道类型为_______ ,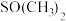 中键角
中键角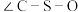
_______  中键角
中键角 (填“大于”“小于”或“等于”),
(填“大于”“小于”或“等于”), 的中心原子价层电子对数为
的中心原子价层电子对数为_______ ,元素S、Mn、N的电负性由大到小的顺序为_______ 。
(4)镍和苯基硼酸在催化剂作用下可以合成丙烯醇(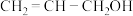 ),该物质与丙醛(
),该物质与丙醛(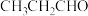 )相比,两者沸点相差较大,原因是
)相比,两者沸点相差较大,原因是_______ 。
(5) 的晶胞结构如图甲所示,其中离子坐标参数A为
的晶胞结构如图甲所示,其中离子坐标参数A为 ,B为
,B为 ,则C的离子坐标参数为
,则C的离子坐标参数为_______ 。一定温度下, 晶体可以自发地分散并形成“单分子层”,可以认为
晶体可以自发地分散并形成“单分子层”,可以认为 作密置单层排列,
作密置单层排列, 填充其中(如图乙),已知
填充其中(如图乙),已知 的半径为
的半径为 ,设阿伏加德罗常数值为NA,每平方米面积上具有该晶体的质量为
,设阿伏加德罗常数值为NA,每平方米面积上具有该晶体的质量为_______ g(用含a、NA的代数式表示)。
(1)
 的价电子排布式为
的价电子排布式为(2)已知金属锰有多种晶型,γ型锰的面心立方晶胞俯视图符合下列
A.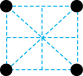 B.
B. C.
C.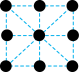 D.
D.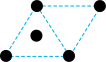
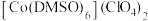 是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为
是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为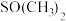 。DMSO中硫原子的杂化轨道类型为
。DMSO中硫原子的杂化轨道类型为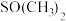 中键角
中键角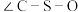
 中键角
中键角 (填“大于”“小于”或“等于”),
(填“大于”“小于”或“等于”), 的中心原子价层电子对数为
的中心原子价层电子对数为(4)镍和苯基硼酸在催化剂作用下可以合成丙烯醇(
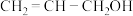 ),该物质与丙醛(
),该物质与丙醛(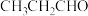 )相比,两者沸点相差较大,原因是
)相比,两者沸点相差较大,原因是(5)
 的晶胞结构如图甲所示,其中离子坐标参数A为
的晶胞结构如图甲所示,其中离子坐标参数A为 ,B为
,B为 ,则C的离子坐标参数为
,则C的离子坐标参数为 晶体可以自发地分散并形成“单分子层”,可以认为
晶体可以自发地分散并形成“单分子层”,可以认为 作密置单层排列,
作密置单层排列, 填充其中(如图乙),已知
填充其中(如图乙),已知 的半径为
的半径为 ,设阿伏加德罗常数值为NA,每平方米面积上具有该晶体的质量为
,设阿伏加德罗常数值为NA,每平方米面积上具有该晶体的质量为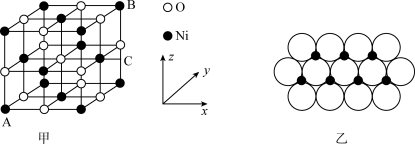
您最近一年使用:0次
2024-04-21更新
|
260次组卷
|
2卷引用:四川省绵阳南山中学2024届高三下学期三诊热身考试理综-化学试题
名校
解题方法
6 . 含铜物质在生产生活中有着广泛应用。回答下列问题:
(1)一个原子轨道填充2个自旋方向相反(顺时针和逆时针)的电子。原子中电子有两种相反的自旋状态,分别用 和
和 表示,称为电子的自旋磁量子数,则基态铜原子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,则基态铜原子自旋磁量子数的代数和为_______ ;基态 较基态
较基态 更稳定的原因是
更稳定的原因是_______ 。
(2) 稀溶液中存在
稀溶液中存在 ,
, 的空间构型为八面体形:下列对
的空间构型为八面体形:下列对 中
中 杂化方式推断合理的是_______(填标号)。
杂化方式推断合理的是_______(填标号)。
(3) 可形成
可形成 ,其中en代表
,其中en代表 。1mol该配合物中,VSEPR模型为四面体的非金属原子共有
。1mol该配合物中,VSEPR模型为四面体的非金属原子共有_______ 个;C、N、F的电负性由大到小的顺序为_______ 。
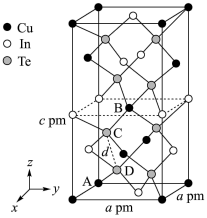
(4)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为_______ ;该晶体的化学式为_______ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点,B点原子的分数坐标分别为(0,0,0)、 ,则C点原子的分数坐标为
,则C点原子的分数坐标为_______ ,晶胞中C、D间距离
_______ pm。
(1)一个原子轨道填充2个自旋方向相反(顺时针和逆时针)的电子。原子中电子有两种相反的自旋状态,分别用
 和
和 表示,称为电子的自旋磁量子数,则基态铜原子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,则基态铜原子自旋磁量子数的代数和为 较基态
较基态 更稳定的原因是
更稳定的原因是(2)
 稀溶液中存在
稀溶液中存在 ,
, 的空间构型为八面体形:下列对
的空间构型为八面体形:下列对 中
中 杂化方式推断合理的是_______(填标号)。
杂化方式推断合理的是_______(填标号)。A. | B. | C.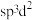 | D. |
(3)
 可形成
可形成 ,其中en代表
,其中en代表 。1mol该配合物中,VSEPR模型为四面体的非金属原子共有
。1mol该配合物中,VSEPR模型为四面体的非金属原子共有(4)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为
 ,则C点原子的分数坐标为
,则C点原子的分数坐标为

您最近一年使用:0次
2024-04-04更新
|
688次组卷
|
3卷引用:2024届四川省成都市第七中学高三下学期二模诊断考试理综试题-高中化学
解题方法
7 . “无机”碳化学的一个重要领域是含有C—N键的化合物,其中重要的化合物有氰 、氰化氢、氰化物、氰酸盐等。回答下列问题:
、氰化氢、氰化物、氰酸盐等。回答下列问题:
(1)基态 的价层电子轨道表示式为
的价层电子轨道表示式为_______ 。
(2) 与卤素性质相似,与
与卤素性质相似,与 反应生成HCN和HOCN,反应中所含元素的电负性由大到小的顺序为
反应生成HCN和HOCN,反应中所含元素的电负性由大到小的顺序为_______ , 中C原子的杂化方式为
中C原子的杂化方式为_______ 。
(3)科学家研究发现,在低温下,HCN可结晶成晶体,在晶体中HCN分子排列可形成 的无限长链,其原因是
的无限长链,其原因是_______ ;写出 分子的链状结构
分子的链状结构_______ 。
(4)将氰化物与氟化物或氯化物一起反应,即可得FCN和ClCN,它们的沸点数据如下表所示:
ClCN的沸点比FCN的沸点高原因是_______ 。
(5)氰酸根离子可与大多数金属阳离子形成氰化物,几种金属氰化物的晶胞转化关系如图一所示,从普鲁士蓝晶胞中切出 的结构,如图二所示。
的结构,如图二所示。

①下列说法正确的是_______ (填标号)。
A.每个普鲁士蓝晶胞中含6个 键
键
B.普鲁士白的化学式为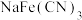
C.格林绿晶体中 周围等距且最近的
周围等距且最近的 数目为12
数目为12
②已知普鲁士白晶胞的晶胞参数均为a pm,设 为阿伏加德罗常数的值,则普鲁士白晶体密度为
为阿伏加德罗常数的值,则普鲁士白晶体密度为_______  (用含
(用含 、
、 、
、 计算式表示)。
计算式表示)。
 、氰化氢、氰化物、氰酸盐等。回答下列问题:
、氰化氢、氰化物、氰酸盐等。回答下列问题:(1)基态
 的价层电子轨道表示式为
的价层电子轨道表示式为(2)
 与卤素性质相似,与
与卤素性质相似,与 反应生成HCN和HOCN,反应中所含元素的电负性由大到小的顺序为
反应生成HCN和HOCN,反应中所含元素的电负性由大到小的顺序为 中C原子的杂化方式为
中C原子的杂化方式为(3)科学家研究发现,在低温下,HCN可结晶成晶体,在晶体中HCN分子排列可形成
 的无限长链,其原因是
的无限长链,其原因是 分子的链状结构
分子的链状结构(4)将氰化物与氟化物或氯化物一起反应,即可得FCN和ClCN,它们的沸点数据如下表所示:
| FCN | ClCN | |
| 沸点/K | 227 | 286 |
(5)氰酸根离子可与大多数金属阳离子形成氰化物,几种金属氰化物的晶胞转化关系如图一所示,从普鲁士蓝晶胞中切出
 的结构,如图二所示。
的结构,如图二所示。
①下列说法正确的是
A.每个普鲁士蓝晶胞中含6个
 键
键B.普鲁士白的化学式为
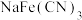
C.格林绿晶体中
 周围等距且最近的
周围等距且最近的 数目为12
数目为12②已知普鲁士白晶胞的晶胞参数均为a pm,设
 为阿伏加德罗常数的值,则普鲁士白晶体密度为
为阿伏加德罗常数的值,则普鲁士白晶体密度为 (用含
(用含 、
、 、
、 计算式表示)。
计算式表示)。
您最近一年使用:0次
解题方法
8 . 硼(B)是一种重要的类金属元素,在化工、冶金等行业具有重要的应用价值。请回答:
(1)基态B原子的核外电子排布式是___________ 。
(2)乙硼烷水解生成硼酸(H3BO3),常温常压下硼酸晶体结构为层状,其二维平面结构如图
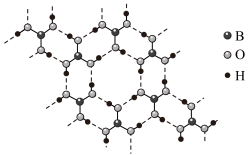
①硼酸晶体属于___________ 晶体(填“离子”或“分子”),电负性:B___________ O。(填“>”或“<”)
②1 mol H3BO3的晶体中含有___________ mol氢键,B原子的杂化方式为___________ 。
③硼酸是一元弱酸,它本身不给出质子,但是溶于水后能给出 。请解释硼酸水溶液呈酸性的原因(请用相关文字解释):
。请解释硼酸水溶液呈酸性的原因(请用相关文字解释):___________ 。
(3)近年来硼氢类离子液体作为火箭推进剂燃料得到了广泛使用。该化合物(如图所示)中不存在的作用力有___________ (填字母)。

a.离子键 b.配位键 c.金属键 d. 键 e.
键 e. 键 f.氢键
键 f.氢键
(4)硼化钙晶胞结构如图所示,B原子构成 八面体,各个顶点通过
八面体,各个顶点通过 键互相连接成三维骨架,八个
键互相连接成三维骨架,八个 多面体围成立方体,中心为
多面体围成立方体,中心为 ,晶胞密度为
,晶胞密度为 。
。

①硼化钙的化学式为___________ 。
②晶胞边长为___________ nm(已知NA为阿伏加德罗常数)。
(1)基态B原子的核外电子排布式是
(2)乙硼烷水解生成硼酸(H3BO3),常温常压下硼酸晶体结构为层状,其二维平面结构如图

①硼酸晶体属于
②1 mol H3BO3的晶体中含有
③硼酸是一元弱酸,它本身不给出质子,但是溶于水后能给出
 。请解释硼酸水溶液呈酸性的原因(请用相关文字解释):
。请解释硼酸水溶液呈酸性的原因(请用相关文字解释):(3)近年来硼氢类离子液体作为火箭推进剂燃料得到了广泛使用。该化合物(如图所示)中不存在的作用力有

a.离子键 b.配位键 c.金属键 d.
 键 e.
键 e. 键 f.氢键
键 f.氢键(4)硼化钙晶胞结构如图所示,B原子构成
 八面体,各个顶点通过
八面体,各个顶点通过 键互相连接成三维骨架,八个
键互相连接成三维骨架,八个 多面体围成立方体,中心为
多面体围成立方体,中心为 ,晶胞密度为
,晶胞密度为 。
。
①硼化钙的化学式为
②晶胞边长为
您最近一年使用:0次
名校
9 . 固体电解质以其在电池、传感器等装置中的广泛应用而备受关注,大致分为无机物类及高分子类。
(1)固体电解质中研究得最多的是 和O等的导体。
和O等的导体。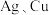 在元素周期表中位于同一族且
在元素周期表中位于同一族且 在
在 的下一周期,具有类似的价层电子排布式,
的下一周期,具有类似的价层电子排布式, 的价层电子排布式为
的价层电子排布式为___________ 。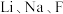 和O的电负性从小到大的顺序为
和O的电负性从小到大的顺序为___________ 。F的第二电离能___________ O的第二电离能(填“>”或“=”或“<”)。
(2) 中阴离子的空间构型为
中阴离子的空间构型为___________ 。
(3)1979年,法国Armand等报道了聚氧化乙烯( )碱金属盐络合物可用作锂离子电池固体聚合物电解质。聚氧化乙烯中O的
)碱金属盐络合物可用作锂离子电池固体聚合物电解质。聚氧化乙烯中O的___________ 杂化轨道与C的 杂化轨道成键;因氢键的形成,聚氧化乙烯是一种水溶性聚合物,若水分子之间形成的氢键可以表示为
杂化轨道成键;因氢键的形成,聚氧化乙烯是一种水溶性聚合物,若水分子之间形成的氢键可以表示为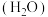
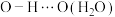 ,请写出使聚氧化乙烯具有水溶性的氢键的表示式
,请写出使聚氧化乙烯具有水溶性的氢键的表示式___________ 。
(4)过渡金属配合物常满足“18电子规则”,即中心原子的价电子数加上配体提供的电子数之和等于18,如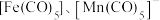 等都满足这个规则。钒配合物
等都满足这个规则。钒配合物 的熔点为
的熔点为 ,其晶体类型为:
,其晶体类型为:___________ ;已知该化合物满足18电子规则,其配体“ ”中的大
”中的大 键可表示为
键可表示为___________ 。(已知苯中的大 键表示为:
键表示为: )
)
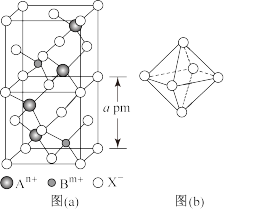
(5)图(a)为一种由阳离子 和阴离子
和阴离子 组成的无机固体电解质的晶胞结构。用A、B、X表示出这种电解质的化学式为
组成的无机固体电解质的晶胞结构。用A、B、X表示出这种电解质的化学式为___________ ,
___________ 。 堆积形成了正八面体和正四面体两种空隙,阳离子占据的空隙类型为
堆积形成了正八面体和正四面体两种空隙,阳离子占据的空隙类型为___________ ,占有率为___________ 。图(b)为 堆积形成的正八面体,其边长为
堆积形成的正八面体,其边长为___________  。(用含a的式子表示)
。(用含a的式子表示)
(1)固体电解质中研究得最多的是
 和O等的导体。
和O等的导体。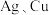 在元素周期表中位于同一族且
在元素周期表中位于同一族且 在
在 的下一周期,具有类似的价层电子排布式,
的下一周期,具有类似的价层电子排布式, 的价层电子排布式为
的价层电子排布式为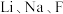 和O的电负性从小到大的顺序为
和O的电负性从小到大的顺序为(2)
 中阴离子的空间构型为
中阴离子的空间构型为(3)1979年,法国Armand等报道了聚氧化乙烯(
 )碱金属盐络合物可用作锂离子电池固体聚合物电解质。聚氧化乙烯中O的
)碱金属盐络合物可用作锂离子电池固体聚合物电解质。聚氧化乙烯中O的 杂化轨道成键;因氢键的形成,聚氧化乙烯是一种水溶性聚合物,若水分子之间形成的氢键可以表示为
杂化轨道成键;因氢键的形成,聚氧化乙烯是一种水溶性聚合物,若水分子之间形成的氢键可以表示为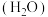
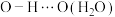 ,请写出使聚氧化乙烯具有水溶性的氢键的表示式
,请写出使聚氧化乙烯具有水溶性的氢键的表示式(4)过渡金属配合物常满足“18电子规则”,即中心原子的价电子数加上配体提供的电子数之和等于18,如
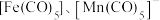 等都满足这个规则。钒配合物
等都满足这个规则。钒配合物 的熔点为
的熔点为 ,其晶体类型为:
,其晶体类型为: ”中的大
”中的大 键可表示为
键可表示为 键表示为:
键表示为: )
)(5)图(a)为一种由阳离子
 和阴离子
和阴离子 组成的无机固体电解质的晶胞结构。用A、B、X表示出这种电解质的化学式为
组成的无机固体电解质的晶胞结构。用A、B、X表示出这种电解质的化学式为
 堆积形成了正八面体和正四面体两种空隙,阳离子占据的空隙类型为
堆积形成了正八面体和正四面体两种空隙,阳离子占据的空隙类型为 堆积形成的正八面体,其边长为
堆积形成的正八面体,其边长为 。(用含a的式子表示)
。(用含a的式子表示)
您最近一年使用:0次
名校
10 . 锂电池的电解液是目前研究的热点。
(1)锂电池的电解液可采用溶有 的碳酸酯类有机溶液。
的碳酸酯类有机溶液。
①基态 的电子云轮廓图的形状为
的电子云轮廓图的形状为_______ 。
②基态P原子的价层电子轨道表示式为_______ 。
(2)为提高锂电池的安全性,科研人员采用离子液体作电解液。某种离子液体的阳离子的结构简式如下,阴离子为 。
。_______ 。
②该阳离子中,带“*”的C原子的杂化轨道类型为_______ 杂化。
③根据VSEPR模型, 的中心原子上的价层电子对数为
的中心原子上的价层电子对数为_______ ,空间结构为正八面体形。
(3) 因其良好的锂离子传输性能可作锂电池的固体电解质,其晶胞结构示意图如图所示,晶胞的边长为
因其良好的锂离子传输性能可作锂电池的固体电解质,其晶胞结构示意图如图所示,晶胞的边长为 。
。_______ (填“ ”或“
”或“ ”)。
”)。
②距离 最近的
最近的 有
有_______ 个。
③已知 的摩尔质量是
的摩尔质量是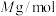 ,阿伏伽德罗常数为
,阿伏伽德罗常数为 。该晶体的密度为
。该晶体的密度为_______  。
。
(1)锂电池的电解液可采用溶有
 的碳酸酯类有机溶液。
的碳酸酯类有机溶液。①基态
 的电子云轮廓图的形状为
的电子云轮廓图的形状为②基态P原子的价层电子轨道表示式为
(2)为提高锂电池的安全性,科研人员采用离子液体作电解液。某种离子液体的阳离子的结构简式如下,阴离子为
 。
。
②该阳离子中,带“*”的C原子的杂化轨道类型为
③根据VSEPR模型,
 的中心原子上的价层电子对数为
的中心原子上的价层电子对数为(3)
 因其良好的锂离子传输性能可作锂电池的固体电解质,其晶胞结构示意图如图所示,晶胞的边长为
因其良好的锂离子传输性能可作锂电池的固体电解质,其晶胞结构示意图如图所示,晶胞的边长为 。
。
 ”或“
”或“ ”)。
”)。②距离
 最近的
最近的 有
有③已知
 的摩尔质量是
的摩尔质量是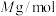 ,阿伏伽德罗常数为
,阿伏伽德罗常数为 。该晶体的密度为
。该晶体的密度为 。
。
您最近一年使用:0次
2024-01-20更新
|
252次组卷
|
3卷引用:2024届四川省绵阳市东辰中学高三下学期模拟考试(一)理科综合试题-高中化学



