2023高三·全国·专题练习
1 . 我国科学家使用了新的铝铍埋藏测年法测量北京猿人的生存年代。这种方法的测量对象是石英(二氧化硅),它是砂石的主要成分。当宇宙射线打到地面时,会将石英中的硅原子和氧原子打破,生成铝和铍的同位素。只要测出一块石头中26Al和10Be的含量,就能推算出它被埋入地下的时间。完成下列填空:
(1)画出Be的核外价电子排布轨道式___________ 。Be所在的周期中,最外层有2个未成对电子的元素的符号是___________ 、___________ 。
(2)写出Al的最外层电子排布式___________ 。铝原子核外有___________ 种运动状态不同的电子;铝原子核外有___________ 种能量不同的电子。有一种与26Al中子数相同的硅的核素,写出该核素符号___________ ,该硅电负性___________ (填“大于”或“小于”)Al 。
(3)比较Al3+、S2-和Cl-半径由大到小的顺序___________ ;这3种元素最高价氧化物对应的水化物中酸性最强的是___________ (写化学式)。
(4)铝单质在氧气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:___________ 。
(1)画出Be的核外价电子排布轨道式
(2)写出Al的最外层电子排布式
(3)比较Al3+、S2-和Cl-半径由大到小的顺序
(4)铝单质在氧气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:
您最近一年使用:0次
名校
解题方法
2 . X、Q、Y、Z、W、M、R、T是原子半径依次增大的前四周期元素,基态R原子核外电子有9种空间运动状态,并有2个单电子;基态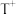 的d轨道半充满。由上述元素中的六种组成的一种化合物常作为“相转移催化剂”被广泛应用于有机合成中,其结构简式如图Ⅰ所示。
的d轨道半充满。由上述元素中的六种组成的一种化合物常作为“相转移催化剂”被广泛应用于有机合成中,其结构简式如图Ⅰ所示。
(1)基态R原子的价电子排布式为_______ 的,第一电离能小于R的同周期元素有_______ 种。
(2) 的结构如图Ⅱ所示,分子中存在大
的结构如图Ⅱ所示,分子中存在大 键
键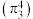 ,比较键长:①
,比较键长:①_______ ②(填“>”“<”或“=”),理由是_______ 。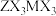 分子中M原子的杂化方式为
分子中M原子的杂化方式为_______ ,熔点比
_______ (填“高”或“低”); 中T的化合价为
中T的化合价为 ,且含有4个
,且含有4个 价的Y,则该分子中
价的Y,则该分子中 键与
键与 键的个数比为
键的个数比为_______ 。
(4)53号元素A的电负性与W近似相等,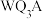 水解反应的产物为
水解反应的产物为_______ 。
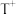 的d轨道半充满。由上述元素中的六种组成的一种化合物常作为“相转移催化剂”被广泛应用于有机合成中,其结构简式如图Ⅰ所示。
的d轨道半充满。由上述元素中的六种组成的一种化合物常作为“相转移催化剂”被广泛应用于有机合成中,其结构简式如图Ⅰ所示。
(1)基态R原子的价电子排布式为
(2)
 的结构如图Ⅱ所示,分子中存在大
的结构如图Ⅱ所示,分子中存在大 键
键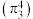 ,比较键长:①
,比较键长:①
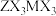 分子中M原子的杂化方式为
分子中M原子的杂化方式为
 中T的化合价为
中T的化合价为 ,且含有4个
,且含有4个 价的Y,则该分子中
价的Y,则该分子中 键与
键与 键的个数比为
键的个数比为(4)53号元素A的电负性与W近似相等,
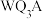 水解反应的产物为
水解反应的产物为
您最近一年使用:0次
2023-12-03更新
|
321次组卷
|
3卷引用:2024届山东省临沂市高三11月教学质量检测考试 化学
2024届山东省临沂市高三11月教学质量检测考试 化学(已下线)通关练06 元素位-构-性推断-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)四川省宜宾市叙州区第一中学校2023-2024学年高二上学期12月月考化学试题
3 . 2023年8月1日起,我国对镓(Ga)等相关物项实施出口管制。Ga与B、Al处于同一主族。请回答:
(1)基态Ga原子的价电子排布图:___________ ;
(2)①硼的氢化物叫硼烷( )。如
)。如 (乙硼烷-6)、
(乙硼烷-6)、 (丁硼烷-10)等。下列说法
(丁硼烷-10)等。下列说法不正确 的是___________ ;
A.B原子由 需吸收能量
需吸收能量
D. 与
与 反应生成
反应生成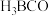 ,
,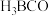 分子中
分子中 键与
键与 键数目之比为:
键数目之比为:
②氮和硼形成的化合的BN,与 互为等电子体,通常存在石墨型与金刚石型两种结构,可发生如下转化:
互为等电子体,通常存在石墨型与金刚石型两种结构,可发生如下转化: 。两类化合物中B原子的杂化方式分别为:
。两类化合物中B原子的杂化方式分别为:___________ ;金刚石型的BN的硬度大于金刚石,原因是___________ ;
③ 极易发生水解生成
极易发生水解生成 和
和 ,请写出反应的化学方程式:
,请写出反应的化学方程式:___________ ;
(3)Ga与N形成的化合物是一种重要的半导体材料,晶体的部分结构如图。___________ ;
②下列所示为图1所对应晶胞的是:___________ 。
(1)基态Ga原子的价电子排布图:
(2)①硼的氢化物叫硼烷(
 )。如
)。如 (乙硼烷-6)、
(乙硼烷-6)、 (丁硼烷-10)等。下列说法
(丁硼烷-10)等。下列说法A.B原子由
 需吸收能量
需吸收能量B. 的结构式:
的结构式:

D.
 与
与 反应生成
反应生成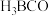 ,
,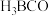 分子中
分子中 键与
键与 键数目之比为:
键数目之比为:
②氮和硼形成的化合的BN,与
 互为等电子体,通常存在石墨型与金刚石型两种结构,可发生如下转化:
互为等电子体,通常存在石墨型与金刚石型两种结构,可发生如下转化: 。两类化合物中B原子的杂化方式分别为:
。两类化合物中B原子的杂化方式分别为:③
 极易发生水解生成
极易发生水解生成 和
和 ,请写出反应的化学方程式:
,请写出反应的化学方程式:(3)Ga与N形成的化合物是一种重要的半导体材料,晶体的部分结构如图。
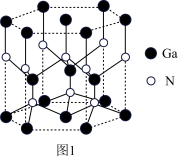
②下列所示为图1所对应晶胞的是:
A. B.
B. C.
C. D.
D.
您最近一年使用:0次
2023-11-10更新
|
833次组卷
|
5卷引用:热点25 物质结构与性质综合题
(已下线)热点25 物质结构与性质综合题浙江省温州市普通高中2024届高三上学期第一次适应性考试(一模)化学试题(已下线)专题04 物质结构与性质(2大题型)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)(已下线)压轴题10 物质结构与性质综合题(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)浙江省部分学校2024届高三下学期模拟考试化学试卷
2023高三·全国·专题练习
4 . 氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
(1)H、B、N中,原子半径最大的是_______ 。根据对角线规则,B的一些化学性质与元素_______ 的相似。
(2)NH3BH3分子中,N—B化学键称为_______ 键,其电子对由_______ 提供。氨硼烷在催化剂作用下水解释放氢气:3NH3BH3+6H2O=3NH +B3O
+B3O +9H2。B3O
+9H2。B3O 的结构为
的结构为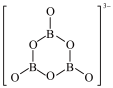 。在该反应中,B原子的杂化轨道类型由
。在该反应中,B原子的杂化轨道类型由_______ 变为_______ 。
(3)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是_______ 。
(4)研究发现,氨硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为a pm、b pm、c pm,α=β=γ=90°。氨硼烷的2×2×2超晶胞结构如图所示。
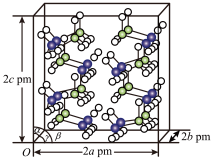
氨硼烷晶体的密度ρ=_______ g·cm-3(列出计算式,设NA为阿伏加德罗常数的值)。
(1)H、B、N中,原子半径最大的是
(2)NH3BH3分子中,N—B化学键称为
 +B3O
+B3O +9H2。B3O
+9H2。B3O 的结构为
的结构为 。在该反应中,B原子的杂化轨道类型由
。在该反应中,B原子的杂化轨道类型由(3)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是
(4)研究发现,氨硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为a pm、b pm、c pm,α=β=γ=90°。氨硼烷的2×2×2超晶胞结构如图所示。

氨硼烷晶体的密度ρ=
您最近一年使用:0次
解题方法
5 . 元素周期表中ⅡA族包括铍、镁、钙、锶、钡、镭6种元素,这些金属又称为碱土金属,原因是钙、锶、钡的氧化物性质介于“碱性的”碱金属氧化物和“土性的”氧化铝之间。回答下列问题:
(1)锶 位于第五周期,其核外电子排布式为
位于第五周期,其核外电子排布式为_______ ,有_______ 种空间运动状态不同的电子。
(2)叶绿素中含有镁,镁对植物的光合作用至关重要;一种卟啉配合物叶绿素的结构示意图(图中R为长链有机基团),则该配合物的中心微粒为_______ (填微粒符号),碳原子的杂化方式为_______ ,所含元素C、H、O、N的电负性由大到小的顺序为_______ 。

(3)碱土金属氯化物中 的熔点低于
的熔点低于 ,原因为
,原因为_______ , 的空间构型为
的空间构型为_______ 。
(4)钙是组成动物牙齿和骨骼的重要成分,其重要的氧化物 的晶胞结构如图所示,与
的晶胞结构如图所示,与 距离最近且相等的
距离最近且相等的 有
有_______ 个; 位于
位于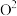 构成的
构成的_______ 体的中心,该晶胞若沿体对角线投影,则 的投影图为
的投影图为_______ (填字母选项)

A. B.
B.
C. D.
D.
(1)锶
 位于第五周期,其核外电子排布式为
位于第五周期,其核外电子排布式为(2)叶绿素中含有镁,镁对植物的光合作用至关重要;一种卟啉配合物叶绿素的结构示意图(图中R为长链有机基团),则该配合物的中心微粒为

(3)碱土金属氯化物中
 的熔点低于
的熔点低于 ,原因为
,原因为 的空间构型为
的空间构型为(4)钙是组成动物牙齿和骨骼的重要成分,其重要的氧化物
 的晶胞结构如图所示,与
的晶胞结构如图所示,与 距离最近且相等的
距离最近且相等的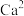 有
有 位于
位于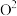 构成的
构成的 的投影图为
的投影图为
A.
 B.
B.
C.
 D.
D.
您最近一年使用:0次
真题
解题方法
6 . 三氯甲硅烷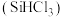 是制取高纯硅的重要原料,常温下为无色液体,沸点为
是制取高纯硅的重要原料,常温下为无色液体,沸点为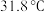 ,熔点为
,熔点为 ,易水解。实验室根据反应
,易水解。实验室根据反应 ,利用如下装置制备
,利用如下装置制备 粗品(加热及夹持装置略)。回答下列问题:
粗品(加热及夹持装置略)。回答下列问题:
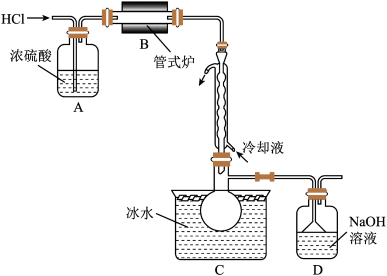
(1)制备 时进行操作:(ⅰ)……;(ⅱ)将盛有硅粉的瓷舟置于管式炉中;(ⅲ)通入
时进行操作:(ⅰ)……;(ⅱ)将盛有硅粉的瓷舟置于管式炉中;(ⅲ)通入 ,一段时间后接通冷凝装置,加热开始反应。操作(ⅰ)为
,一段时间后接通冷凝装置,加热开始反应。操作(ⅰ)为_____ ;判断制备反应结束的实验现象是_____ 。图示装置存在的两处缺陷是_____ 。
(2)已知电负性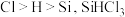 在浓
在浓 溶液中发生反应的化学方程式为
溶液中发生反应的化学方程式为_____ 。
(3)采用如下方法测定溶有少量 的
的 纯度。
纯度。
 样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:①
样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:①_____ ,②_____ (填操作名称),③称量等操作,测得所得固体氧化物质量为 ,从下列仪器中选出①、②中需使用的仪器,依次为
,从下列仪器中选出①、②中需使用的仪器,依次为_____ (填标号)。测得样品纯度为_____ (用含 、
、 的代数式表示)。
的代数式表示)。

 是制取高纯硅的重要原料,常温下为无色液体,沸点为
是制取高纯硅的重要原料,常温下为无色液体,沸点为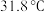 ,熔点为
,熔点为 ,易水解。实验室根据反应
,易水解。实验室根据反应 ,利用如下装置制备
,利用如下装置制备 粗品(加热及夹持装置略)。回答下列问题:
粗品(加热及夹持装置略)。回答下列问题:
(1)制备
 时进行操作:(ⅰ)……;(ⅱ)将盛有硅粉的瓷舟置于管式炉中;(ⅲ)通入
时进行操作:(ⅰ)……;(ⅱ)将盛有硅粉的瓷舟置于管式炉中;(ⅲ)通入 ,一段时间后接通冷凝装置,加热开始反应。操作(ⅰ)为
,一段时间后接通冷凝装置,加热开始反应。操作(ⅰ)为(2)已知电负性
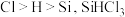 在浓
在浓 溶液中发生反应的化学方程式为
溶液中发生反应的化学方程式为(3)采用如下方法测定溶有少量
 的
的 纯度。
纯度。 样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:①
样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:① ,从下列仪器中选出①、②中需使用的仪器,依次为
,从下列仪器中选出①、②中需使用的仪器,依次为 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2023-06-19更新
|
11036次组卷
|
16卷引用:专题19 实验综合题
(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)考点12 硅及其无机非金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第10讲 硅及其化合物(已下线)T26-工业流程题(已下线)专题15 化学实验综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点13 硅及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点46 定量分析实验(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)题型17 化学实验综合-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)2024届河北省实验中学高三年级上学期第一次月考化学试题2023年高考山东卷化学真题(已下线)2023年高考山东卷化学真题变式题(实验综合题)(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)
名校
7 . A、B、C、D、E、F均为周期表中前四周期的元素,且原子序数依次增大。请按要求回答下列问题。
(1)A与氢元素形成的两种化合物AH3、A2H4是弱碱,比较下表中两种化合物的熔沸点,解释其高低的主要原因_______ 。
(2)量子力学把电子在原子核外的一个空间运动状态称为一个_______ ,电子除空间运动状态外,还有一种运动状态叫做_______ 。B是地壳中含量最高的元素,B基态原子的电子空间运动状态有_______ 种。
(3)已知C和D为第三周期元素,其原子的第一至第四电离能如下表所示:
下列有关C、D的叙述正确的是_______ 。
a.离子半径C<D
b.电负性C<D
c.单质的熔点C>D
d.C、D的单质均能与氧化物发生置换
e.C的氧化物具有两性
f.C、D均能与氯元素构成离子晶体
(4)已知金属E原子核外的电子运动状态有22种,其外围电子轨道表示式为_______ ,E的晶胞是六方最密堆积结构(如图1),E原子的配位数为_______ ;若E的相对原子质量为M,E原子半径为rcm。该晶胞的空间利用率为_______ (用含r、h的代数式表达,可以不必化简)。_______ (填“是”或否”),该立方体是不是F3B4的晶胞_______ (填“是”或“否”)。
(1)A与氢元素形成的两种化合物AH3、A2H4是弱碱,比较下表中两种化合物的熔沸点,解释其高低的主要原因
| A2H4 | AH3 | |
| 熔点/°C | 2 | -77.8 |
| 沸点/°C | 113.5 | -33.5 |
(3)已知C和D为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| C(或D) | 578 | 1817 | 2745 | 11578 |
| C(或D) | 738 | 1451 | 7733 | 10540 |
a.离子半径C<D
b.电负性C<D
c.单质的熔点C>D
d.C、D的单质均能与氧化物发生置换
e.C的氧化物具有两性
f.C、D均能与氯元素构成离子晶体
(4)已知金属E原子核外的电子运动状态有22种,其外围电子轨道表示式为


您最近一年使用:0次
2023-06-10更新
|
426次组卷
|
3卷引用:四川省成都市第七中学2023届高三下学期热身考试理科综合化学试题
8 . 硒(Se)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(AIE)效应以来,AIE在发光材料、生物医学等领域引起广泛关注。一种含Se的新型AIE分子Ⅳ的合成路线如图:
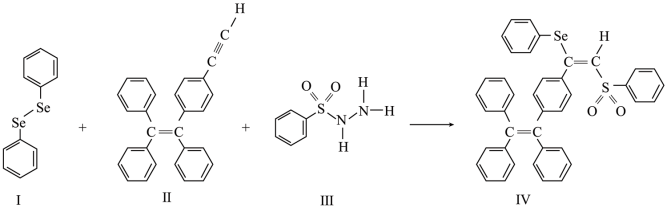
回答下列问题:
(1)Se与S同族,基态硒原子价电子排布式为_____ 。
(2)H2Se的沸点低于H2O,其原因是_____ 。
(3)关于I~Ⅲ三种反应物,下列说法正确的有_____ (填字母)。
A.I中仅有σ键
B.I中的Se-Se键为非极性共价键
C.Ⅱ易溶于水
D.Ⅱ中碳原子的杂化轨道类型只有sp与sp2
E.I~Ⅲ含有的元素中,O电负性最大
(4)Ⅳ中具有孤对电子的原子有_____ (填元素符号)。
(5)硒的两种含氧酸的酸性强弱为H2SeO4_____ H2SeO3(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(Na2SeO4)可减轻重金属铊引起的中毒。SeO 的立体构型为
的立体构型为_____ 。
(6)钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:
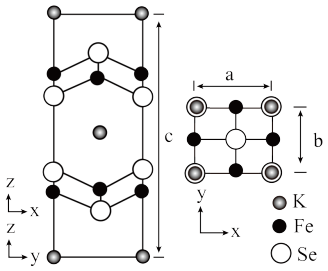
①该超导材料的最简化学式为_____ 。
②Fe原子的配位数为_____ 。
③该晶胞参数a=b=0.4nm、c=1.4nm。阿伏加德罗常数的值为NA,则该晶体的密度为_____ g•cm-3(列出计算式)。

回答下列问题:
(1)Se与S同族,基态硒原子价电子排布式为
(2)H2Se的沸点低于H2O,其原因是
(3)关于I~Ⅲ三种反应物,下列说法正确的有
A.I中仅有σ键
B.I中的Se-Se键为非极性共价键
C.Ⅱ易溶于水
D.Ⅱ中碳原子的杂化轨道类型只有sp与sp2
E.I~Ⅲ含有的元素中,O电负性最大
(4)Ⅳ中具有孤对电子的原子有
(5)硒的两种含氧酸的酸性强弱为H2SeO4
 的立体构型为
的立体构型为(6)钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:

①该超导材料的最简化学式为
②Fe原子的配位数为
③该晶胞参数a=b=0.4nm、c=1.4nm。阿伏加德罗常数的值为NA,则该晶体的密度为
您最近一年使用:0次
解题方法
9 . 一种新型硫酸盐功能电解液由2mol·L-1Na2SO4和0.3mol·L-1MgSO4混合组成,电化学测试表明该电解液构建的Na2Ni[Fe(CN)6]、NaTi2(PO4)3/C电池可以稳定循环500次以上。
请回答下列问题:
(1)MgSO4中三种原子的半径由大到小的顺序是___________ (用元素符号表示),其中电负性最大的元素是___________ (填名称)。
(2)第一电离能N>O的原因是___________ 。
(3)Na2Ni[Fe(CN)6]中,基态Fe2+核外电子的空间运动状态有___________ 种,[Fe(CN)6]4-中σ键和π键的数目之比为___________ 。
(4)NaTi2(PO4)3中, 中磷原子的杂化类型是
中磷原子的杂化类型是___________ 。
(5)N、O两种元素形成的简单氢化物的熔点:NH3___________ H2O(填“>”“<”或“=”),其原因是___________ 。
(6)NiaMgbFec的立方晶胞结构如图所示。已知晶胞的边长为npm,设NA为阿伏加德罗常数的值。

①a:b:c=___________ 。
②该晶体密度是___________ g·cm-3(用含n、NA的代数式表示)。
请回答下列问题:
(1)MgSO4中三种原子的半径由大到小的顺序是
(2)第一电离能N>O的原因是
(3)Na2Ni[Fe(CN)6]中,基态Fe2+核外电子的空间运动状态有
(4)NaTi2(PO4)3中,
 中磷原子的杂化类型是
中磷原子的杂化类型是(5)N、O两种元素形成的简单氢化物的熔点:NH3
(6)NiaMgbFec的立方晶胞结构如图所示。已知晶胞的边长为npm,设NA为阿伏加德罗常数的值。

①a:b:c=
②该晶体密度是
您最近一年使用:0次
2023-04-26更新
|
280次组卷
|
3卷引用:河南省名校大联考2023届高三下学期三模考试理综化学试题
河南省名校大联考2023届高三下学期三模考试理综化学试题(已下线)专题16 物质结构与性质综合题-2023年高考化学真题题源解密(全国通用)新疆疏附县第一中学2023-2024学年高三上学期开学摸底测试化学试题
2023高三·全国·专题练习
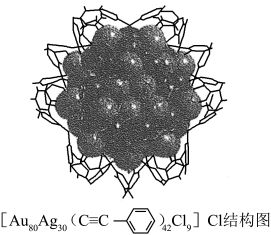
10 . 腐蚀、防腐以及催化等化学化工过程都涉及金属纳米团簇的研究,团簇已经成为化学和材料研究的前沿和热点。金属纳米团簇最外层需要配体来稳定,常见有硫醇配体、磷配体和炔配体。卤素作为第二配体或第三配体,其体积比硫醇配体、磷配体和炔配体更小,在形成纳米团簇的过程中空间位阻更小,而且卤素与金、银具有较好的配位能力。
(1)银位于元素周期表第五周期第ⅠB族元素,其价电子排布式为______ 。
(2)金(Au)溶于王水的原理是金与强氧化性的硝酸生成微量的Au3+和NO,盐酸提供的Cl-与Au3+形成[AuCl4]-配离子,写出总反应的离子方程式:______ 。
(3)[Au80Ag30(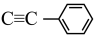 )42Cl9]Cl结构中非金属元素的电负性由大到小的顺序是
)42Cl9]Cl结构中非金属元素的电负性由大到小的顺序是______ 。
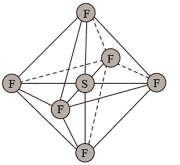
(4)第三周期部分主族元素的氟化物的熔点(见表)。
由表中数值可以判断AlF3晶体类型为_______ ,SiF4比SF6熔点低的原因______ ;SF6分子的空间构型为正八面体,如图所示,该分子的键角分别为______ ,它的二氯代物SF4Cl2有______ 种。
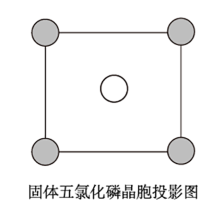
(5)固态五氯化磷为离子晶体,结构单元可以写作PCl 、PCl
、PCl ,晶胞与CsCl相同,该晶胞沿x、y或z轴的投影如图。阳离子中的P杂化方式为:
,晶胞与CsCl相同,该晶胞沿x、y或z轴的投影如图。阳离子中的P杂化方式为:______ ,若密度为dg/cm3,则晶胞参数a=_______ cm(已知阿伏加德罗常数的值为NA,列出计算式即可)
(1)银位于元素周期表第五周期第ⅠB族元素,其价电子排布式为
(2)金(Au)溶于王水的原理是金与强氧化性的硝酸生成微量的Au3+和NO,盐酸提供的Cl-与Au3+形成[AuCl4]-配离子,写出总反应的离子方程式:
(3)[Au80Ag30(
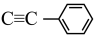 )42Cl9]Cl结构中非金属元素的电负性由大到小的顺序是
)42Cl9]Cl结构中非金属元素的电负性由大到小的顺序是
(4)第三周期部分主族元素的氟化物的熔点(见表)。
| 化合物 | NaF | AlF3 | SiF4 | SF6 |
| 熔点/℃ | 993 | 1040 | -90 | -50.5 |

(5)固态五氯化磷为离子晶体,结构单元可以写作PCl
 、PCl
、PCl ,晶胞与CsCl相同,该晶胞沿x、y或z轴的投影如图。阳离子中的P杂化方式为:
,晶胞与CsCl相同,该晶胞沿x、y或z轴的投影如图。阳离子中的P杂化方式为:
您最近一年使用:0次



