名校
解题方法
1 . 有机物K合成路线如下图 (部分条件已省略)。

已知:
①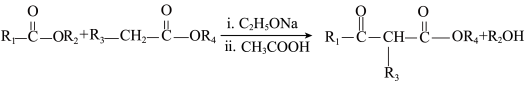
②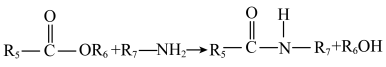 (
( 表示烃基)。
表示烃基)。
请回答下列问题。
(1)K的分子式为_______ 。
(2)A中官能团的名称是_______ ,G→H的反应类型是_______ 。
(3)B→D的化学方程式为_______ 。
(4)F→G中NaOH的作用是_______ 。
(5)D+H→J中形成酰胺键。在有机合成中常用酯基和 生成酰胺基,而不是用羧基和
生成酰胺基,而不是用羧基和 直接反应生成酰胺基,请结合元素电负性和键的极性解释原因:
直接反应生成酰胺基,请结合元素电负性和键的极性解释原因:_______ 。(元素电负性:H-2.1 C-2.5 O-3.5)
(6)由J生成K可以看作三步反应,如下图所示。

①P中有两个六元环结构。P的结构简式为_______ 。
②Q和K是互变异构关系,K比Q稳定的原因是_______ 。
(7)X是D的同分异构体,符合下列条件的X的结构简式是_______ 。
a.1molX能与足量银氨溶液反应生成4molAg
b.X中核磁共振氢谱中出现3组吸收峰,峰面积比为1:1:3

已知:
①
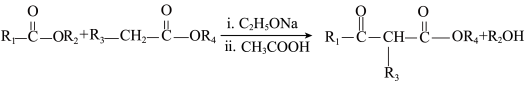
②
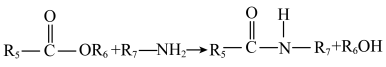 (
( 表示烃基)。
表示烃基)。请回答下列问题。
(1)K的分子式为
(2)A中官能团的名称是
(3)B→D的化学方程式为
(4)F→G中NaOH的作用是
(5)D+H→J中形成酰胺键。在有机合成中常用酯基和
 生成酰胺基,而不是用羧基和
生成酰胺基,而不是用羧基和 直接反应生成酰胺基,请结合元素电负性和键的极性解释原因:
直接反应生成酰胺基,请结合元素电负性和键的极性解释原因:(6)由J生成K可以看作三步反应,如下图所示。

①P中有两个六元环结构。P的结构简式为
②Q和K是互变异构关系,K比Q稳定的原因是
(7)X是D的同分异构体,符合下列条件的X的结构简式是
a.1molX能与足量银氨溶液反应生成4molAg
b.X中核磁共振氢谱中出现3组吸收峰,峰面积比为1:1:3
您最近一年使用:0次
名校
解题方法
2 . 我国的航空航天事业取得了举世瞩目的成就,近年来硼氢类离子液体作为火箭推进剂燃料得到了广泛使用。硼氢类离子液体的合成如图所示:
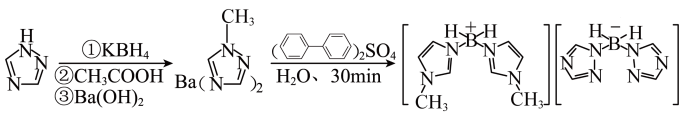
回答下列问题:
(1)基态K原子核外电子的空间运动状态有___________ 种。
(2)C、O、N的第一电离能由大到小的顺序为___________ (用元素符号表示)。
(3) 中,
中, 的空间构型为
的空间构型为___________ 。
(4)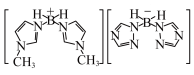 中
中不存在 的作用力有___________ (填字母)。
a.离子键 b.配位键 c. 键 d.
键 d. 键 e.金属键 f.氢键
键 e.金属键 f.氢键
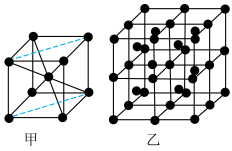
(5)Ba的一种晶体如甲、乙所示,若按甲虚线方向切乙,所得剖面图正确的是___________(填字母标号)。
(6)硼化钙晶胞结构如图所示,B原子构成B6八面体,各个顶点通过B-B键互相连接成三维骨架,八个B6多面体围成立方体,中心为Ca2+,晶胞密度为ρg·cm-3。
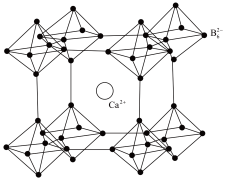
①硼化钙的化学式为___________ 。
②晶胞边长为___________ nm(已知NA为阿伏加德罗常数)。

回答下列问题:
(1)基态K原子核外电子的空间运动状态有
(2)C、O、N的第一电离能由大到小的顺序为
(3)
 中,
中, 的空间构型为
的空间构型为(4)
 中
中a.离子键 b.配位键 c.
 键 d.
键 d. 键 e.金属键 f.氢键
键 e.金属键 f.氢键(5)Ba的一种晶体如甲、乙所示,若按甲虚线方向切乙,所得剖面图正确的是___________(填字母标号)。

A.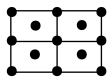 | B.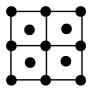 | C.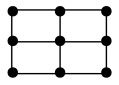 | D. |
(6)硼化钙晶胞结构如图所示,B原子构成B6八面体,各个顶点通过B-B键互相连接成三维骨架,八个B6多面体围成立方体,中心为Ca2+,晶胞密度为ρg·cm-3。

①硼化钙的化学式为
②晶胞边长为
您最近一年使用:0次
解题方法
3 . 化合物F是一种重要的有机合成中间体,某研究小组按下列路线进行合成:
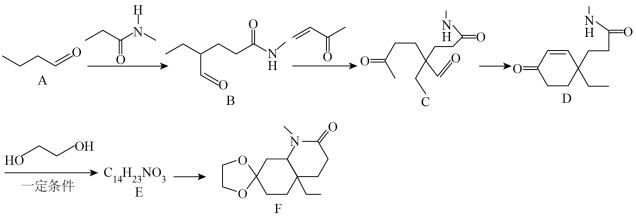
已知: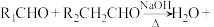
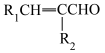
请回答下列问题:
(1)有机物B所含的官能团名称是___________ ,B→C的反应类型为___________ 。
(2)化合物E的结构简式是___________ 。
(3)写出D→E的化学方程式:___________ 。
(4)1分子有机物F分子中含有的手性碳原子数为___________ 。
(5)上述流程涉及的非金属元素中,电负性由大到小的顺序为___________ ,第一电离能最大的为___________ (填元素符号)。
(6)有机物H是D的同分异构体,写出符合下列条件的H的结构简式:___________ (任写一种)。
①IR谱检测表明:分子中含有一个苯环,有 键,无
键,无 、
、 键。
键。
② 谱检测表明:分子中共有5种不同化学环境的氢原子。
谱检测表明:分子中共有5种不同化学环境的氢原子。
③仅含有两种官能团,其中一种为 ,且氨基与苯环直接相连。
,且氨基与苯环直接相连。

已知:
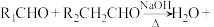
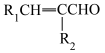
请回答下列问题:
(1)有机物B所含的官能团名称是
(2)化合物E的结构简式是
(3)写出D→E的化学方程式:
(4)1分子有机物F分子中含有的手性碳原子数为
(5)上述流程涉及的非金属元素中,电负性由大到小的顺序为
(6)有机物H是D的同分异构体,写出符合下列条件的H的结构简式:
①IR谱检测表明:分子中含有一个苯环,有
 键,无
键,无 、
、 键。
键。②
 谱检测表明:分子中共有5种不同化学环境的氢原子。
谱检测表明:分子中共有5种不同化学环境的氢原子。③仅含有两种官能团,其中一种为
 ,且氨基与苯环直接相连。
,且氨基与苯环直接相连。
您最近一年使用:0次
4 . 西北工业大学曾华强课题组借用足球烯核心,成功实现了高效且选择性可精准定制的离子跨膜运输,如图甲所示。
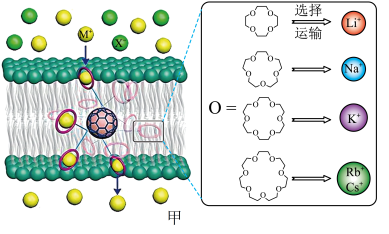
已知:图甲中的有机物为“冠醚”,命名规则是“环上原子个数-冠醚-氧原子个数”。
请回答下列问题:
(1)基态Cs原子的价层电子排布式为___________ 。基态K原子的核外电子云有___________ 个伸展方向。
(2)运输Cs+的冠醚名称是___________ 。冠醚分子中氧原子的杂化类型是___________ ,冠醚与碱金属离子之间存在微弱的配位键,配位原子是___________ (填元素符号)。
(3)几种冠醚与识别的碱金属离子的有关数据如下表所示:
18-冠醚-6不能识别和运输Na+和Cs+的原因是___________ 。观察图甲,冠醚不能识别和运输X-的主要原因可能是___________ 。
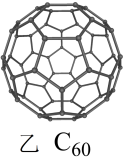
(4)足球烯的结构如图乙所示。1mol足球烯含___________ molσ键。
(5)铷晶胞为体心立方堆积,如图丙所示。
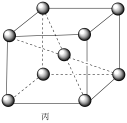
铷晶胞的原子空间利用率为___________ (用含π的式子表示)。
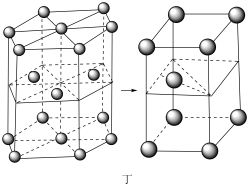
(6)锂晶胞为六方最密堆积,如图丁所示。锂晶胞中底边长为a pm,高为b pm,设NA为阿伏加德罗常数的值,则锂晶胞的密度为___________ g· cm-3(用含字母的式子表示)。

已知:图甲中的有机物为“冠醚”,命名规则是“环上原子个数-冠醚-氧原子个数”。
请回答下列问题:
(1)基态Cs原子的价层电子排布式为
(2)运输Cs+的冠醚名称是
(3)几种冠醚与识别的碱金属离子的有关数据如下表所示:
| 冠醚 | 冠醚空腔直径/pm | 适合的粒子直径/pm |
| 12冠醚- 4 | 120~ 150 | Li+ (152) |
| 15 -冠醚-5 | 170~ 220 | Na+ (204) |
| 18 -冠醚- 6 | 260~ 320 | K+ (276) |
| ___________ | 340~ 430 | Rb+ (304) |
| Cs+ (334) |
(4)足球烯的结构如图乙所示。1mol足球烯含

(5)铷晶胞为体心立方堆积,如图丙所示。

铷晶胞的原子空间利用率为
(6)锂晶胞为六方最密堆积,如图丁所示。锂晶胞中底边长为a pm,高为b pm,设NA为阿伏加德罗常数的值,则锂晶胞的密度为

您最近一年使用:0次
名校
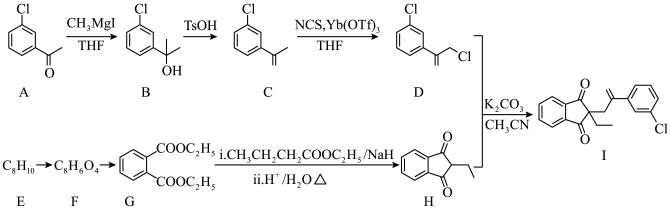
5 . 以A和芳香烃E为原料制备除草剂茚草酮中间体(Ⅰ)的合成路线如下:
(1)A中所含官能团的名称为__________ 。
(2)B→C的反应类型为__________ 。
(3)D中碳原子的杂化轨道类型有__________ ;其中,电负性最大的元素为__________ 。
(4)写出F→G的化学方程式__________ 。
(5)B的同分异构体中,满足下列条件的结构有______ 种;其中,核磁共振氢谱有四组峰,且峰面积之比为6∶2∶2∶1的结构简式为__________ 。
条件:①含有苯环;
②与 溶液发生显色反应;
溶液发生显色反应;
③含有2个甲基,且连在同一个碳原子上。
(6)利用原子示踪技术追踪G→H的反应过程:
(1)A中所含官能团的名称为
(2)B→C的反应类型为
(3)D中碳原子的杂化轨道类型有
(4)写出F→G的化学方程式
(5)B的同分异构体中,满足下列条件的结构有
条件:①含有苯环;
②与
 溶液发生显色反应;
溶液发生显色反应;③含有2个甲基,且连在同一个碳原子上。
(6)利用原子示踪技术追踪G→H的反应过程:
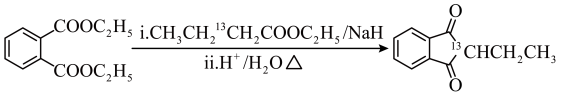
根据上述信息,写出以乙醇和 为原料合成
为原料合成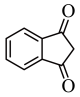 的路线(无机试剂任选)
的路线(无机试剂任选)
您最近一年使用:0次
2023-02-19更新
|
2308次组卷
|
9卷引用:重庆市南开中学校2023届高三模拟考试化学试题
重庆市南开中学校2023届高三模拟考试化学试题广东省深圳市2022-2023学年高三第一次调研考试化学试题(已下线)广东省深圳市2022-2023学年高三第一次调研考试变式题(有机综合题)(已下线)专题21 有机推断题(已下线)广东省广州市天河区2023届高三二模化学试题变式题(有机推断题)(已下线)化学-2023年高考押题预测卷02(广东卷)(含考试版、全解全析、参考答案、答题卡)湖南师范大学附属中学2024届高三上学期月考(二) 化学试题(已下线)山东省名校联盟2024届高三下学期5月模拟考试化学试题湖南师范大学附属中学2023-2024学年高三上学期月考化学试卷(二)
名校
6 . Ⅰ.全球首次在350公里时速的奥运版复兴号高铁列车上依托5G技术打造的超高清直播演播室,实现了超高清信号的长时间稳定传输。请回答下列问题:
(1)5G芯片主要材质是高纯硅。基态Si原子价层电子的运动状态有_______ 种,若其电子排布式表示为[Ne]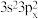 违背了
违背了_______ 。
(2)高纯硅制备过程中会有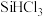 、
、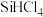 等中间产物生成。已知电负性;
等中间产物生成。已知电负性; ,则
,则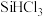 充分水解的化学方程式为
充分水解的化学方程式为_______ ,复兴号高铁车体材质用到Mn、Co等元素,Mn的一种配合物化学式为[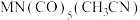 ],
], 中C原子的杂化类型为
中C原子的杂化类型为_______ 。
Ⅱ.碳及其化合物对人类的生产、生活有重大影响,一直是科技工作者的研究热点。回答下列问题:
已知:①部分化学键的键能数据如表:
②热化学反应方程及化学平衡常数如下:
反应i;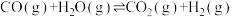
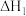
反应ii;
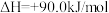
反应iii:
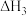
(3)则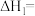
_______  ;化学平衡常数
;化学平衡常数 与
与 、
、 的关系为
的关系为_______ 。
(4)在恒温、恒压条件下,以22.4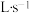 (已转化为标准状况)将CO(g)和
(已转化为标准状况)将CO(g)和 (g)的混合气体通入装有催化剂的连续反应器中发生反应:
(g)的混合气体通入装有催化剂的连续反应器中发生反应: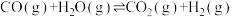 。
。
①0~5内测得CO的体积分数由25%变为20%则该时间段内用 表示的化学反应速率为
表示的化学反应速率为_______ 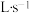 。
。
②该反应达到平衡后,若增大压强,平衡_______ 移动(填“向左”“向右”或“不”);若升高温度,CO的平衡转化率_______ (填“变大”“变小”或“不变”)。
(1)5G芯片主要材质是高纯硅。基态Si原子价层电子的运动状态有
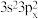 违背了
违背了(2)高纯硅制备过程中会有
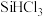 、
、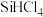 等中间产物生成。已知电负性;
等中间产物生成。已知电负性; ,则
,则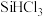 充分水解的化学方程式为
充分水解的化学方程式为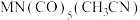 ],
], 中C原子的杂化类型为
中C原子的杂化类型为Ⅱ.碳及其化合物对人类的生产、生活有重大影响,一直是科技工作者的研究热点。回答下列问题:
已知:①部分化学键的键能数据如表:
| 化学键 | H-H | C=O | C≡O | O-H |
键能/( ) ) | 436 | 745 | 960 | 463 |
②热化学反应方程及化学平衡常数如下:
反应i;
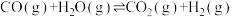
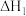
反应ii;

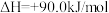
反应iii:

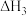
(3)则
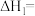
 ;化学平衡常数
;化学平衡常数 与
与 、
、 的关系为
的关系为(4)在恒温、恒压条件下,以22.4
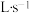 (已转化为标准状况)将CO(g)和
(已转化为标准状况)将CO(g)和 (g)的混合气体通入装有催化剂的连续反应器中发生反应:
(g)的混合气体通入装有催化剂的连续反应器中发生反应: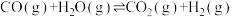 。
。①0~5内测得CO的体积分数由25%变为20%则该时间段内用
 表示的化学反应速率为
表示的化学反应速率为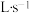 。
。②该反应达到平衡后,若增大压强,平衡
您最近一年使用:0次
名校
解题方法
7 . 为了防止枪支生锈,常将枪支的钢铁零件放在 和
和 的混合溶液中进行化学处理使钢铁零件表面生成
的混合溶液中进行化学处理使钢铁零件表面生成 的致密的保护层“发蓝”,其过程可用下列化学方程式表示:
的致密的保护层“发蓝”,其过程可用下列化学方程式表示:
①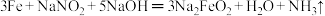 ;
;
② ;
;
③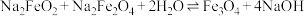 。
。
回答下列问题:
(1)基态 原子的外围电子轨道表示式为
原子的外围电子轨道表示式为___________ ,与 同周期,未成对电子数比
同周期,未成对电子数比 的未成对电子数多的元素有
的未成对电子数多的元素有___________ (填元素名称)。
(2)H、N、O元系的电负性由大到小的顺序为___________ (用元素符号表示),第二周期中比O原子的第一电离能大的元素有___________ 种。
(3)与 互为等电子体的粒子为
互为等电子体的粒子为___________ (填粒子符号,任写一种)
(4)由于d轨道处于未充满状态,铁的水合离子会具有一定的颜色,如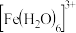 呈淡紫色。但是
呈淡紫色。但是 的水解程度严重,故强酸的铁盐溶于水得不到淡紫色
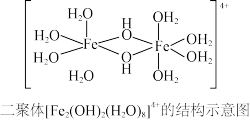
的水解程度严重,故强酸的铁盐溶于水得不到淡紫色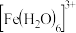 ,而是水解生成黄色的
,而是水解生成黄色的 及如图所示的二聚体。1个二聚体中含有
及如图所示的二聚体。1个二聚体中含有___________ 个 键。
键。
(5)与钠同周期的金属元素的单质熔沸点由高到低的顺序为___________ (用元素符号表示),原因为___________ 。
(6) 的晶胞结构如图甲所示,晶胞中O离子的配位数为
的晶胞结构如图甲所示,晶胞中O离子的配位数为___________ 。已知该晶胞中a原子的坐标参数为 ,b原子的坐标参数为
,b原子的坐标参数为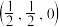 ,则c原子的坐标参数为
,则c原子的坐标参数为___________ 。

(7)铁的氧化物除了 ,还有氧化亚铁,氧化亚铁晶胞与
,还有氧化亚铁,氧化亚铁晶胞与 的相似,
的相似, 的晶胞如图乙所示。由于晶体缺陷,某氧化亚铁晶体的实际组成为
的晶胞如图乙所示。由于晶体缺陷,某氧化亚铁晶体的实际组成为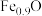 ,其中包含有
,其中包含有 和
和 ,若该晶体的密度为
,若该晶体的密度为 ,
, 表示阿伏加德罗常数的值,则晶胞边长为
表示阿伏加德罗常数的值,则晶胞边长为
___________  (用含
(用含 、
、 的代数式表示,列出计算式即可)。
的代数式表示,列出计算式即可)。
 和
和 的混合溶液中进行化学处理使钢铁零件表面生成
的混合溶液中进行化学处理使钢铁零件表面生成 的致密的保护层“发蓝”,其过程可用下列化学方程式表示:
的致密的保护层“发蓝”,其过程可用下列化学方程式表示:①
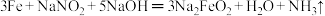 ;
;②
 ;
;③
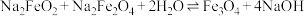 。
。 回答下列问题:
(1)基态
 原子的外围电子轨道表示式为
原子的外围电子轨道表示式为 同周期,未成对电子数比
同周期,未成对电子数比 的未成对电子数多的元素有
的未成对电子数多的元素有(2)H、N、O元系的电负性由大到小的顺序为
(3)与
 互为等电子体的粒子为
互为等电子体的粒子为(4)由于d轨道处于未充满状态,铁的水合离子会具有一定的颜色,如
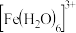 呈淡紫色。但是
呈淡紫色。但是 的水解程度严重,故强酸的铁盐溶于水得不到淡紫色
的水解程度严重,故强酸的铁盐溶于水得不到淡紫色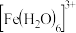 ,而是水解生成黄色的
,而是水解生成黄色的 及如图所示的二聚体。1个二聚体中含有
及如图所示的二聚体。1个二聚体中含有 键。
键。
(5)与钠同周期的金属元素的单质熔沸点由高到低的顺序为
(6)
 的晶胞结构如图甲所示,晶胞中O离子的配位数为
的晶胞结构如图甲所示,晶胞中O离子的配位数为 ,b原子的坐标参数为
,b原子的坐标参数为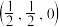 ,则c原子的坐标参数为
,则c原子的坐标参数为
(7)铁的氧化物除了
 ,还有氧化亚铁,氧化亚铁晶胞与
,还有氧化亚铁,氧化亚铁晶胞与 的相似,
的相似, 的晶胞如图乙所示。由于晶体缺陷,某氧化亚铁晶体的实际组成为
的晶胞如图乙所示。由于晶体缺陷,某氧化亚铁晶体的实际组成为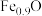 ,其中包含有
,其中包含有 和
和 ,若该晶体的密度为
,若该晶体的密度为 ,
, 表示阿伏加德罗常数的值,则晶胞边长为
表示阿伏加德罗常数的值,则晶胞边长为
 (用含
(用含 、
、 的代数式表示,列出计算式即可)。
的代数式表示,列出计算式即可)。
您最近一年使用:0次
名校
解题方法
8 . 我国科学家最近开发了α- B26C@ TiO2/Ti催化剂实现NO制NH3,为资源回收利用提供新思路。请回答下列问题:
(1)基态N原子的价层电子排布图为_______ 。
(2)上述物质中所含第二周期元素的第一电离能由大到小的顺序为_______ (填元素符号,下同),电负性由大到小的顺序为_______ 。
(3)氨硼烷(NH3·BH3)是一种具有潜力的固体储氢材料。NH3·BH3分子中属于sp3杂化的原子有_______ (填元素符号)。H—N—H键角:NH3_______ NH3·BH3(填“>”“<”或“=”),理由是_______ 。
(4)已知:BC(碳化硼)、BN(氮化硼)的熔点依次为2450℃、3000℃, BN的熔点较高的主要原因是_______ 。
(5)已知TiO2的晶胞如图1所示,“黑球”代表_______ (填“钛”或“氧")。
(6)钛晶体有两种结构,如图2和图3所示。
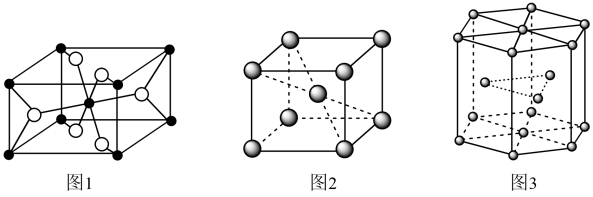
图2结构中空间利用率(φ)为_______ (用含π的代数式表示);已知图3结构中底边长为a nm,高为c nm,NA代表阿伏加德罗常数的值,则该钛晶体的密度为_______ g·cm-3(用含a、c、NA的代数式表示)。
(1)基态N原子的价层电子排布图为
(2)上述物质中所含第二周期元素的第一电离能由大到小的顺序为
(3)氨硼烷(NH3·BH3)是一种具有潜力的固体储氢材料。NH3·BH3分子中属于sp3杂化的原子有
(4)已知:BC(碳化硼)、BN(氮化硼)的熔点依次为2450℃、3000℃, BN的熔点较高的主要原因是
(5)已知TiO2的晶胞如图1所示,“黑球”代表
(6)钛晶体有两种结构,如图2和图3所示。

图2结构中空间利用率(φ)为
您最近一年使用:0次
2022-04-26更新
|
591次组卷
|
3卷引用:重庆市长寿中学校2022-2023学年高三上学期12月月考化学试题
重庆市长寿中学校2022-2023学年高三上学期12月月考化学试题安徽省河南省皖豫名校联盟体2022届高三下学期第三次考试理综化学试题(已下线)押全国卷理综第35题 物质结构与性质-备战2022年高考化学临考题号押题(课标全国卷)
名校
9 . 铁在生活中分布较广,占地壳含量的4.75%,仅次于氧、硅、铝,位居地壳含量第四位,铁及其化合物在人们生成、生活中有着广泛的应用,请按要求回答下列问题:
(1)请写出Fe原子的价层电子排布图:___________ 。
(2)早在西汉时期的《淮南万毕术》中就记载“曾青得铁则化为铜”,这是有关“湿法炼铜”的最早文献记录。若向盛装有硫酸铜水溶液的试管里加入氨水,首先生成蓝色沉淀,继续滴加氨水,得到深蓝色的透明溶液。
①请写出蓝色沉淀溶解的离子反应方程式:___________ 。
②NH3是重要的配体,NH3分子的VSEPR模型为___________ ,其中H-N-H的键角为107.3°,则[Cu(NH3)4]2+中H-N-H的键角___________ 107.3°(填“大于”“小于”或“等于”)。
(3)二茂铁又称二环戊二烯合铁,分子式为(C5H5)2Fe,是一种具有芳香族性质的有机过渡金属化合物。其结构为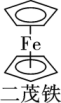 ,其制备原理可简单表示为2KOH+FeCl2+2C5H5→(C5H5)2Fe+2KCl+2H2O。
,其制备原理可简单表示为2KOH+FeCl2+2C5H5→(C5H5)2Fe+2KCl+2H2O。
①环戊二烯(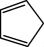 )分子中的碳原子的杂化方式为
)分子中的碳原子的杂化方式为___________ 。结合所学知识分析上述反应中除Cl元素之外,其他非金属元素的电负性由大到小的顺序为___________ 。
②当环戊二烯(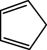 )失去一个氢离子之后,形成环戊二烯负离子(
)失去一个氢离子之后,形成环戊二烯负离子(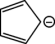 ),研究发现在该结构中形成了类似于苯环中的大π键,则该大π键可表示为
),研究发现在该结构中形成了类似于苯环中的大π键,则该大π键可表示为___________ 。(已知 分子中的大π键可表示为π66)。
分子中的大π键可表示为π66)。
(4)如图是一种铁、铝金属间化合物的晶胞结构,因该物质资源丰富,具有优良抗腐蚀性和抗氧化性,价格低廉,有取代不锈钢的巨大潜力。

说明:Fe原子位于顶点、面心、棱心、大立方体的体心,以及四个互不相邻的小立方体的体心;Al原子位于四个互不相邻的小立方体体心。
①铁、铝金属间化合物的化学式为___________ ;若晶胞中1,2号原子的坐标分别为(0, )、(0,
)、(0, ,0),则晶胞中3号原子的坐标
,0),则晶胞中3号原子的坐标___________ 。
②则该立方晶胞的密度为ρg/cm3,NA表示阿伏加德罗常数,试计算晶胞中距离最近的两个Fe原子核间的距离为___________ pm。
(1)请写出Fe原子的价层电子排布图:
(2)早在西汉时期的《淮南万毕术》中就记载“曾青得铁则化为铜”,这是有关“湿法炼铜”的最早文献记录。若向盛装有硫酸铜水溶液的试管里加入氨水,首先生成蓝色沉淀,继续滴加氨水,得到深蓝色的透明溶液。
①请写出蓝色沉淀溶解的离子反应方程式:
②NH3是重要的配体,NH3分子的VSEPR模型为
(3)二茂铁又称二环戊二烯合铁,分子式为(C5H5)2Fe,是一种具有芳香族性质的有机过渡金属化合物。其结构为
 ,其制备原理可简单表示为2KOH+FeCl2+2C5H5→(C5H5)2Fe+2KCl+2H2O。
,其制备原理可简单表示为2KOH+FeCl2+2C5H5→(C5H5)2Fe+2KCl+2H2O。①环戊二烯(
 )分子中的碳原子的杂化方式为
)分子中的碳原子的杂化方式为②当环戊二烯(
 )失去一个氢离子之后,形成环戊二烯负离子(
)失去一个氢离子之后,形成环戊二烯负离子( ),研究发现在该结构中形成了类似于苯环中的大π键,则该大π键可表示为
),研究发现在该结构中形成了类似于苯环中的大π键,则该大π键可表示为 分子中的大π键可表示为π66)。
分子中的大π键可表示为π66)。(4)如图是一种铁、铝金属间化合物的晶胞结构,因该物质资源丰富,具有优良抗腐蚀性和抗氧化性,价格低廉,有取代不锈钢的巨大潜力。

说明:Fe原子位于顶点、面心、棱心、大立方体的体心,以及四个互不相邻的小立方体的体心;Al原子位于四个互不相邻的小立方体体心。
①铁、铝金属间化合物的化学式为
 )、(0,
)、(0, ,0),则晶胞中3号原子的坐标
,0),则晶胞中3号原子的坐标②则该立方晶胞的密度为ρg/cm3,NA表示阿伏加德罗常数,试计算晶胞中距离最近的两个Fe原子核间的距离为
您最近一年使用:0次
名校
解题方法
10 . 铜与S、Se元素形成的化合物Cu2S、Cu2Se可用作热电材料,是热电领域的研究热点。回答下列问题:
(1)基态Cu原子核外电子的运动状态有___________ 种。
(2)S与卤素可形成化合物,如SF6、SClF5等;S、F、Cl电负性由大到小的顺序为___________ ;SF6、SClF5中心原子的价层电子对数为___________ ;SF6、SClF5中心原子的杂化方式是___________ (填字母)。
A. B.
B. C.
C.
(3)Se单质、铜离子在水合肼(N2H4∙H2O)的作用下可以生成Cu2Se。N2H4的相对分子质量与氧气相同,但沸点差距大,原因主要是___________ 。
(4)Cu2Se晶体属立方晶系,其晶胞结构如图所示:

该晶胞中有___________ 个Cu2Se;Se2-的配位数是___________ ;以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子分数坐标,如立方体晶胞体心位置的分数坐标为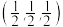 。写出Cu2Se晶胞中所有Cu+的分数坐标:
。写出Cu2Se晶胞中所有Cu+的分数坐标:___________ 。
(1)基态Cu原子核外电子的运动状态有
(2)S与卤素可形成化合物,如SF6、SClF5等;S、F、Cl电负性由大到小的顺序为
A.
 B.
B. C.
C.
(3)Se单质、铜离子在水合肼(N2H4∙H2O)的作用下可以生成Cu2Se。N2H4的相对分子质量与氧气相同,但沸点差距大,原因主要是
(4)Cu2Se晶体属立方晶系,其晶胞结构如图所示:

该晶胞中有
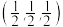 。写出Cu2Se晶胞中所有Cu+的分数坐标:
。写出Cu2Se晶胞中所有Cu+的分数坐标:
您最近一年使用:0次



