河南省湘豫名校2023届高三下学期第一次模拟考试理科综合化学试题
河南
高三
一模
2023-03-11
1269次
整体难度:
适中
考查范围:
常见无机物及其应用、有机化学基础、化学与STSE、物质结构与性质、认识化学科学、化学反应原理、化学实验基础
河南省湘豫名校2023届高三下学期第一次模拟考试理科综合化学试题
河南
高三
一模
2023-03-11
1269次
整体难度:
适中
考查范围:
常见无机物及其应用、有机化学基础、化学与STSE、物质结构与性质、认识化学科学、化学反应原理、化学实验基础
一、单选题 添加题型下试题
单选题
|
容易(0.94)
名校
解题方法
1. 化学与人类社会的生产、生活有着密切联系。下列叙述正确的是
| A.“五花马,千金裘”中“裘”的主要成分是纤维素 |
| B.二氧化硫不可用作食品添加剂 |
| C.“绿宝石”“孔雀石”的主要成分均属于硅酸盐 |
| D.“火树银花”涉及焰色反应 |
您最近一年使用:0次
2023-03-08更新
|
488次组卷
|
5卷引用:河南省湘豫名校2023届高三下学期第一次模拟考试理科综合化学试题
河南省湘豫名校2023届高三下学期第一次模拟考试理科综合化学试题(已下线)广东省深圳市2022-2023学年高三第一次调研考试变式题(选择题1-5)(已下线)河南省湘豫名校2023届高三下学期第一次模拟化学试题变式题(选择题7-10)(已下线)广东省广州市天河区2023届高三二模化学试题变式题(选择题1-5)四川省泸县第五中学2023-2024学年高三上学期开学考试理综化学试题
单选题
|
适中(0.65)
解题方法
2. 莫诺拉韦可有效治疗新冠病毒感染,化合物1和化合物2是制备莫诺拉韦的原料,结构如下。下列叙述错误的是


| A.化合物1分子中含有羟基和醚键 |
| B.化合物1可发生加成反应 |
| C.化合物2与乙酸互为同系物 |
| D.化合物2分子中所有碳原子不可能共平面 |
您最近一年使用:0次
单选题
|
适中(0.65)
3. Rh(铑)催化苯乙烯的不对称氢硒化反应历程如图所示。
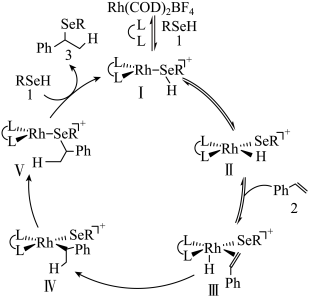
已知:与四个互不相同的原子或基团直接连接的碳原子叫手性碳原子,含手性碳原子的分子叫手性分子。Ph-代表苯基(C6H5-)。下列叙述错误的是

已知:与四个互不相同的原子或基团直接连接的碳原子叫手性碳原子,含手性碳原子的分子叫手性分子。Ph-代表苯基(C6H5-)。下列叙述错误的是
| A.该反应历程的总反应是最理想的绿色化学工艺 |
| B.Rh(COD)2BF4是总反应的催化剂 |
| C.上述循环中,Rh原子形成化学键数目保持不变 |
| D.有机物3是手性分子 |
您最近一年使用:0次
4. 下列有关实验操作、现象和解释或结论都正确的是
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向FeBr2溶液中加入少量新制氯水,再加CCl4振荡 | CCl4层无色 | Fe2+的还原性强于Br- |
| B | 取丙烯醛(CH2=CHCHO)于试管中,滴加酸性KMnO4溶液 | 酸性高锰酸钾溶液褪色 | 说明丙烯醛中含有碳碳双键 |
| C | 向20%蔗糖溶液中加入少量稀硫酸,加热,再加入银氨溶液 | 未出现银镜 | 蔗糖未水解 |
| D | 将乙醇和浓硫酸混合,迅速加热到170 ℃ ,将产生的气体通入溴水中 | 溴水褪色 | 说明乙醇发生消去反应且产物是乙烯 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
5. 短周期主族元素X、Y、Z、W的原子序数依次增大,X元素的最高正价和最低负价之和为2,Y和W同主族,在短周期元素中Z原子的原子半径最大,其中Y、Z、W构成的某种物质结构如图所示。下列说法正确的是
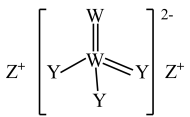
| A.简单离子半径:W> Z> Y> X |
| B.元素X的氧化物对应水化物是强酸 |
| C.元素Y和Z能形成一种用于呼吸面具供氧剂的物质 |
| D.向Y、Z和W形成的上述化合物中加入稀硫酸,无明显现象 |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
6. 科学家发明了一种Mg—PbO2电池,电解质为Na2SO4、H2SO4、NaOH,通过M和N两种离子交换膜将电解质溶液隔开,形成A、B、C三个电解质溶液区域(已知:a>b),装置如图,下列说法不正确的是


| A.Na+通过M膜移向B区,离子交换膜N为阴离子交换膜 |
| B.B区域的电解质浓度逐渐减小 |
| C.放电时,Mg电极反应为Mg+ 2OH—-2e—=Mg(OH)2 |
| D.消耗2.4 g Mg时,C区域电解质溶液减少16.0 g |
【知识点】 原电池原理的应用 原电池电极反应式书写解读 新型电池解读
您最近一年使用:0次
2023-03-08更新
|
479次组卷
|
3卷引用:河南省湘豫名校2023届高三下学期第一次模拟考试理科综合化学试题
河南省湘豫名校2023届高三下学期第一次模拟考试理科综合化学试题(已下线)河南省湘豫名校2023届高三下学期第一次模拟化学试题变式题(选择题11-13)福建省泉州科技中学2023-2024学年高二上学期期中考试化学试题
单选题
|
适中(0.65)
名校
解题方法
7. 已知丙二酸(HOOCCH2COOH,简记为H2A)是二元弱酸。常温下,向20.0 mL0.1 mol·L-1丙二酸溶液中滴加同浓度的NaOH溶液V mL,体系中含碳粒子的物质的量分布系数(δ)与pH的关系如图所示。已知:丙二酸在体系中物质的量分布系数为δ(H2A)=  。
。

下列叙述正确的是
 。
。
下列叙述正确的是
| A.V=20.0时,c(HA-)>c(H2A)>c(A2- ) |
| B.b点对应的溶液温度为滴定过程中的最高值 |
| C.V=40.0时,c(H2A)+c(HA- )+c(A2-)=0.1 mol ·L-1 |
D.常温下,H2A+A2- 2HA-的平衡常数K= 102.81 2HA-的平衡常数K= 102.81 |
您最近一年使用:0次
2023-03-08更新
|
477次组卷
|
4卷引用:河南省湘豫名校2023届高三下学期第一次模拟考试理科综合化学试题
河南省湘豫名校2023届高三下学期第一次模拟考试理科综合化学试题(已下线)河南省湘豫名校2023届高三下学期第一次模拟化学试题变式题(选择题11-13)四川省凉山州宁南中学2022-2023学年高二下学期第一次月考化学试题福建省福州高级中学2023-2024学年高三第二次阶段考试化学试题
二、解答题 添加题型下试题
解答题-工业流程题
|
适中(0.65)
8. 近期科学家首次发现像大脑样的学习材料—— VO2,某小组以接触法制硫酸的废催化剂(主要成分是V2O5,含少量Fe2O3、CuO、Al2O3等杂质)为原料制备VO2的流程如下:

已知:①NH4VO3难溶于水,(VO2)2SO4易溶于水;
② +2H+
+2H+ 
 + H2O;
+ H2O;
③几种金属离子以氢氧化物沉淀时的pH如下表。
请回答下列问题:
(1)“碱浸”中提高反应速率的可行措施有___________ (答两条)。
(2)“煅烧1”发生主要反应的化学方程式为___________ 。
(3)理论上,为实现Cu2+完全沉淀,应调节pH=6.0,工业生产中,常调节pH=8.0,其目的是___________ (用化学用语和必要的文字说明)。
(4)滤渣2的主要成分是Cu(OH)2和___________ (填化学式)。“煅烧2”需要在流动空气中煅烧的原因可能是___________ 。
(5)将2.075g VO2产品溶于强碱溶液,加热煮沸,调节pH为8.5,将溶液稀释至250.00mL溶液。取25.00mL稀释后的溶液于锥形瓶中,加入硫酸酸化的KI溶液(过量) ,溶液中的还原产物为V3+,滴加指示剂,用0. 10 mol∙L−1Na2S2O3溶液滴定,重复三次,测得数据如下表所示:
该产品的纯度为___________ %。若滴定过程中,振荡时间太长,则测得的结果___________ (填“偏高”“偏 低”或“无影响”)。(已知:2Na2S2O3 +I2 =Na2S4O6 + 2NaI)

已知:①NH4VO3难溶于水,(VO2)2SO4易溶于水;
②
 +2H+
+2H+ 
 + H2O;
+ H2O;③几种金属离子以氢氧化物沉淀时的pH如下表。
| 金属氢氧化物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀的pH | 2.7 | 4.0 | 4.6 |
| 完全沉淀的pH | 3.7 | 5.2 | 6.0 |
(1)“碱浸”中提高反应速率的可行措施有
(2)“煅烧1”发生主要反应的化学方程式为
(3)理论上,为实现Cu2+完全沉淀,应调节pH=6.0,工业生产中,常调节pH=8.0,其目的是
(4)滤渣2的主要成分是Cu(OH)2和
(5)将2.075g VO2产品溶于强碱溶液,加热煮沸,调节pH为8.5,将溶液稀释至250.00mL溶液。取25.00mL稀释后的溶液于锥形瓶中,加入硫酸酸化的KI溶液(过量) ,溶液中的还原产物为V3+,滴加指示剂,用0. 10 mol∙L−1Na2S2O3溶液滴定,重复三次,测得数据如下表所示:
| 序号 | 起始读数 | 终点读数 |
| ① | 0.10 | 20.55 |
| ② | 0. 02 | 20.12 |
| ③ | 0.03 | 19. 93 |
您最近一年使用:0次
解答题-实验探究题
|
较难(0.4)
名校
9. 某学习小组在实验室中利用下图装置(部分装置略去)测定某铁硫化物(FexSy)的组成,并探究反应结束后装置D所得溶液中含硫化合物的组成。
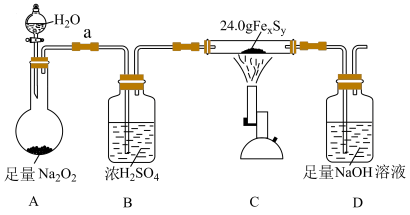
实验步骤:
步骤一:如图依次连接装置,检查装置气密性,装入试剂;
步骤二:打开分液漏斗活塞与旋塞,并点燃酒精喷灯:
步骤三:足够长时间后,装置D中产生气泡速率变快时,停止加热,继续向装置A中的烧瓶滴水一段时间;
步骤四:实验结束后,将装置D中所得溶液加水配制成100mL溶液。
请回答下列问题:
(1)盛水仪器的名称为___________ ,C中使用酒精喷灯而不使用酒精灯的原因是___________ 。
(2)检查装置A气密性的方法是___________ 。
(3)装置A中反应的离子方程式为___________ 。
(4)装置D的作用是___________ ,检验反应后 D装置溶液中含硫阴离子的方法是___________ 。
(5)取25. 00 mL步骤四中所配溶液,加入足量的H2O2,再加入足量经稀盐酸酸化的BaCl2溶液,将所得沉淀过滤、洗涤、干燥,称其质量为23.3g,则FexSy与O2反应的化学方程式为___________ 。

实验步骤:
步骤一:如图依次连接装置,检查装置气密性,装入试剂;
步骤二:打开分液漏斗活塞与旋塞,并点燃酒精喷灯:
步骤三:足够长时间后,装置D中产生气泡速率变快时,停止加热,继续向装置A中的烧瓶滴水一段时间;
步骤四:实验结束后,将装置D中所得溶液加水配制成100mL溶液。
请回答下列问题:
(1)盛水仪器的名称为
(2)检查装置A气密性的方法是
(3)装置A中反应的离子方程式为
(4)装置D的作用是
(5)取25. 00 mL步骤四中所配溶液,加入足量的H2O2,再加入足量经稀盐酸酸化的BaCl2溶液,将所得沉淀过滤、洗涤、干燥,称其质量为23.3g,则FexSy与O2反应的化学方程式为
您最近一年使用:0次
2023-03-08更新
|
598次组卷
|
4卷引用:河南省湘豫名校2023届高三下学期第一次模拟考试理科综合化学试题
河南省湘豫名校2023届高三下学期第一次模拟考试理科综合化学试题(已下线)河南省湘豫名校2023届高三下学期第一次模拟化学试题变式题(实验综合题)湖北省沙市中学2022-2023学年高一下学期4月期中考试化学试题黑龙江省鹤岗市第一中学2022-2023学年高一下学期5月期中考试化学试题
10. 短链烯烃是重要的有机化工原料,如丙烯(C3H6)和乙烯等。利用它们间的转化可有效强化节能减排,达到“碳达峰”和“碳中和”的目的。请回答下列问题:
(1)丙烯可由丙烷脱氢制取。已知丙烷脱氢制丙烯发生的主要反应及能量变化如图,其中反应1为主反应,反应2为副反应。
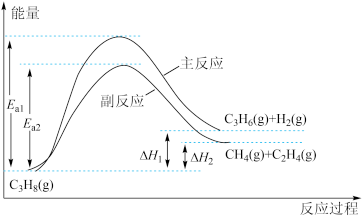
反应1:C3H8(g) C3H6(g)+H2(g)ΔH1;
C3H6(g)+H2(g)ΔH1;
反应2:C3H8(g) C2H4(g) +CH4(g)ΔH2=+81.3kJmol-1;
C2H4(g) +CH4(g)ΔH2=+81.3kJmol-1;
反应3:C3H6(g)+H2(g) C2H4(g)+CH4(g) ΔH3= -43.0kJ·mol-1。
C2H4(g)+CH4(g) ΔH3= -43.0kJ·mol-1。
根据图和以上数据可知,若温度升高,副反应要比主反应更容易发生,其主要原因是___________ ,主反应的焓变ΔH1=___________ 。
(2)乙烯可由CO2和H2制取:2CO2(g) + 6H2(g) C2H4(g) + 4H2O(g),在0.1 MPa,反应物起始物质的量之比n(CO2):n(H2)=1:3的条件下,不同温度下达到平衡时,CO2、H2、C2H4、H2O四种组分的物质的量分数如图所示:
C2H4(g) + 4H2O(g),在0.1 MPa,反应物起始物质的量之比n(CO2):n(H2)=1:3的条件下,不同温度下达到平衡时,CO2、H2、C2H4、H2O四种组分的物质的量分数如图所示:
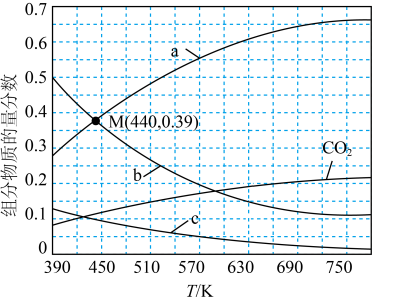
①图中表示C2H4的物质的量分数随温度变化的曲线是___________ (填“a”“b”或“c”)。
②反应2CO2(g) +6H2(g) C2H4(g) +4H2O(g) ΔH
C2H4(g) +4H2O(g) ΔH___________ (填“>”或“<”)0,保持其他条件不变,在绝热密闭容器中发生上述反应,达到平衡时,C2H4的物质的量分数比在恒温密闭容器中___________ (填“大”“小”或“相同”)。
③440℃时H2的平衡转化率为___________ 。
(3)利用CO2和CH4重整:CO2(g) +CH4(g) 2CO(g) +2H2(g) ΔH >0,在密闭容器中通入物质的量均为0.1 mol的CH4和CO2,在一定条件下使CO2(g)和CH4(g)发生上述反应,CH4的平衡转化率与温度及压强(单位:Pa)的关系如图所示。
2CO(g) +2H2(g) ΔH >0,在密闭容器中通入物质的量均为0.1 mol的CH4和CO2,在一定条件下使CO2(g)和CH4(g)发生上述反应,CH4的平衡转化率与温度及压强(单位:Pa)的关系如图所示。
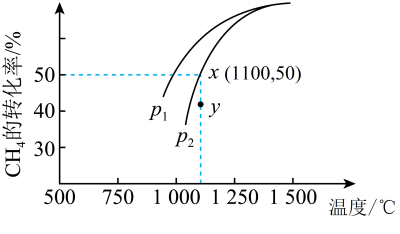
①结合图示,在1100℃下y点时v正___________ v逆(填“>”“<”或“=”)。
②若在1 100 ℃下x点时已达到平衡状态,用平衡分压代替平衡浓度可以得到平衡常数Kp,则x点对应温度下反应的平衡常数Kp=___________ (已知:气体分压p分=气体总压p总×气体的物质的量分数)。
(1)丙烯可由丙烷脱氢制取。已知丙烷脱氢制丙烯发生的主要反应及能量变化如图,其中反应1为主反应,反应2为副反应。

反应1:C3H8(g)
 C3H6(g)+H2(g)ΔH1;
C3H6(g)+H2(g)ΔH1;反应2:C3H8(g)
 C2H4(g) +CH4(g)ΔH2=+81.3kJmol-1;
C2H4(g) +CH4(g)ΔH2=+81.3kJmol-1;反应3:C3H6(g)+H2(g)
 C2H4(g)+CH4(g) ΔH3= -43.0kJ·mol-1。
C2H4(g)+CH4(g) ΔH3= -43.0kJ·mol-1。根据图和以上数据可知,若温度升高,副反应要比主反应更容易发生,其主要原因是
(2)乙烯可由CO2和H2制取:2CO2(g) + 6H2(g)
 C2H4(g) + 4H2O(g),在0.1 MPa,反应物起始物质的量之比n(CO2):n(H2)=1:3的条件下,不同温度下达到平衡时,CO2、H2、C2H4、H2O四种组分的物质的量分数如图所示:
C2H4(g) + 4H2O(g),在0.1 MPa,反应物起始物质的量之比n(CO2):n(H2)=1:3的条件下,不同温度下达到平衡时,CO2、H2、C2H4、H2O四种组分的物质的量分数如图所示:
①图中表示C2H4的物质的量分数随温度变化的曲线是
②反应2CO2(g) +6H2(g)
 C2H4(g) +4H2O(g) ΔH
C2H4(g) +4H2O(g) ΔH③440℃时H2的平衡转化率为
(3)利用CO2和CH4重整:CO2(g) +CH4(g)
 2CO(g) +2H2(g) ΔH >0,在密闭容器中通入物质的量均为0.1 mol的CH4和CO2,在一定条件下使CO2(g)和CH4(g)发生上述反应,CH4的平衡转化率与温度及压强(单位:Pa)的关系如图所示。
2CO(g) +2H2(g) ΔH >0,在密闭容器中通入物质的量均为0.1 mol的CH4和CO2,在一定条件下使CO2(g)和CH4(g)发生上述反应,CH4的平衡转化率与温度及压强(单位:Pa)的关系如图所示。
①结合图示,在1100℃下y点时v正
②若在1 100 ℃下x点时已达到平衡状态,用平衡分压代替平衡浓度可以得到平衡常数Kp,则x点对应温度下反应的平衡常数Kp=
您最近一年使用:0次
11. 西北工业大学曾华强课题组借用足球烯核心,成功实现了高效且选择性可精准定制的离子跨膜运输,如图甲所示。
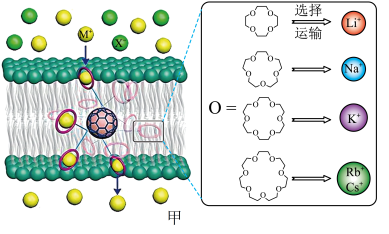
已知:图甲中的有机物为“冠醚”,命名规则是“环上原子个数-冠醚-氧原子个数”。
请回答下列问题:
(1)基态Cs原子的价层电子排布式为___________ 。基态K原子的核外电子云有___________ 个伸展方向。
(2)运输Cs+的冠醚名称是___________ 。冠醚分子中氧原子的杂化类型是___________ ,冠醚与碱金属离子之间存在微弱的配位键,配位原子是___________ (填元素符号)。
(3)几种冠醚与识别的碱金属离子的有关数据如下表所示:
18-冠醚-6不能识别和运输Na+和Cs+的原因是___________ 。观察图甲,冠醚不能识别和运输X-的主要原因可能是___________ 。
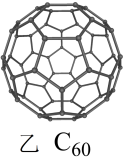
(4)足球烯的结构如图乙所示。1mol足球烯含___________ molσ键。
(5)铷晶胞为体心立方堆积,如图丙所示。
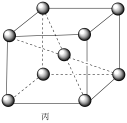
铷晶胞的原子空间利用率为___________ (用含π的式子表示)。
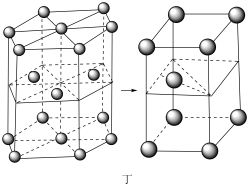
(6)锂晶胞为六方最密堆积,如图丁所示。锂晶胞中底边长为a pm,高为b pm,设NA为阿伏加德罗常数的值,则锂晶胞的密度为___________ g· cm-3(用含字母的式子表示)。

已知:图甲中的有机物为“冠醚”,命名规则是“环上原子个数-冠醚-氧原子个数”。
请回答下列问题:
(1)基态Cs原子的价层电子排布式为
(2)运输Cs+的冠醚名称是
(3)几种冠醚与识别的碱金属离子的有关数据如下表所示:
| 冠醚 | 冠醚空腔直径/pm | 适合的粒子直径/pm |
| 12冠醚- 4 | 120~ 150 | Li+ (152) |
| 15 -冠醚-5 | 170~ 220 | Na+ (204) |
| 18 -冠醚- 6 | 260~ 320 | K+ (276) |
| ___________ | 340~ 430 | Rb+ (304) |
| Cs+ (334) |
(4)足球烯的结构如图乙所示。1mol足球烯含

(5)铷晶胞为体心立方堆积,如图丙所示。

铷晶胞的原子空间利用率为
(6)锂晶胞为六方最密堆积,如图丁所示。锂晶胞中底边长为a pm,高为b pm,设NA为阿伏加德罗常数的值,则锂晶胞的密度为

您最近一年使用:0次
解答题-有机推断题
|
较难(0.4)
12. K是某药物的中间体,以顺丁烯二酸为原料制备K的流程如下:
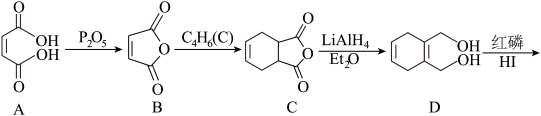

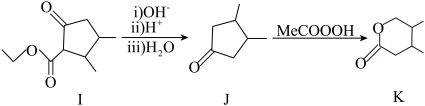
已知:①B和C生成D反应的原子利用率为100% ;
②图中,Me代表甲基,Et代表乙基。
请回答下列问题:
(1)C的名称是___________ ,I所含官能团的名称为___________ 。
(2)J→K的反应类型是___________ 。
(3)若1mol H在碱的作用下生成1molI和1mol L,则L在核磁共振氢谱图中峰的面积比为___________ 。
(4)写出B →D反应的化学方程式___________ 。
(5)在D的同分异构体中,同时具备下列条件的结构有___________ 种。
①遇FeCl3溶液发生显色反应;②能发生银镜反应和水解反应。
任选一种苯环上含3个取代基的同分异构体与足量的热烧碱溶液反应,写出发生反应的化学方程式___________ 。
(6)以异戊二烯(2—甲基—1,3—丁二烯)、3—烯环戊醇和CH3COOOH为原料合成某药物中间体 ,设计合成路线(无机试剂任选)。
,设计合成路线(无机试剂任选)。___________



已知:①B和C生成D反应的原子利用率为100% ;
②图中,Me代表甲基,Et代表乙基。
请回答下列问题:
(1)C的名称是
(2)J→K的反应类型是
(3)若1mol H在碱的作用下生成1molI和1mol L,则L在核磁共振氢谱图中峰的面积比为
(4)写出B →D反应的化学方程式
(5)在D的同分异构体中,同时具备下列条件的结构有
①遇FeCl3溶液发生显色反应;②能发生银镜反应和水解反应。
任选一种苯环上含3个取代基的同分异构体与足量的热烧碱溶液反应,写出发生反应的化学方程式
(6)以异戊二烯(2—甲基—1,3—丁二烯)、3—烯环戊醇和CH3COOOH为原料合成某药物中间体
 ,设计合成路线(无机试剂任选)。
,设计合成路线(无机试剂任选)。
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:常见无机物及其应用、有机化学基础、化学与STSE、物质结构与性质、认识化学科学、化学反应原理、化学实验基础
试卷题型(共 12题)
题型
数量
单选题
7
解答题
5
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.94 | 二氧化硫与二氧化碳的性质区别 焰色试验 淀粉和纤维素组成与结构 化学科学对人类文明发展的意义 | |
| 2 | 0.65 | 常见官能团名称、组成及结构 同系物的判断 加成反应 有机分子中原子共面的判断 | |
| 3 | 0.65 | 分子的手性 物质结构中化学键数目的计算 绿色化学与可持续发展 | |
| 4 | 0.65 | 氧化性、还原性强弱的比较 Fe2+的鉴别及其应用 乙醇的消去反应 蔗糖与麦芽糖的水解 | |
| 5 | 0.65 | 元素非金属性强弱的比较方法 微粒半径大小的比较方法 根据原子结构进行元素种类推断 | |
| 6 | 0.65 | 原电池原理的应用 原电池电极反应式书写 新型电池 | |
| 7 | 0.65 | 弱电解质在水溶液中的电离平衡 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 盐的水解常数 | |
| 二、解答题 | |||
| 8 | 0.65 | 氧化还原反应方程式的配平 酸碱中和滴定原理的应用 常见无机物的制备 探究物质组成或测量物质的含量 | 工业流程题 |
| 9 | 0.4 | 硫酸根离子的检验 硫化物 探究物质组成或测量物质的含量 综合实验设计与评价 | 实验探究题 |
| 10 | 0.4 | 盖斯定律及其有关计算 碰撞理论及活化能 化学平衡的移动及其影响因素 化学平衡的有关计算 | 原理综合题 |
| 11 | 0.4 | 电子排布式 元素性质与电负性的关系 利用杂化轨道理论判断化学键杂化类型 晶胞的有关计算 | 结构与性质 |
| 12 | 0.4 | 同分异构体的数目的确定 含酯基有机物水解消耗NaOH的量的计算 有机物的推断 根据题给物质选择合适合成路线 | 有机推断题 |



