名校
1 . 甲硫醇( )是重要的有机化工中间体,可用于合成维生素。通过
)是重要的有机化工中间体,可用于合成维生素。通过 和
和 合成
合成 的主要反应为:
的主要反应为:
I.
Ⅱ.
回答下列问题:
(1)计算反应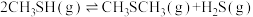 的
的
_______ kJ/mol。
(2) ℃时,向恒容密闭容器中充入一定量
℃时,向恒容密闭容器中充入一定量 和
和 发生反应,下列事实能说明反应达到平衡状态的是_______(填选项字母)。
发生反应,下列事实能说明反应达到平衡状态的是_______(填选项字母)。
(3) ℃时,向压强为
℃时,向压强为 的恒压密闭容器中按物质的量之比为1:2充入
的恒压密闭容器中按物质的量之比为1:2充入 和
和 发生反应,达到平衡时,
发生反应,达到平衡时, 的转化率为80%,
的转化率为80%, 的体积分数为5%。
的体积分数为5%。
①计算 的选择性为
的选择性为_______ ( 的选择性=
的选择性= )。
)。
②反应I的平衡常数 =
=_______ ( 是用分压表示的平衡常数,结果保留两位小数)。
是用分压表示的平衡常数,结果保留两位小数)。
(4)在 反应压力为0.7Mpa条件下,气体按90mL/min的速率通过催化剂表面发生反应,每分钟反应体系中
反应压力为0.7Mpa条件下,气体按90mL/min的速率通过催化剂表面发生反应,每分钟反应体系中 转化率、
转化率、 选择性随温度的变化如图甲所示,催化机理如图乙所示。
选择性随温度的变化如图甲所示,催化机理如图乙所示。 分压表示的反应速率为
分压表示的反应速率为_______ Mpa/min(结果保留两位有效数字)。
②当温度高于370℃时, 转化率随温度升高而降低的原因可能为
转化率随温度升高而降低的原因可能为_______ 。
③从电负性的角度描述ⅲ→i中脱水的过程:_______ 。
 )是重要的有机化工中间体,可用于合成维生素。通过
)是重要的有机化工中间体,可用于合成维生素。通过 和
和 合成
合成 的主要反应为:
的主要反应为:I.

Ⅱ.

回答下列问题:
(1)计算反应
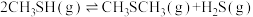 的
的
(2)
 ℃时,向恒容密闭容器中充入一定量
℃时,向恒容密闭容器中充入一定量 和
和 发生反应,下列事实能说明反应达到平衡状态的是_______(填选项字母)。
发生反应,下列事实能说明反应达到平衡状态的是_______(填选项字母)。| A.容器内气体密度不再发生变化 |
| B.混合气体的平均相对分子质量不再发生变化 |
C. 的体积分数不再发生变化 的体积分数不再发生变化 |
D. 和 和 的物质的量之比不再变化 的物质的量之比不再变化 |
(3)
 ℃时,向压强为
℃时,向压强为 的恒压密闭容器中按物质的量之比为1:2充入
的恒压密闭容器中按物质的量之比为1:2充入 和
和 发生反应,达到平衡时,
发生反应,达到平衡时, 的转化率为80%,
的转化率为80%, 的体积分数为5%。
的体积分数为5%。①计算
 的选择性为
的选择性为 的选择性=
的选择性= )。
)。②反应I的平衡常数
 =
= 是用分压表示的平衡常数,结果保留两位小数)。
是用分压表示的平衡常数,结果保留两位小数)。(4)在
 反应压力为0.7Mpa条件下,气体按90mL/min的速率通过催化剂表面发生反应,每分钟反应体系中
反应压力为0.7Mpa条件下,气体按90mL/min的速率通过催化剂表面发生反应,每分钟反应体系中 转化率、
转化率、 选择性随温度的变化如图甲所示,催化机理如图乙所示。
选择性随温度的变化如图甲所示,催化机理如图乙所示。
 分压表示的反应速率为
分压表示的反应速率为②当温度高于370℃时,
 转化率随温度升高而降低的原因可能为
转化率随温度升高而降低的原因可能为③从电负性的角度描述ⅲ→i中脱水的过程:
您最近一年使用:0次
名校
解题方法
2 . “液态阳光”项目通过太阳能电解水制氢,再采用催化剂将二氧化碳加氢合成甲醇。高选择性催化剂的组成为 固溶体。四方体
固溶体。四方体 晶胞如图所示,回答下列问题:
晶胞如图所示,回答下列问题:
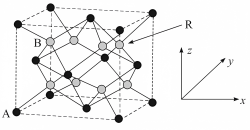
(1)图示晶胞中A代表___________ (填“ ”或“
”或“ ”)原子。
”)原子。
(2) 在元素周期表中的位置
在元素周期表中的位置___________ ,第二电离能:
___________  (填“大于”或“小于”)。
(填“大于”或“小于”)。
(3)关于 分子:
分子:
① 的电子式为
的电子式为___________ , 是
是___________ 分子(填“极性”或“非极性”)。
②H、C、N、O四种元素的电负性由大到小的顺序为___________ (用元素符号表示)。
③甲醇的沸点(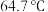 )介于水(
)介于水( )和甲硫醇(
)和甲硫醇( ,
,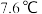 )之间,其原因是
)之间,其原因是___________ 。
(4)该晶胞中原子坐标参数 为
为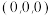 ,则
,则 的原子坐标参数为
的原子坐标参数为___________ 。
(5)晶胞参数为长 、宽
、宽 、高
、高 ,晶体密度为
,晶体密度为___________  (写出计算式即可,其中阿伏加德罗常数数值为
(写出计算式即可,其中阿伏加德罗常数数值为 )。
)。
 固溶体。四方体
固溶体。四方体 晶胞如图所示,回答下列问题:
晶胞如图所示,回答下列问题:
(1)图示晶胞中A代表
 ”或“
”或“ ”)原子。
”)原子。(2)
 在元素周期表中的位置
在元素周期表中的位置
 (填“大于”或“小于”)。
(填“大于”或“小于”)。(3)关于
 分子:
分子:①
 的电子式为
的电子式为 是
是②H、C、N、O四种元素的电负性由大到小的顺序为
③甲醇的沸点(
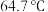 )介于水(
)介于水( )和甲硫醇(
)和甲硫醇( ,
,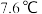 )之间,其原因是
)之间,其原因是(4)该晶胞中原子坐标参数
 为
为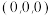 ,则
,则 的原子坐标参数为
的原子坐标参数为(5)晶胞参数为长
 、宽
、宽 、高
、高 ,晶体密度为
,晶体密度为 (写出计算式即可,其中阿伏加德罗常数数值为
(写出计算式即可,其中阿伏加德罗常数数值为 )。
)。
您最近一年使用:0次
解题方法
3 . 工业制备并提取一氯乙酸(ClCH2COOH)的母液中有CH3COOH、ClCH2COOH、Cl2CHCOOH等残留。实验室用多孔硫颗粒做催化剂,对母液进行深度氯化,使其中残留物转化为有广泛应用价值的三氯乙酸(CCl3COOH)。
主要反应方程式: 。制备装置如下图所示。
。制备装置如下图所示。

回答下列问题:
(1)甲中用仪器X替换分液漏斗的好处是_______ 。
(2)甲中制取Cl2离子方程式为_______ 。
(3)丁中仪器Y的名称是_______ 。
(4)制备三氯乙酸时,需要控制温度在140℃左右持续加热,则丁的加热方法是_______ 。(填“水浴加热”“油浴加热”或“酒精灯直接加热”)。
(5)该制备装置一处缺陷会产生实验安全问题,该缺陷是_______ 。
(6)制备过程中无需沸石,原因是_______ 。
(7)可以用pKa(pKa=-lgKa)来衡量酸性的强弱,下表是部分酸的pKa数据:
①从表中数据可知,酸性:ClCH2COOH<Cl2CHCOOH<CCl3COOH,请从物质结构角度解释原因_______ 。
②在Na2SO3溶液中加入足量的ClCH2COOH,反应的离子反应方程式为_______ 。
主要反应方程式:
 。制备装置如下图所示。
。制备装置如下图所示。
回答下列问题:
(1)甲中用仪器X替换分液漏斗的好处是
(2)甲中制取Cl2离子方程式为
(3)丁中仪器Y的名称是
(4)制备三氯乙酸时,需要控制温度在140℃左右持续加热,则丁的加热方法是
(5)该制备装置一处缺陷会产生实验安全问题,该缺陷是
(6)制备过程中无需沸石,原因是
(7)可以用pKa(pKa=-lgKa)来衡量酸性的强弱,下表是部分酸的pKa数据:
| ClCH2COOH | Cl2CHCOOH | CCl3COOH | H2SO3 | |
| pKa (室温) | 2.86 | 1.29 | 0.65 |  |
②在Na2SO3溶液中加入足量的ClCH2COOH,反应的离子反应方程式为
您最近一年使用:0次
2022-12-14更新
|
271次组卷
|
2卷引用:湖北省部分学校2022-2023学年高三上学期12月联考化学试题
名校
解题方法
4 . 铁氧体是一种磁性材料,具有广泛的应用。
(1)基态铁原子的核外电子排布式为____ 。
(2)工业制备铁氧体常使用水解法,制备时常加入尿素[CO(NH2)2]、醋酸钠等碱性物质。尿素分子中四种不同元素的电负性由大至小的顺序是____ ;醋酸钠中碳原子的杂化类型是____ 。
(3)工业制备铁氧体也可使用沉淀法,制备时常加入氨(NH3)、联氨(N2H4)等弱碱。比较表中氨(NH3)、联氨(N2H4)的熔沸点,解释其高低的主要原因____ 。
(4)如图是从铁氧体离子晶体Fe3O4中,取出的能体现其晶体结构的一个立方体,则晶体中的氧离子是否构成了面心立方最密堆积____ (填“是”或“否”),该立方体是不是Fe3O4的晶胞____ (填“是”或“否”),立方体中三价铁离子处于氧离子围成的____ 空隙(填空间结构)。
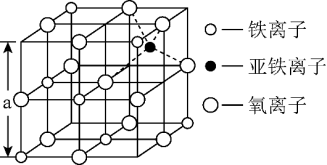
(5)解释该Fe3O4晶体能导电的原因____ ,根据如图计算Fe3O4晶体的密度____ g•cm-3。(图中a=0.42nm,只需要列出计算式。)
(1)基态铁原子的核外电子排布式为
(2)工业制备铁氧体常使用水解法,制备时常加入尿素[CO(NH2)2]、醋酸钠等碱性物质。尿素分子中四种不同元素的电负性由大至小的顺序是
(3)工业制备铁氧体也可使用沉淀法,制备时常加入氨(NH3)、联氨(N2H4)等弱碱。比较表中氨(NH3)、联氨(N2H4)的熔沸点,解释其高低的主要原因
| N2H4 | NH3 | |
| 熔点/℃ | 2 | -77.8 |
| 沸点/℃ | 113.5 | -33.5 |

(5)解释该Fe3O4晶体能导电的原因
您最近一年使用:0次
2022-03-18更新
|
176次组卷
|
5卷引用:2017届湖北省黄冈市高三3月质量检测理科综合化学试卷
解题方法
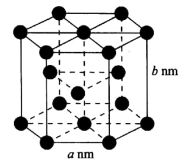
5 . 压电陶瓷常用于声呐系统、气象探测、环境保护、家用电器等。回答下列问题:
(1)钛酸钡是常用压电陶瓷中的一种。Ti原子价电子排布式为______ ,价电子层中含有空轨道______ 个。TiOSO4中含有的化学键类型为______ 。
(2)石英是压电晶体的代表。SiO2中化学键的键角______ (填“大于”“小于”或“等于")CO2分子中键角,SiO2的沸点远高于CO2的原因是______ ;C、O、Si三种元素的电负性大小关系为______ 。
(3)铁电陶瓷可用于制造大容量电容器等,从结构上分析Fe2+易转化为Fe3+的原因______ [Fe(SCN)4Cl2]Cl3的配位数为______ ,将1mol[Fe(SCN)4Cl2]Cl3溶于水,易电离出______ 个Cl-。
(4)低温下金属钛(a相)原子堆积呈密排六方结构,如图所示,其密度为______ g·cm-1(用含a、b的代数式表示)。
(1)钛酸钡是常用压电陶瓷中的一种。Ti原子价电子排布式为
(2)石英是压电晶体的代表。SiO2中化学键的键角
(3)铁电陶瓷可用于制造大容量电容器等,从结构上分析Fe2+易转化为Fe3+的原因
(4)低温下金属钛(a相)原子堆积呈密排六方结构,如图所示,其密度为

您最近一年使用:0次
名校
解题方法
6 . 钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为________________ 。
②Fe的基态原子共有________ 种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是____________________ (用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为________ ,中心原子的杂化方式为________ 。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO________ (填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。
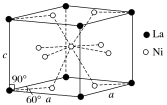
①该晶体的化学式为________________ 。
②已知该晶胞的摩尔质量为Mg·mol-1,密度为dg·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是________ cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511pm,c=397pm;标准状况下氢气的密度为8.98×10-5g·cm-3;储氢能力= 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为________ 。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为
②Fe的基态原子共有
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。

①该晶体的化学式为
②已知该晶胞的摩尔质量为Mg·mol-1,密度为dg·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511pm,c=397pm;标准状况下氢气的密度为8.98×10-5g·cm-3;储氢能力=
 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
您最近一年使用:0次
2020-11-12更新
|
346次组卷
|
13卷引用:2016届湖北省襄阳五中高三5月模拟三理综化学试卷
2016届湖北省襄阳五中高三5月模拟三理综化学试卷湖北省孝感市八校2018届高三上学期期末考试理综化学试题2016届河北省晋州一中高三上学期期末理综化学试卷2016届安徽省安庆一中高三热身考试理综化学试卷2017届安徽省黄山市屯溪一中高三上月考二化学卷四川省内江市2017届高三第五次模拟考试理综化学试题陕西省师范大学附属中学2017届高三下学期第十一次模考理综化学试题苏教版2017届高三单元精练检测十一化学试题(已下线)2018年6月1日 押高考化学第35题(2)——《每日一题》2018年高三化学四轮复习(已下线)解密21 物质的结构与性质(教师版)——备战2018年高考化学之高频考点解密(已下线)2019年5月31日《每日一题》四轮复习—— 押高考化学第35题(2)四川省成都附属实验中学2021届高三上学期11月月考理科综合化学试题(已下线)第三单元 物质的聚集状态性质与物质性质(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)
7 . 现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大。A元素的价电子构型为nsnnpn+1;C元素为最活泼的非金属元素;D元素核外有三个电子层,最外层电子数是核外电子总数的1/6;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
(1)A元素的第一电离能_______ (填“<”“>”或“=”)B元素的第一电离能,A、B、C三种元素的电负性由小到大的顺序为________ (用元素符号表示)。
(2)D元素原子的价电子排布式是________ 。
(3)C元素的电子排布图为_________ ;E3+的离子符号为__________ 。
(4)F元素位于元素周期表的______ 区,其基态原子的电子排布式为_______ 。
(5)G元素可能的性质有________ 。
A.其最高价氧化物是分子晶体 B.其电负性大于磷 C.其原子半径大于锗 D.其第一电离能小于硒
(6)用氢键表示式写出C的氢化物水溶液中存在的所有氢键:_________ 。已知F的最高价氧化物对应水化物能溶于氨水且生成一种配合物阳离子,写出该反应的离子方程式____ 。
(1)A元素的第一电离能
(2)D元素原子的价电子排布式是
(3)C元素的电子排布图为
(4)F元素位于元素周期表的
(5)G元素可能的性质有
A.其最高价氧化物是分子晶体 B.其电负性大于磷 C.其原子半径大于锗 D.其第一电离能小于硒
(6)用氢键表示式写出C的氢化物水溶液中存在的所有氢键:
您最近一年使用:0次
解题方法
8 . 工业上合成氨,CO易与铁触媒作用导致铁触媒失去催化活性:Fe+5CO =Fe(CO)5。为了防止催化剂铁触媒中毒,要除去CO,发生的反应为Cu(NH3)2OOCCH3+CO+NH3 =Cu(NH3)3(CO)OOCCH3。回答下列问题:
(1)写出CO的一种常见等电子体分子的结构式:________________________ ;C、N、O的第一电离能由大到小的顺序为________________________ (用元素符号表示)。
(2)与O同族的元素还有S、Se、Te,它们氢化物的沸点大小为H2O>H2Te>H2Se>H2S,其原因是_______________________________________________________________________ 。
(3)1 mol配合物[Cu(NH3)2]OOCCH3中,铜显+1价,则含有化学键的类型有________________ ;其中含有的σ键数目为____________ ,NH3分子的价电子对互斥理论模型是______________ 。
(4)一种类石墨的聚合物半导体g-C3N4,其单层平面结构如图1,晶胞结构如图2。
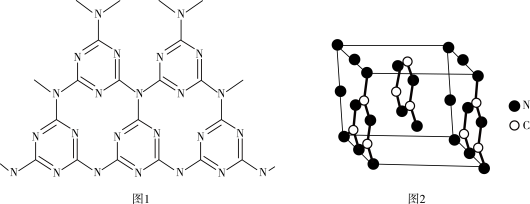
① g-C3N4中氮原子的杂化类型是_____________ 。
② 根据图2,在图1中用平行四边形画出一个最小重复单元_____________ 。
③ 已知该晶胞的体积为V cm3,中间层原子均在晶胞内部。设阿伏加 德罗常数的值为NA,则g-C3N4的密度为_____________ g•cm-3。
(1)写出CO的一种常见等电子体分子的结构式:
(2)与O同族的元素还有S、Se、Te,它们氢化物的沸点大小为H2O>H2Te>H2Se>H2S,其原因是
(3)1 mol配合物[Cu(NH3)2]OOCCH3中,铜显+1价,则含有化学键的类型有
(4)一种类石墨的聚合物半导体g-C3N4,其单层平面结构如图1,晶胞结构如图2。

① g-C3N4中氮原子的杂化类型是
② 根据图2,在图1中用平行四边形画出一个最小重复单元
③ 已知该晶胞的体积为V cm3,中间层原子均在晶胞内部。设阿伏加 德罗常数的值为NA,则g-C3N4的密度为
您最近一年使用:0次
解题方法
9 . SDIC是一种性能稳定的高效广谱杀菌消毒剂,广泛用于环境水处理、食品加工、公共场所等清洁消毒,结构如图甲所示。其中W、X、Y、R、Z均为短周期元素且原子序数依次增大,Z在同周期主族元素中原子半径最小,且Z与Y位于不同周期。

回答下列问题:
(1)SDIC中,电负性最小的元素是____ (填元素名称) ,其中W最外层的孤电子对数为__________ 。
(2)基态X3-的核外电子排布式为____ 。某离子晶体中含有X3-和M+两种离子,其中M+核外电子正好充满K、L、M3个能层,则M的元素符号是___ ,该晶体晶胞结构如图乙所示,则X3-的配位数为____ 。
(3)X≡X的键能为942kJ/mol,X-X单键的键能为247kJ/mol,则X的最常见单质中____ (填“σ”或“π”)键更稳定。
(4)X的最简单氢化物是___ 分子(填“极性”或“非极性”),该分子与1个H+结合形成离子时键角___ (填“变大”、“变小”或“不变”),原因是____ 。
(5)SDIC的原子发射光谱中呈现特征颜色的微观原因是____ 。
(6)在由R和Y的单核离子组成的晶体中,阴离子的排列方式为面心立方最密堆积,阳离子填充在全部的正四面体空隙中。已知晶胞参数为anm,阿伏加 德罗常数的值为NA,则该晶体密度为____ g/cm3 (列出计算式)。

回答下列问题:
(1)SDIC中,电负性最小的元素是
(2)基态X3-的核外电子排布式为
(3)X≡X的键能为942kJ/mol,X-X单键的键能为247kJ/mol,则X的最常见单质中
(4)X的最简单氢化物是
(5)SDIC的原子发射光谱中呈现特征颜色的微观原因是
(6)在由R和Y的单核离子组成的晶体中,阴离子的排列方式为面心立方最密堆积,阳离子填充在全部的正四面体空隙中。已知晶胞参数为anm,阿伏加 德罗常数的值为NA,则该晶体密度为
您最近一年使用:0次
解题方法
10 . Ⅰ.羟基磷酸钙[Ca10(PO4)6(OH)2]具有优良的生物相容性和生物活性,它在口腔保健中具有重要作用,可以防止龋齿等,回答下列问题。
(1)Ca10(PO4)6(OH)2中,元素的电负性按由大到小的顺序依次是___ 。
(2)上述元素都能形成氢化物,其中PH3与同主族元素N形成的氢化物的键角关系是PH3___ NH3(填“>”或“<”),PO43-离子空间构型是___ 。
(3)现已合成含钙的全氮阴离子盐,其中阴离子N5-为平面正五边形结构,N原子的杂化类型是___ 。
(4)碳酸钙的分解温度远高于碳酸镁,其原因是___ 。
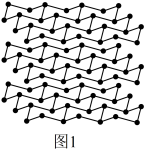
(5)黑磷是磷的一种同素异形体,与石墨烯类似,其晶体结构片段如图1所示:其中最小的环为6元环,每个环平均含有___ 个P原子。
Ⅱ.钴是人体不可或缺的微量元素之一。Co、Al、O形成的一种化合物钴蓝晶体结构如图2所示。
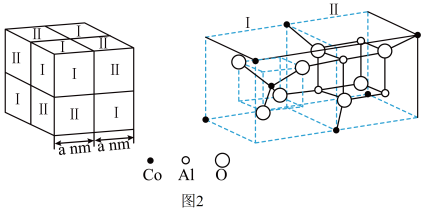
(6)基态Co原子的价电子排布式为___ 。该立方晶胞由4个I型和4个Ⅱ型小立方体构成,其化学式为___ ,NA为阿伏加 德罗常数的值,钴蓝晶体的密度为___ g·cm-3(列计算式)。
(1)Ca10(PO4)6(OH)2中,元素的电负性按由大到小的顺序依次是
(2)上述元素都能形成氢化物,其中PH3与同主族元素N形成的氢化物的键角关系是PH3
(3)现已合成含钙的全氮阴离子盐,其中阴离子N5-为平面正五边形结构,N原子的杂化类型是
(4)碳酸钙的分解温度远高于碳酸镁,其原因是
(5)黑磷是磷的一种同素异形体,与石墨烯类似,其晶体结构片段如图1所示:其中最小的环为6元环,每个环平均含有

Ⅱ.钴是人体不可或缺的微量元素之一。Co、Al、O形成的一种化合物钴蓝晶体结构如图2所示。

(6)基态Co原子的价电子排布式为
您最近一年使用:0次



