名校
解题方法
1 . 新型铜锌锡硫化合物(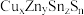 )薄膜太阳能电池近年来已经成为可再生能源领域的研究热点。回答下列问题:
)薄膜太阳能电池近年来已经成为可再生能源领域的研究热点。回答下列问题:
(1) 的价电子排布式为
的价电子排布式为_______ , 位于元素周期表的
位于元素周期表的_____ 区。
(2) 、
、 、
、 第一电离能由大到小的顺序是
第一电离能由大到小的顺序是_______ 。其中电负性最大的元素是______ 。
(3) 和
和 键角较小的是
键角较小的是_______ ,原因是____ 。
(4)向 溶液中滴加氨水至过量,最终得到蓝色溶液,溶液中
溶液中滴加氨水至过量,最终得到蓝色溶液,溶液中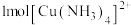 含有
含有____ 个 键。再向溶液中加入乙醇得到深蓝色晶体,该晶体中不存在
键。再向溶液中加入乙醇得到深蓝色晶体,该晶体中不存在____ (填标号)。
A.离子键 B.共价键 C.配位键 D.金属键 E.氢键
(5)锌黄锡矿( 型)是制备薄膜太阳能电池的重要原料,其晶胞结构如图所示(晶胞参数
型)是制备薄膜太阳能电池的重要原料,其晶胞结构如图所示(晶胞参数 )。该晶体的化学式为
)。该晶体的化学式为______ ,密度
______  (用含有
(用含有 的代数式表示)。
的代数式表示)。
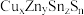 )薄膜太阳能电池近年来已经成为可再生能源领域的研究热点。回答下列问题:
)薄膜太阳能电池近年来已经成为可再生能源领域的研究热点。回答下列问题:(1)
 的价电子排布式为
的价电子排布式为 位于元素周期表的
位于元素周期表的(2)
 、
、 、
、 第一电离能由大到小的顺序是
第一电离能由大到小的顺序是(3)
 和
和 键角较小的是
键角较小的是(4)向
 溶液中滴加氨水至过量,最终得到蓝色溶液,溶液中
溶液中滴加氨水至过量,最终得到蓝色溶液,溶液中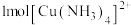 含有
含有 键。再向溶液中加入乙醇得到深蓝色晶体,该晶体中不存在
键。再向溶液中加入乙醇得到深蓝色晶体,该晶体中不存在A.离子键 B.共价键 C.配位键 D.金属键 E.氢键
(5)锌黄锡矿(
 型)是制备薄膜太阳能电池的重要原料,其晶胞结构如图所示(晶胞参数
型)是制备薄膜太阳能电池的重要原料,其晶胞结构如图所示(晶胞参数 )。该晶体的化学式为
)。该晶体的化学式为
 (用含有
(用含有 的代数式表示)。
的代数式表示)。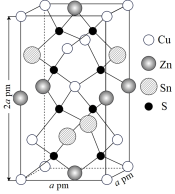
您最近一年使用:0次
名校
2 . 芯片作为高科技产业,以及智能化、信息化、数字化的基础,自诞生以来就一直倍受关注。芯片制造要经过六个最为关键的步骤:沉积、光刻胶涂覆、光刻、刻蚀、离子注入和封装。回答下列问题:
(1)“沉积”是将导体、绝缘体或半导体材料薄膜沉积到纯硅晶圆上。GaN、GaAs是制造芯片的新型半导体材料。
①镓为第四周期元素,基态Ga原子的核外电子排布式为:___________ ;
②将Mn掺杂到GaAs的晶体中替换部分Ga得到稀磁性半导体材料,晶体结构如甲图:___________ 。
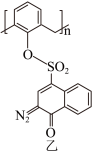
(2)“光刻胶涂覆”中用到一种701紫外正型光刻胶,结构如图乙所示,其分子中S原子的杂化形式为___________ 。 )及清洗剂
)及清洗剂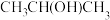 ,三种物质中除H外的各元素的电负性由大到小的顺序为
,三种物质中除H外的各元素的电负性由大到小的顺序为___________ ,HF分子的极性___________ (填“大于”、“等于”或“小于”)HCl,1mol 中含有
中含有___________ mol配位键。
(4)LiF晶体结构属于氯化钠型。
①LiF的熔点和沸点比NaCl的高,请解释原因:___________ 。
②LiF晶体的密度约为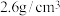 ,LiF晶胞的体积约为
,LiF晶胞的体积约为___________  (保留一位小数)。
(保留一位小数)。
(1)“沉积”是将导体、绝缘体或半导体材料薄膜沉积到纯硅晶圆上。GaN、GaAs是制造芯片的新型半导体材料。
①镓为第四周期元素,基态Ga原子的核外电子排布式为:
②将Mn掺杂到GaAs的晶体中替换部分Ga得到稀磁性半导体材料,晶体结构如甲图:

(2)“光刻胶涂覆”中用到一种701紫外正型光刻胶,结构如图乙所示,其分子中S原子的杂化形式为
 )及清洗剂
)及清洗剂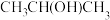 ,三种物质中除H外的各元素的电负性由大到小的顺序为
,三种物质中除H外的各元素的电负性由大到小的顺序为 中含有
中含有(4)LiF晶体结构属于氯化钠型。
①LiF的熔点和沸点比NaCl的高,请解释原因:
②LiF晶体的密度约为
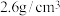 ,LiF晶胞的体积约为
,LiF晶胞的体积约为 (保留一位小数)。
(保留一位小数)。
您最近一年使用:0次
解题方法
3 .  常用作有机合成中的还原剂,其合成反应为
常用作有机合成中的还原剂,其合成反应为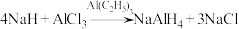 。回答下列问题:
。回答下列问题:
(1)基态氧原子中价层电子排布图为___________ ,O、H、Al电负性由大到小的顺序为___________ ,钠的焰色是黄色,产生此焰色时属于___________ (填“发射”或“吸收”)光谱。
(2)已知 熔点为194℃、NaCl熔点为801℃,其原因是
熔点为194℃、NaCl熔点为801℃,其原因是___________ ,又知铝的第一电离能比镁的第一电离能小,原因是___________ 。
(3)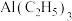 中碳原子的杂化方式为
中碳原子的杂化方式为___________ , 的空间构型为
的空间构型为___________ , 中不存在的化学键是
中不存在的化学键是___________ (填字母)。
A.σ键 B.配位键 C.离子键 D.非极性键
(4) 晶体密度为
晶体密度为 ,其晶胞图及部分微粒分数坐标如图所示,则C的分数坐标为
,其晶胞图及部分微粒分数坐标如图所示,则C的分数坐标为___________ ,阿伏加德罗常数
___________  。
。
 常用作有机合成中的还原剂,其合成反应为
常用作有机合成中的还原剂,其合成反应为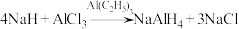 。回答下列问题:
。回答下列问题:(1)基态氧原子中价层电子排布图为
(2)已知
 熔点为194℃、NaCl熔点为801℃,其原因是
熔点为194℃、NaCl熔点为801℃,其原因是(3)
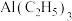 中碳原子的杂化方式为
中碳原子的杂化方式为 的空间构型为
的空间构型为 中不存在的化学键是
中不存在的化学键是A.σ键 B.配位键 C.离子键 D.非极性键
(4)
 晶体密度为
晶体密度为 ,其晶胞图及部分微粒分数坐标如图所示,则C的分数坐标为
,其晶胞图及部分微粒分数坐标如图所示,则C的分数坐标为
 。
。
您最近一年使用:0次
解题方法
4 . 羰基钻催化剂可在温和条件下催化氢甲酰化反应,其结构为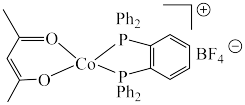 (Ph代表苯基)。回答下列问题:
(Ph代表苯基)。回答下列问题:
(2)羰基钴催化剂中位于第二周期的元素中,电负性由小到大的顺序为
 的晶体类型相同,
的晶体类型相同, 的熔点高于羰基钴催化剂的原因是
的熔点高于羰基钴催化剂的原因是(3)羰基钴催化剂阳离子中Co处于平面四边形中心,羰基钴催化剂中采取
 杂化的元素种数为
杂化的元素种数为 形成羰基钴催化剂过程中,
形成羰基钴催化剂过程中,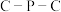 键角
键角(4)一种掺Co催化剂的晶胞结构及晶胞沿面对角线投影如下图所示。晶胞中与Co最近的氧原子所构成的几何形状为
 ,晶体的密度为
,晶体的密度为 ,则距离最近的两个氧原子间的距离为
,则距离最近的两个氧原子间的距离为 、
、 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2024-06-01更新
|
78次组卷
|
2卷引用:2024届陕西省安康市安康市高新中学,安康中学高新分校高三下学期模拟预测理综试题-高中化学
解题方法
5 . Ga与B、Al处于同一主族,氮化镓是制造LED的重要材料,被誉为第三代半导体材料。回答下列问题:
(1)基态Ga原子的价电子排布式为___________ 。
(2)Be、B、C的电负性由小到大的顺序为___________ ,第一电离能由小到大的顺序为___________ 。
(3)①乙硼烷( )的结构如图,其中B原子的轨道杂化类型是
)的结构如图,其中B原子的轨道杂化类型是___________ 。 与
与 反应生成环氮硼烷(
反应生成环氮硼烷( 具有规则的平面六角形环状结构),写出一种与
具有规则的平面六角形环状结构),写出一种与 原子总数相同、价电子总数相同的分子
原子总数相同、价电子总数相同的分子___________ 。 极易水解,从配位角度解释原因
极易水解,从配位角度解释原因___________ 。
③B和N形成的BN有石墨型与金刚石型结构,金刚石型BN的硬度大于金刚石,原因是___________ 。
(4)氮化镓的一种晶体结构如图所示(属六方晶系),Ga的配位数为___________ ,晶体的密度为___________  (用含a、c、
(用含a、c、 的代数式表示,
的代数式表示, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
(1)基态Ga原子的价电子排布式为
(2)Be、B、C的电负性由小到大的顺序为
(3)①乙硼烷(
 )的结构如图,其中B原子的轨道杂化类型是
)的结构如图,其中B原子的轨道杂化类型是 与
与 反应生成环氮硼烷(
反应生成环氮硼烷( 具有规则的平面六角形环状结构),写出一种与
具有规则的平面六角形环状结构),写出一种与 原子总数相同、价电子总数相同的分子
原子总数相同、价电子总数相同的分子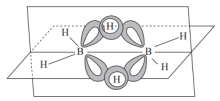
 极易水解,从配位角度解释原因
极易水解,从配位角度解释原因③B和N形成的BN有石墨型与金刚石型结构,金刚石型BN的硬度大于金刚石,原因是
(4)氮化镓的一种晶体结构如图所示(属六方晶系),Ga的配位数为
 (用含a、c、
(用含a、c、 的代数式表示,
的代数式表示, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。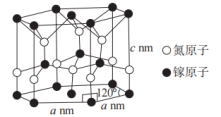
您最近一年使用:0次
解题方法
6 . 国产大飞机C919的制造使用了较多含硼材料(如硼纤维、氮化硼等),多项技术打破了外国垄断。
(1)立方氮化硼硬度大,熔点为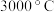 ,其晶体类型为
,其晶体类型为_______ 。
(2)耐高温材料立方 制备流程中用到
制备流程中用到 、
、 和触媒剂
和触媒剂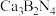 。
。
① 、B、N三种元素电负性从大到小的顺序为
、B、N三种元素电负性从大到小的顺序为_______ 。
② 中
中 原子的
原子的_______ 轨道与 原子的
原子的_______ 轨道形成 键;形成
键;形成 过程中,基态
过程中,基态 原子价电子层上的电子先激发,再杂化,激发后
原子价电子层上的电子先激发,再杂化,激发后 原子的价电子轨道表示式为
原子的价电子轨道表示式为_______ 。
③ 在四氯化碳中的溶解度远大于
在四氯化碳中的溶解度远大于 ,原因是
,原因是_______ 。
(3)近年来硼氢类离子液体作为火箭推进剂燃料得到了广泛使用。该化合物(如图所示)中不存在的作用力有_______ (填字母)。 键 E.
键 E. 键 F.氢键
键 F.氢键
(4)硼化钙晶胞结构如图所示, 原子构成
原子构成 正八面体,各个顶点通过
正八面体,各个顶点通过 键互相连接成三维骨架,八个
键互相连接成三维骨架,八个 多面体围成立方体,中心为
多面体围成立方体,中心为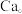 硼化钙的化学式为
硼化钙的化学式为_______ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标。已知 原子的分数坐标为
原子的分数坐标为 ,
, 正八面体中
正八面体中 键的键长为r
键的键长为r ,晶胞参数为a
,晶胞参数为a ,则
,则 点原子的分数坐标为
点原子的分数坐标为_______ 。
(1)立方氮化硼硬度大,熔点为
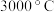 ,其晶体类型为
,其晶体类型为(2)耐高温材料立方
 制备流程中用到
制备流程中用到 、
、 和触媒剂
和触媒剂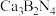 。
。①
 、B、N三种元素电负性从大到小的顺序为
、B、N三种元素电负性从大到小的顺序为②
 中
中 原子的
原子的 原子的
原子的 键;形成
键;形成 过程中,基态
过程中,基态 原子价电子层上的电子先激发,再杂化,激发后
原子价电子层上的电子先激发,再杂化,激发后 原子的价电子轨道表示式为
原子的价电子轨道表示式为③
 在四氯化碳中的溶解度远大于
在四氯化碳中的溶解度远大于 ,原因是
,原因是(3)近年来硼氢类离子液体作为火箭推进剂燃料得到了广泛使用。该化合物(如图所示)中不存在的作用力有
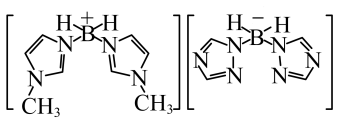
 键 E.
键 E. 键 F.氢键
键 F.氢键(4)硼化钙晶胞结构如图所示,
 原子构成
原子构成 正八面体,各个顶点通过
正八面体,各个顶点通过 键互相连接成三维骨架,八个
键互相连接成三维骨架,八个 多面体围成立方体,中心为
多面体围成立方体,中心为 硼化钙的化学式为
硼化钙的化学式为 原子的分数坐标为
原子的分数坐标为 ,
, 正八面体中
正八面体中 键的键长为r
键的键长为r ,晶胞参数为a
,晶胞参数为a ,则
,则 点原子的分数坐标为
点原子的分数坐标为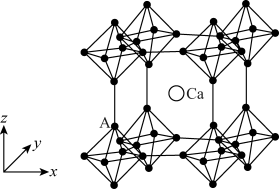
您最近一年使用:0次
23-24高三下·陕西西安·阶段练习
解题方法
7 . CdS、ZnS等硫化物与TiO2、SnO2、ZnO等进行复合,可以得到性能很好的复合半导体光催化剂。回答下列问题:
(1)Sn与C同主族,基态Sn原子的价层电子排布式为_______ ,基态Ti原子核外电子有_______ 种空间运动状态, 核外未成对电子数为
核外未成对电子数为_______ ,ZnS、ZnO中各元素的电负性由大到小的顺序为_______ 。
(2)许多具有—C═N—结构的分子及其硼配合物是较好的荧光材料,在光学探针、有机发光二极管等领域受到广泛关注,某两种含这种结构的分子如图1、图2所示。_______ ;图2中N原子会和B原子形成配位键,成键时_______ (填元素符号)原子提供空轨道。
(3)N、O、F三种元素的第一电离能由大到小的顺序为_______ (填元素符号),解释其原因:_______ 。
(4)钾冰晶石型晶体是一类新型的无机闪烁体,在核安全以及国土安全检查方面有重要的应用。如图是一种钾冰晶石型闪烁体的晶胞结构,属于立方晶系,其中A位是 、B位是
、B位是 、R位是正三价的Y(钇),X位是
、R位是正三价的Y(钇),X位是 。
。_______ 。
②若晶胞参数为anm,该晶体的密度为_______ g (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
(1)Sn与C同主族,基态Sn原子的价层电子排布式为
 核外未成对电子数为
核外未成对电子数为(2)许多具有—C═N—结构的分子及其硼配合物是较好的荧光材料,在光学探针、有机发光二极管等领域受到广泛关注,某两种含这种结构的分子如图1、图2所示。

(3)N、O、F三种元素的第一电离能由大到小的顺序为
(4)钾冰晶石型晶体是一类新型的无机闪烁体,在核安全以及国土安全检查方面有重要的应用。如图是一种钾冰晶石型闪烁体的晶胞结构,属于立方晶系,其中A位是
 、B位是
、B位是 、R位是正三价的Y(钇),X位是
、R位是正三价的Y(钇),X位是 。
。
②若晶胞参数为anm,该晶体的密度为
 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
8 . Fe、Co、Ni、Cu均为第四周期元素,它们的化合物在生产、生活中有着广泛的应用。
(1)基态Fe原子的核外电子中,两种自旋状态的电子数之比为___________ 。在空气中FeO稳定性小于 ,从电子排布的角度分析,其主要原因是
,从电子排布的角度分析,其主要原因是___________ 。
(2) 可形成
可形成 ,其中en代表
,其中en代表 。该化合物分子中,VSEPR模型为四面体的非金属原子共有
。该化合物分子中,VSEPR模型为四面体的非金属原子共有___________ 个;C、N、B的电负性由小到大的顺序为___________ 。
(3)基态 的核外电子排布式为
的核外电子排布式为___________ ; 常温下为无色液体,写出两种与CO互为等电子体离子的化学式
常温下为无色液体,写出两种与CO互为等电子体离子的化学式___________ 、___________ 。
(4)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为___________ ;该晶体的化学式为___________ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点、B点原子的分数坐标分别为 、
、 ,则c点原子的分数坐标为
,则c点原子的分数坐标为___________ ;晶胞中C、D间距离d=___________ pm。
(1)基态Fe原子的核外电子中,两种自旋状态的电子数之比为
 ,从电子排布的角度分析,其主要原因是
,从电子排布的角度分析,其主要原因是(2)
 可形成
可形成 ,其中en代表
,其中en代表 。该化合物分子中,VSEPR模型为四面体的非金属原子共有
。该化合物分子中,VSEPR模型为四面体的非金属原子共有(3)基态
 的核外电子排布式为
的核外电子排布式为 常温下为无色液体,写出两种与CO互为等电子体离子的化学式
常温下为无色液体,写出两种与CO互为等电子体离子的化学式(4)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为
 、
、 ,则c点原子的分数坐标为
,则c点原子的分数坐标为
您最近一年使用:0次
解题方法
9 . 近年来,我国半导体材料市场发展迅速,其中以氮化嫁、碳化硅、氧化锌、金刚石等为主的材料备受关注。回答下列问题:
(1)基态Ga原子的价电子轨道表示式为___________ ,基态N原子核外电子有___________ 种空间运动状态。Zn在元素周期表中位于___________ 区。
(2)C,N、O的第一电离能由大到小的顺序为___________ 。 的空间结构为
的空间结构为___________ 。
(3)SiC的立方晶胞结构如图1所示,已知;1号C原子的坐标参数为( ,
, ,
, ),晶胞参数为apm。则晶胞中2号C原子的坐标参数为
),晶胞参数为apm。则晶胞中2号C原子的坐标参数为___________ ,C和Si原子的最短距离为___________ pm。
①GaN晶体中N原子的杂化轨道类型为___________ 。
②GaN晶体的密度为___________ g/cm3(列出计算式,用含b、c、NA的代数式表示)。
(1)基态Ga原子的价电子轨道表示式为
(2)C,N、O的第一电离能由大到小的顺序为
 的空间结构为
的空间结构为(3)SiC的立方晶胞结构如图1所示,已知;1号C原子的坐标参数为(
 ,
, ,
, ),晶胞参数为apm。则晶胞中2号C原子的坐标参数为
),晶胞参数为apm。则晶胞中2号C原子的坐标参数为
①GaN晶体中N原子的杂化轨道类型为
②GaN晶体的密度为
您最近一年使用:0次
10 . 镓 、铟
、铟 都是典型的稀有分散元素。回答下列问题:
都是典型的稀有分散元素。回答下列问题:
(1)基态 原子的核外价电子排布式为
原子的核外价电子排布式为_____ ,最高能级电子的电子云形状为_____ 。
(2)一种含镓药物的合成方法如图所示: 原子的杂化方式为
原子的杂化方式为_____ , 化合物
化合物 中含有的
中含有的 键的物质的量为
键的物质的量为_____ 。化合物Ⅰ中所含元素的电负性由大到小的顺序为_____ (用元素符号表示)。
②化合物Ⅱ中 的配位数为
的配位数为_____ ,
_____ 。
(3)一种由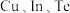 组成的晶体属四方晶系,晶胞棱边夹角均为
组成的晶体属四方晶系,晶胞棱边夹角均为 ,其晶胞结构如图。
,其晶胞结构如图。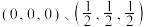 。则C点原子的分数坐标为
。则C点原子的分数坐标为_____ 。
② 表示阿伏加德罗常数的值,该晶体的密度为
表示阿伏加德罗常数的值,该晶体的密度为_____ (用含 的代数式表示)
的代数式表示) 。
。
 、铟
、铟 都是典型的稀有分散元素。回答下列问题:
都是典型的稀有分散元素。回答下列问题:(1)基态
 原子的核外价电子排布式为
原子的核外价电子排布式为(2)一种含镓药物的合成方法如图所示:

 原子的杂化方式为
原子的杂化方式为 化合物
化合物 中含有的
中含有的 键的物质的量为
键的物质的量为②化合物Ⅱ中
 的配位数为
的配位数为
(3)一种由
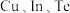 组成的晶体属四方晶系,晶胞棱边夹角均为
组成的晶体属四方晶系,晶胞棱边夹角均为 ,其晶胞结构如图。
,其晶胞结构如图。
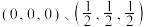 。则C点原子的分数坐标为
。则C点原子的分数坐标为②
 表示阿伏加德罗常数的值,该晶体的密度为
表示阿伏加德罗常数的值,该晶体的密度为 的代数式表示)
的代数式表示) 。
。
您最近一年使用:0次



