名校
1 . 现有A、B、C、D、E、F、G七种短周期主族元素,原子序数依次增大。A与C形成的化合物能使湿润的红色石蕊试纸变蓝;D是地壳中含量最多的元素;D、F原子的最外层电子数相等;E的焰色反应呈黄色;B元素的一种同位素在考古时可用于测定一些文物的年代。
请回答下列问题:(注意回答问题时均用元素符号表示)
(1)元素B在周期表中的位置:___________ 。
(2)元素D与E组成的含非极性键的化合物的电子式:___________ 。元素A与D组成的18电子分子的结构式:___________ 。
(3)写出G的简单阴离子的电子排布式___________ 。
(4)D和F的简单气态氢化物沸点比较高的是:________ (写分子式),原因:________ 。
(5)D、E、F、G的电负性小到大的顺序为___________ (用元素符号表示)。
(6)用电子式表示化合物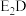 的形成过程:
的形成过程:___________ 。
请回答下列问题:(注意回答问题时均用元素符号表示)
(1)元素B在周期表中的位置:
(2)元素D与E组成的含非极性键的化合物的电子式:
(3)写出G的简单阴离子的电子排布式
(4)D和F的简单气态氢化物沸点比较高的是:
(5)D、E、F、G的电负性小到大的顺序为
(6)用电子式表示化合物
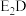 的形成过程:
的形成过程:
您最近一年使用:0次
名校
解题方法
2 . 氢能是一种极具发展潜力的清洁能源,下列物质都是具有广阔应用前景的储氢材料。按要求回答下列问题:
(1)氢化钠( )是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为
)是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为___________ 。
(2)钛系贮氢合金中的钛锰合金具成本低,吸氢量大,室温下易活化等优点,基态钛的价层电子排布式为___________ 。
(3) (氨硼烷)具有很高的储氢容量及相对低的放氢温度(
(氨硼烷)具有很高的储氢容量及相对低的放氢温度(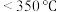 )而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、
)而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、 与
与 进行合成,则涉及的元素H、B、C、N、O电负性最大的是
进行合成,则涉及的元素H、B、C、N、O电负性最大的是___________ ,键角:
___________  (填“
(填“ ”或“
”或“ ”)。
”)。
(4)咔唑(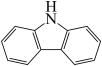 )是一种新型有机液体储氢材料,它的沸点比(
)是一种新型有机液体储氢材料,它的沸点比( )的高,其主要原因是
)的高,其主要原因是___________ 。
(5)氢气的安全贮存和运输是氢能应用的关键,铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。
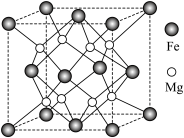
①距离 原子最近的
原子最近的 原子个数是
原子个数是___________ 。
②铁镁合金的化学式为___________ 。
③若该晶胞的晶胞边长为dnm,阿伏加德罗常数为NA,则该合金的密度为___________  。
。
④若该晶体储氢时, 分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下
分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下 的体积约为
的体积约为___________ L。
(1)氢化钠(
 )是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为
)是一种常用的储氢剂,遇水后放出氢气并生成一种碱,该反应的还原剂的电子式为(2)钛系贮氢合金中的钛锰合金具成本低,吸氢量大,室温下易活化等优点,基态钛的价层电子排布式为
(3)
 (氨硼烷)具有很高的储氢容量及相对低的放氢温度(
(氨硼烷)具有很高的储氢容量及相对低的放氢温度(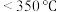 )而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、
)而成为颇具潜力的化学储氢材料之一,它可通过环硼氮烷、 与
与 进行合成,则涉及的元素H、B、C、N、O电负性最大的是
进行合成,则涉及的元素H、B、C、N、O电负性最大的是
 (填“
(填“ ”或“
”或“ ”)。
”)。(4)咔唑(
 )是一种新型有机液体储氢材料,它的沸点比(
)是一种新型有机液体储氢材料,它的沸点比( )的高,其主要原因是
)的高,其主要原因是(5)氢气的安全贮存和运输是氢能应用的关键,铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。

①距离
 原子最近的
原子最近的 原子个数是
原子个数是②铁镁合金的化学式为
③若该晶胞的晶胞边长为dnm,阿伏加德罗常数为NA,则该合金的密度为
 。
。④若该晶体储氢时,
 分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下
分子在晶胞的体心和棱心位置,则含Mg 48g的该储氢合金可储存标准状况下 的体积约为
的体积约为
您最近一年使用:0次
2023-05-25更新
|
343次组卷
|
3卷引用:吉林省长春市第二实验中学2023-2024学年高三上学期9月月考化学试题
解题方法
3 . 氯化亚铜(CuCl)是一种白色粉末,不溶于水和乙醇,在潮湿空气中易水解氧化,常用作有机合成工业中的催化剂。工业上利用硫化铜精矿生产氯化亚铜的一种工艺流程如图所示。

(1)“氧化酸浸”时能提高浸取率的措施有_______ 。(任写两点)
(2)“溶解”时, 被还原为
被还原为 ,该反应的离子方程式为
,该反应的离子方程式为_______ ; 中三种元素的电负性由大到小的顺序为
中三种元素的电负性由大到小的顺序为_______ (填元素符号)。
(3) 中含有
中含有 键和
键和 键,其中
键,其中 键由原子轨道
键由原子轨道_______ 式重叠;“反应”时生成CuCl的化学方程式为_______ 。
(4)“洗涤”时应选用乙醇作洗涤剂,乙醇洗涤的作用是_______ 。
(5)已知:CuCl易溶于 浓度较大的体系中(
浓度较大的体系中(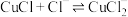 ),
), 水解也可以生成CuCl,温度、pH对CuCl产率的影响如图所示。
水解也可以生成CuCl,温度、pH对CuCl产率的影响如图所示。

根据以上信息,请设计由CuCl、CuO的固体混合物提纯CuCl的实验方案:_______ (实验中须使用的试剂有饱和NaCl溶液、 的
的 溶液、乙醇;除常用仪器外须使用的仪器有真空干燥箱)
溶液、乙醇;除常用仪器外须使用的仪器有真空干燥箱)

(1)“氧化酸浸”时能提高浸取率的措施有
(2)“溶解”时,
 被还原为
被还原为 ,该反应的离子方程式为
,该反应的离子方程式为 中三种元素的电负性由大到小的顺序为
中三种元素的电负性由大到小的顺序为(3)
 中含有
中含有 键和
键和 键,其中
键,其中 键由原子轨道
键由原子轨道(4)“洗涤”时应选用乙醇作洗涤剂,乙醇洗涤的作用是
(5)已知:CuCl易溶于
 浓度较大的体系中(
浓度较大的体系中(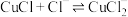 ),
), 水解也可以生成CuCl,温度、pH对CuCl产率的影响如图所示。
水解也可以生成CuCl,温度、pH对CuCl产率的影响如图所示。
根据以上信息,请设计由CuCl、CuO的固体混合物提纯CuCl的实验方案:
 的
的 溶液、乙醇;除常用仪器外须使用的仪器有真空干燥箱)
溶液、乙醇;除常用仪器外须使用的仪器有真空干燥箱)
您最近一年使用:0次
2022-12-13更新
|
245次组卷
|
3卷引用:吉林省部分学校2022-2023学年高三上学期12月联考化学试题
解题方法
4 . 高锰酸钾(KMnO4)被广泛用作氧化剂、消毒剂、水处理剂等。回答下列问题:
(1)基态锰原子的价电子排布式是_________ ,含有_________ 个未成对电子。
(2)高锰酸钾中各元素电负性的大小顺序为_________ 。
(3)已知元素Mn与Fe的第三电离能分别为:I3(Mn)=3248kJ/mol、I3(Fe)=2957kJ/mol,I3(Mn)>I3(Fe)的原因是_________ 。
(4)氧与硫位于相同主族,它们的最简单氢化物的沸点较高的是_________ ,其原因是_________ 。过氧化氢中氧原子的杂化方式为_________ 。
(5)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,如图所示。晶胞中K、I、O分别处于顶角、体心、面心位置,晶胞参数为a=0.446nm。

①距离K最近且距离相等的O有_________ 个;
②与I距离最近的O形成的空间构型为_________ 。
③已知A坐标(0,0,0),B坐标(1,1,1),则I的坐标为_________ ;
④与I距离最近的钾为_________ nm(已知 =1.732,计算结果保留小数点后三位有效数字)。
=1.732,计算结果保留小数点后三位有效数字)。
(1)基态锰原子的价电子排布式是
(2)高锰酸钾中各元素电负性的大小顺序为
(3)已知元素Mn与Fe的第三电离能分别为:I3(Mn)=3248kJ/mol、I3(Fe)=2957kJ/mol,I3(Mn)>I3(Fe)的原因是
(4)氧与硫位于相同主族,它们的最简单氢化物的沸点较高的是
(5)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,如图所示。晶胞中K、I、O分别处于顶角、体心、面心位置,晶胞参数为a=0.446nm。

①距离K最近且距离相等的O有
②与I距离最近的O形成的空间构型为
③已知A坐标(0,0,0),B坐标(1,1,1),则I的坐标为
④与I距离最近的钾为
 =1.732,计算结果保留小数点后三位有效数字)。
=1.732,计算结果保留小数点后三位有效数字)。
您最近一年使用:0次
名校
解题方法
5 . 化学在生产、生活和科研中应用广泛。回答下列问题:
(1)基态Ti原子的电子所占据的最高能层符号为_______ ,N、O、Cu的电负性由大到小的顺序是_______ 。
(2)利用TiO2纳米管的光电实验可制备TNT(2,4,6-三硝基甲苯),其结构如图,N原子的杂化类型为_______ 。TNT常温下是固体,而甲苯是液体,原因是_______ 。

(3)GaCl3·xNH3(x=3,4,5,6)是一系列化合物,向含1molGaCl3·xNH3的溶液中加入足量AgNO3溶液,有难溶于硝酸的白色沉淀生成;过滤后,充分加热滤液,有 4mol氨气逸出,且又有上述沉淀生成,两次沉淀的物质的量之比为1:2。
①NH3的VSEPR模型为_______ 。
②GaCl3·xNH3含有的化学键类型有_______ (填序号)。
A极性共价键 B.配位键 C.金属键 D.氢键
③能准确表示GaCl3·xNH3结构的化学式为_______ 。
(4)具有双钙钛矿型结构的晶体通过掺杂改性可用作固体电解质材料。双钙钛矿型晶体的一种典型结构单元如图所示:
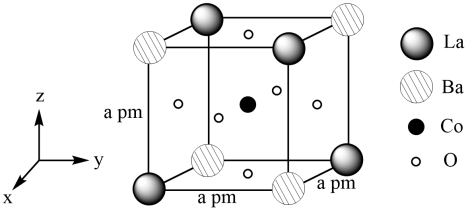
①该晶体的一个完整晶胞中含有_______ 个 Co原子
②真实的晶体中存在5%的O原子缺陷,从而能让O2−在其中传导,已知La为+3价,Ba为+2价,则+3价Co与+4价Co的原子个数比为_______ ,设阿伏加德罗常数为NA,则晶体的密度为_______ g/cm3。
(1)基态Ti原子的电子所占据的最高能层符号为
(2)利用TiO2纳米管的光电实验可制备TNT(2,4,6-三硝基甲苯),其结构如图,N原子的杂化类型为

(3)GaCl3·xNH3(x=3,4,5,6)是一系列化合物,向含1molGaCl3·xNH3的溶液中加入足量AgNO3溶液,有难溶于硝酸的白色沉淀生成;过滤后,充分加热滤液,有 4mol氨气逸出,且又有上述沉淀生成,两次沉淀的物质的量之比为1:2。
①NH3的VSEPR模型为
②GaCl3·xNH3含有的化学键类型有
A极性共价键 B.配位键 C.金属键 D.氢键
③能准确表示GaCl3·xNH3结构的化学式为
(4)具有双钙钛矿型结构的晶体通过掺杂改性可用作固体电解质材料。双钙钛矿型晶体的一种典型结构单元如图所示:

①该晶体的一个完整晶胞中含有
②真实的晶体中存在5%的O原子缺陷,从而能让O2−在其中传导,已知La为+3价,Ba为+2价,则+3价Co与+4价Co的原子个数比为
您最近一年使用:0次
名校
6 . 铝离子电池能量密度高、成本低且安全性高,是有前景的下一代储能电池。铝离子电池一般采用离子液体作为电解质,几种离子液体的结构如下。
(1)基态铝原子的核外电子排布式为___________ 。
(2)基态氮原子的价层电子排布图为___________(填编号)。
(3)化合物I中碳原子的杂化轨道类型为___________ ,化合物II中阳离子的空间构型为___________ 。
(4)化合物III中O、F、S电负性由大到小的顺序为___________ 。
(5)传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是___________ 。
(6)铝离子电池的其中一种正极材料为AlMn2O4,其晶胞中铝原子的骨架如图所示。___________ 。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,如图中原子1的坐标为( ,
, ,
, ),原子2的坐标为(
),原子2的坐标为( ,
, ,
, ),则原子3的坐标为
),则原子3的坐标为_____ 。
③已知该晶体属于立方晶系,晶胞参数为apm,阿伏加德罗常数的值为NA,则晶体的密度为______ g·cm-3(列出计算式)。
(1)基态铝原子的核外电子排布式为
(2)基态氮原子的价层电子排布图为___________(填编号)。
A.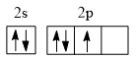 | B.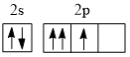 | C.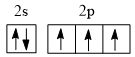 | D.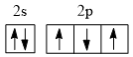 |
(4)化合物III中O、F、S电负性由大到小的顺序为
(5)传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是
(6)铝离子电池的其中一种正极材料为AlMn2O4,其晶胞中铝原子的骨架如图所示。
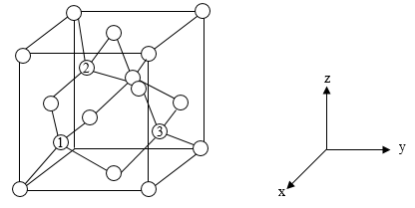
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,如图中原子1的坐标为(
 ,
, ,
, ),原子2的坐标为(
),原子2的坐标为( ,
, ,
, ),则原子3的坐标为
),则原子3的坐标为③已知该晶体属于立方晶系,晶胞参数为apm,阿伏加德罗常数的值为NA,则晶体的密度为
您最近一年使用:0次
2022-03-17更新
|
2757次组卷
|
10卷引用:吉林省长春市吉林省实验中学2022届高三最后一次模拟考试理综化学试题
吉林省长春市吉林省实验中学2022届高三最后一次模拟考试理综化学试题广东省广州市2022届高三一模考试化学试题(已下线)必刷卷01-2022年高考化学考前信息必刷卷(全国乙卷)(已下线)回归教材重难点11 物质结构与性质(选考)-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)江西省新余市2022届高三第二次模拟考试理综化学试题(已下线)广东省广州市2022届高三一模考试(结构与性质)广东省广州市2021-2022学年高三下学期一模考试化学试题2024届四川省兴文第二中学校高三上学期一诊模拟考试理综试题(已下线)热点25 物质结构与性质综合题广东省广州市第六中学2023-2024学年高二下学期期中考试化学试题
7 . Li、Fe、As、Zn等均为重要的合金材料,回答下列问题
(1)Li的焰色反应为紫红色,很多金属元素能产生焰色反应的原因是_______
(2)KSCN和K4[Fe(CN)6]常用于检验Fe3+,SCN-的立体构型为_______ ,K4[Fe(CN)6]中所含元素电负性由大到小的顺序为_______ 。
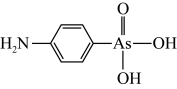
(3)H3AsO3的酸性弱于H3AsO4的原因为_______ 。 含砷有机物“对氨基苯胂酸”的结构简式如图,As原子轨道杂化类型为_______ ,lmol对氨基苯胂酸含 键数目为
键数目为_______ 。
(4)锌和镉位于同一副族,而锌与铜相邻。现有4种铜、锌元素的相应状态,
①锌:[Ar]3dl04s2、②锌:[Ar]3dl04s1、③铜:[Ar]3d104s1、 ④铜: [Ar]3d10失去1个电子需要的能量由大到小排序是_______(填字母)。
(5)Li2O为离子晶体,具有反萤石结构,晶胞如下图所示。则O2-配位数为_______ ,若晶胞参数为bnm,阿伏加德罗常数的值为NA,则Li2O的密度为_______ g·cm-3(列出计算式即可)。

(1)Li的焰色反应为紫红色,很多金属元素能产生焰色反应的原因是
(2)KSCN和K4[Fe(CN)6]常用于检验Fe3+,SCN-的立体构型为
(3)H3AsO3的酸性弱于H3AsO4的原因为
 键数目为
键数目为
(4)锌和镉位于同一副族,而锌与铜相邻。现有4种铜、锌元素的相应状态,
①锌:[Ar]3dl04s2、②锌:[Ar]3dl04s1、③铜:[Ar]3d104s1、 ④铜: [Ar]3d10失去1个电子需要的能量由大到小排序是_______(填字母)。
| A.④②①③ | B.④②③① | C.①②④③ | D.①④③② |

您最近一年使用:0次
名校
解题方法
8 . 钇(Y)是一种用途广泛的金属,是稀土元素之一,钇钡铜氧化物是一种高温超导材料。回答下列问题:
(1)钇的原子序数为39,其基态原子的外围电子排布式为________ ;钡、铜的焰色对应的辐射波长Ba____ Cu(填“大于”或“小于”)。
(2)(C4H9O)3PO(磷酸三丁酯)是一种提炼稀土常用的萃取剂,其四种组成元素中,电负性最大的是______ ;(C4H9O)3PO中P原子的轨道杂化类型为______ 。
(3)Y和Cu都可形成配合物。向CuSO4溶液中滴加氨水,先生成蓝色沉淀,后蓝色沉淀溶解得到[Cu(NH3)4]SO4深蓝色透明溶液。若[Cu(NH3)4]2+中的两个NH3被两个NH2R替换,得到两种不同构型的产物,则[Cu(NH3)4]2+的空间构型为_____ ,其判断理由是_______ ;若向[Cu(NH3)4]SO4溶液中加入乙醇,将析出深蓝色晶体,[Cu(NH3)4]SO4难溶于乙醇的原因可能是____________ .
(4)某种由Y、Ba、Cu、O构成的超导化合物的晶胞结构如图所示。
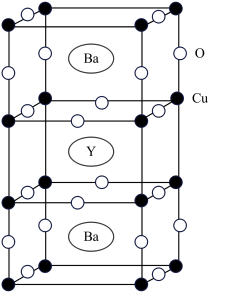
①该化合物中,Y、Ba的化合价分别为+3、+2,Cu的平均化合价为_________ 。
②已知:晶胞参数为a=381.7 pm、b=388.3 pm、c=1163.3 pm,α=β=γ=90°,设NA为阿伏加德罗常数的值,则该晶体的密度为______ g.cm-3(列出计算式即可)。
(1)钇的原子序数为39,其基态原子的外围电子排布式为
(2)(C4H9O)3PO(磷酸三丁酯)是一种提炼稀土常用的萃取剂,其四种组成元素中,电负性最大的是
(3)Y和Cu都可形成配合物。向CuSO4溶液中滴加氨水,先生成蓝色沉淀,后蓝色沉淀溶解得到[Cu(NH3)4]SO4深蓝色透明溶液。若[Cu(NH3)4]2+中的两个NH3被两个NH2R替换,得到两种不同构型的产物,则[Cu(NH3)4]2+的空间构型为
(4)某种由Y、Ba、Cu、O构成的超导化合物的晶胞结构如图所示。

①该化合物中,Y、Ba的化合价分别为+3、+2,Cu的平均化合价为
②已知:晶胞参数为a=381.7 pm、b=388.3 pm、c=1163.3 pm,α=β=γ=90°,设NA为阿伏加德罗常数的值,则该晶体的密度为
您最近一年使用:0次
2022-03-10更新
|
530次组卷
|
4卷引用:吉林市第一中学2021-2022学年高三下学期4月教学质量检测理科综合化学试题
吉林市第一中学2021-2022学年高三下学期4月教学质量检测理科综合化学试题云南省昆明一中、宁夏银川一中2021-2022学年高三下学期联合考试一模理科综合化学试题(已下线)二轮拔高卷6-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)黑龙江省齐齐哈尔市第一中学校2022届高三下学期二模理科综合化学试题
名校
解题方法
9 . 硼、碳、氮、磷、硫等元素形成的单质和化合物在生活、生产中有重要的用途。
(1)下列氮原子的电子排布图表示的状态中,能量由低到高的顺序是___________ (填字母)。
A. B.
B.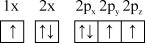
C.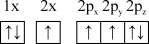 D.
D.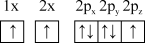
(2)氢、硼、碳、硫四元素的电负性由大到小的顺序为___________
(3)(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子的最外层均满足8电子稳定结构,其结构式为___________ 。其σ键分别为___________ 型σ键。
(4)直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,其结构如图所示。则由n个磷氧四面体形成的这类磷酸根离子的通式为___________

(5)碳酸盐中的阳离子不同,热分解温度就不同。下表为四种碳酸盐的热分解温度和对应金属阳离子的半径。随着金属阳离子半径的增大,碳酸盐的热分解温度逐渐升高,原因是___________
(6)氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性 (晶体结构如图)。
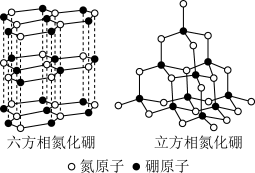
①关于这两种晶体的说法,不正确的是___________ (填字母)。
a.两种晶体均为分子晶体
b.两种晶体中的B﹣N键均为共价键
c.六方相氮化硼层间作用力小,所以质地软
d.立方相氮化硼含有σ键和π键,所以硬度大
②六方相氮化硼晶体其结构与石墨相似却不导电,原因是___________
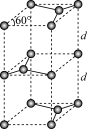
(7)石墨的晶胞结构如图所示。已知石墨的密度为ρg·cm-3,C-C键的键长为r cm,NA为阿伏加德罗常数的值,则石墨晶体的层间距d=___________ cm。
(1)下列氮原子的电子排布图表示的状态中,能量由低到高的顺序是
A.
 B.
B.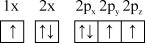
C.
 D.
D.
(2)氢、硼、碳、硫四元素的电负性由大到小的顺序为
(3)(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子的最外层均满足8电子稳定结构,其结构式为
(4)直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,其结构如图所示。则由n个磷氧四面体形成的这类磷酸根离子的通式为

(5)碳酸盐中的阳离子不同,热分解温度就不同。下表为四种碳酸盐的热分解温度和对应金属阳离子的半径。随着金属阳离子半径的增大,碳酸盐的热分解温度逐渐升高,原因是
| 碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
| 热分解温度/℃ | 402 | 900 | 1172 | 1360 |
| 金属阳离子半径/pm | 66 | 99 | 112 | 135 |

①关于这两种晶体的说法,不正确的是
a.两种晶体均为分子晶体
b.两种晶体中的B﹣N键均为共价键
c.六方相氮化硼层间作用力小,所以质地软
d.立方相氮化硼含有σ键和π键,所以硬度大
②六方相氮化硼晶体其结构与石墨相似却不导电,原因是
(7)石墨的晶胞结构如图所示。已知石墨的密度为ρg·cm-3,C-C键的键长为r cm,NA为阿伏加德罗常数的值,则石墨晶体的层间距d=

您最近一年使用:0次
2021-05-24更新
|
320次组卷
|
2卷引用:吉林省长春外国语学校2022届高三上学期期初考试化学试题
解题方法
10 . 卤族元素是重要的非金属元素,用途广泛。回答下列问题:
(1)卤族元素位于元素周期表___________ 区,其中电负性最大的是___________ (填元素符号)。
(2)基态氟原子核外有___________ 种运动状态不同的电子,其中含有单电子的轨道形状为___________ 。
(3)溴元素对应的含氧酸 HBrO4酸性比 HBrO3酸性___________ (填“强”或“弱”),原因是___________ 。
(4)化合物 I3 AsF6为离子化合物,其中阳离子(I )中心原子的杂化方式为
)中心原子的杂化方式为___________ 。该晶体中不含有的化学键类型为___________ (填选项字母)。
a.配位键 b.金属键 c.极性键 d.非极性键
(5)由钾、氧、碘三种元素构成的晶体晶胞结构如图1所示。则该晶体的化学式为___________ ,晶胞中位置与 K+紧邻的 O 的个数为___________ 。
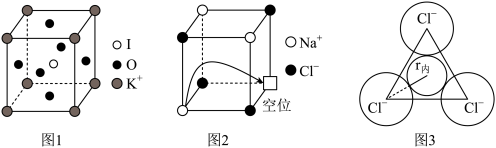
(6)有“点缺陷”的 NaCl 晶体可导电,其结构如图 2 所示。有人认为:高温下有“点缺陷”的 NaCl 晶体能导电,是因为 Na+经过一个由 3 个 Cl-组成的最小三角形窗孔(如图 3 所示),迁移到另一空位而造成的。已知立方体边长 a=282pm,粒子半径 r(Na+)=115pm,r(Cl-)=167pm,计算内切圆半径 r内的值并判断该观点是否正确___________ 。(已知: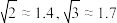 )
)
(1)卤族元素位于元素周期表
(2)基态氟原子核外有
(3)溴元素对应的含氧酸 HBrO4酸性比 HBrO3酸性
(4)化合物 I3 AsF6为离子化合物,其中阳离子(I
 )中心原子的杂化方式为
)中心原子的杂化方式为a.配位键 b.金属键 c.极性键 d.非极性键
(5)由钾、氧、碘三种元素构成的晶体晶胞结构如图1所示。则该晶体的化学式为

(6)有“点缺陷”的 NaCl 晶体可导电,其结构如图 2 所示。有人认为:高温下有“点缺陷”的 NaCl 晶体能导电,是因为 Na+经过一个由 3 个 Cl-组成的最小三角形窗孔(如图 3 所示),迁移到另一空位而造成的。已知立方体边长 a=282pm,粒子半径 r(Na+)=115pm,r(Cl-)=167pm,计算内切圆半径 r内的值并判断该观点是否正确
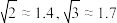 )
)
您最近一年使用:0次



