1 . 新型单环 -内酰胺类降脂药物H的合成路线如下:
-内酰胺类降脂药物H的合成路线如下:
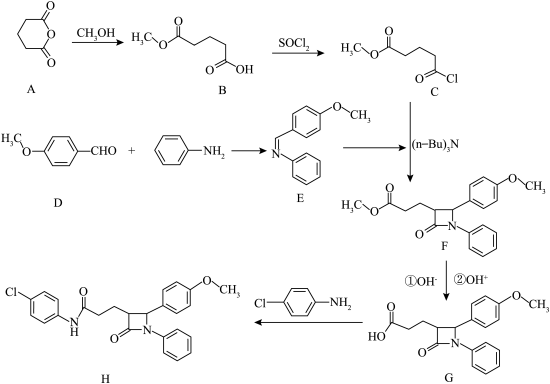
回答下列有关问题:
(1)D的化学名称是_______ 。
(2)A中H、C和O的电负性由大到小的顺序为_______ 。
(3) 中官能团名称是
中官能团名称是_______ 。
(4)G→H的反应类型是_______ 。
(5)C与E反应生成F的化学反应方程式为_______ 。
(6)写出同时满足下列条件的B的所有同分异构体的结构简式为_______ 。
①能发生银镜反应;②能与 反应放出气体;③1molB最多能与2molNaOH反应;④核磁共振氢谱显示为4组峰,且峰面积比为1∶1∶2∶6。
反应放出气体;③1molB最多能与2molNaOH反应;④核磁共振氢谱显示为4组峰,且峰面积比为1∶1∶2∶6。
(7)某药物中间体的合成线路如下(部分反应条件已省略),其中M和N的结构简式分别为_______ 和_______ 。
 -内酰胺类降脂药物H的合成路线如下:
-内酰胺类降脂药物H的合成路线如下:
回答下列有关问题:
(1)D的化学名称是
(2)A中H、C和O的电负性由大到小的顺序为
(3)
 中官能团名称是
中官能团名称是(4)G→H的反应类型是
(5)C与E反应生成F的化学反应方程式为
(6)写出同时满足下列条件的B的所有同分异构体的结构简式为
①能发生银镜反应;②能与
 反应放出气体;③1molB最多能与2molNaOH反应;④核磁共振氢谱显示为4组峰,且峰面积比为1∶1∶2∶6。
反应放出气体;③1molB最多能与2molNaOH反应;④核磁共振氢谱显示为4组峰,且峰面积比为1∶1∶2∶6。(7)某药物中间体的合成线路如下(部分反应条件已省略),其中M和N的结构简式分别为

您最近一年使用:0次
名校
解题方法
2 . Cu是一种重要的金属元素,许多铜的化合物在医药、工农业生产中有重要作用。回答下列问题:
(1)基态Cu原子的价电子排布式为___________ ;比较Cu2+和Zn2+稳定性并分析原因:___________ 。
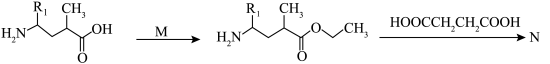
(2)一种铜的配合物结构如图1所示,其对肿瘤有明显的抑制作用,该配合物中几种非金属元素的电负性由大到小的顺序为___________ ,配位原子的杂化方式为___________ 。

(3)金属铜单独与氨水或过双氧水都不反应,但可与氨气和双氧水的混合溶液反应,其原因___________ 。
(4)NH3分子中H-N-H键角为107° ,在[Cu(NH3)4]2+中的H-N-H键角为109.5° ,键角变大的原因是___________ 。
(5)Cu2O 晶体结构与CsCl (图2)相似,只是利用Cu4O占据CsCl晶体中C1的位置,而Cs位置由O原子占据,如图3所示,每个Cu2O晶胞中有___________ 个 “Cu2O”;Cu2O晶胞中Cu的配位数是___________ ;若①处Cu原子坐标为( ,
, ,
, ),则Cu2O晶胞中Cu4O四面体中O原子坐标为
),则Cu2O晶胞中Cu4O四面体中O原子坐标为___________ 。

(1)基态Cu原子的价电子排布式为
(2)一种铜的配合物结构如图1所示,其对肿瘤有明显的抑制作用,该配合物中几种非金属元素的电负性由大到小的顺序为

(3)金属铜单独与氨水或过双氧水都不反应,但可与氨气和双氧水的混合溶液反应,其原因
(4)NH3分子中H-N-H键角为107° ,在[Cu(NH3)4]2+中的H-N-H键角为109.5° ,键角变大的原因是
(5)Cu2O 晶体结构与CsCl (图2)相似,只是利用Cu4O占据CsCl晶体中C1的位置,而Cs位置由O原子占据,如图3所示,每个Cu2O晶胞中有
 ,
, ,
, ),则Cu2O晶胞中Cu4O四面体中O原子坐标为
),则Cu2O晶胞中Cu4O四面体中O原子坐标为
您最近一年使用:0次
2022-06-05更新
|
416次组卷
|
3卷引用:安徽省江淮名校2022届高三下学期5月联考理科综合化学试题
安徽省江淮名校2022届高三下学期5月联考理科综合化学试题(已下线)专题17 物质结构与性质综合题-备战2023年高考化学母题题源解密(全国通用)内蒙古自治区鄂尔多斯市第一中学2023-2024学年高三上学期12月阶段性测试理科综合试题
名校
解题方法
3 . 2022年春晚节目《只此青绿》取材于宋代名画《千里江山图》,该画描绘了山清水秀的美丽景色,历经千年色彩依然,其中青色来自蓝铜矿颜料[主要成分为Cu3(CO3)2(OH)2]。请回答下列问题:
(1)基态铜原子价电子排布式为_______ 。从原子结构角度分析,第二电离能I2(Fe)与I2(Cu)的关系是I2(Fe)_______ I2(Cu) (填“>”“<”或“=”),并解释有关原因_______ 。
(2) 的空间构型为
的空间构型为_______ 。
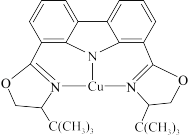
(3)我国科学家制取了一种铜的配合物如图所示,该配合物中四种非金属元素电负性由大到小的顺序是_______ (填元素符号),该配合物中采用sp2杂化的碳原子与sp3杂化的碳原子个数比为_______ 。
(4)黄铜矿是主要的炼铜原料,晶胞结构如下图1所示,晶胞中S原子的投影位置如图2所示。
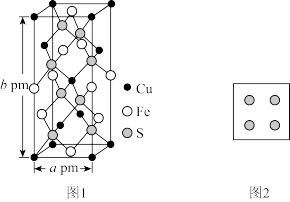
①Fe3+周围距离最近的S2-的个数为_______ 。
②该晶胞上下底面均为正方形,侧面与底面垂直,晶胞参数如图所示,晶胞的密度为ρ g/cm3,则阿伏加德罗常数(NA)为_______ mol-1(用a、b、ρ表示,并化成最简)。
(1)基态铜原子价电子排布式为
(2)
 的空间构型为
的空间构型为(3)我国科学家制取了一种铜的配合物如图所示,该配合物中四种非金属元素电负性由大到小的顺序是

(4)黄铜矿是主要的炼铜原料,晶胞结构如下图1所示,晶胞中S原子的投影位置如图2所示。

①Fe3+周围距离最近的S2-的个数为
②该晶胞上下底面均为正方形,侧面与底面垂直,晶胞参数如图所示,晶胞的密度为ρ g/cm3,则阿伏加德罗常数(NA)为
您最近一年使用:0次
2022-05-04更新
|
736次组卷
|
4卷引用:安徽省淮北市2022届高三第二次模拟考试理科综合化学试题
安徽省淮北市2022届高三第二次模拟考试理科综合化学试题(已下线)专项17 物质结构与性质综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)山东省菏泽市单县第二中学2021-2022学年高二下学期慧光班段考化学试题四川省南充高级中学2021-2022学年高二下学期期中考试化学试题
4 . 四羰基镍[Ni(CO)4]主要用于制高纯镍粉,也用于制造塑料中间体。回答下列问题:
(1)Ni在周期表中的位置_______ 。Ni基态原子排布式中3d能级上未成对电子数为_______
(2)Ni(CO)4中三种元素电负性由小到大的顺序为_______
(3)Ni(CO)4为正四面体的配合物。它不溶于水,易溶于乙醇、乙醚等有机溶剂,原因是_______ 。1 mol Ni(CO)4中含有_______ mol σ键。
(4)已知碳的一种单质结构如图1所示,层间距离为335 pm,层内的碳原子的核间距为142 pm。
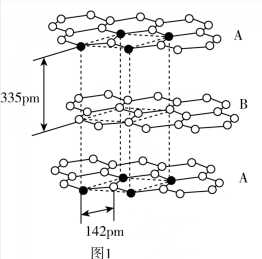
①该单质的晶体类型为_______
②从图1中取出该物质的晶胞如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。例如图2中原子1的坐标为(0,0,0),原子2的坐标为(1,1,1),则原子3和原子4的坐标分别为_______ 、_______ 。
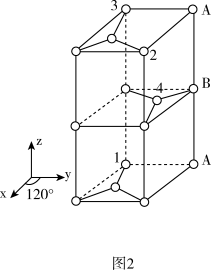
③根据图1中所给的数据,阿伏加德罗常数的值为NA,石墨的密度为_______ g/cm3。(列出计算式)
(1)Ni在周期表中的位置
(2)Ni(CO)4中三种元素电负性由小到大的顺序为
(3)Ni(CO)4为正四面体的配合物。它不溶于水,易溶于乙醇、乙醚等有机溶剂,原因是
(4)已知碳的一种单质结构如图1所示,层间距离为335 pm,层内的碳原子的核间距为142 pm。

①该单质的晶体类型为
②从图1中取出该物质的晶胞如图2所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标。例如图2中原子1的坐标为(0,0,0),原子2的坐标为(1,1,1),则原子3和原子4的坐标分别为

③根据图1中所给的数据,阿伏加德罗常数的值为NA,石墨的密度为
您最近一年使用:0次
名校
5 . 非线性光学晶体在信息、激光技术、医疗、国防等领域具有重要应用价值。我国科学家利用 、
、 (
( )和
)和 首次合成了组成为
首次合成了组成为 的非线性光学晶体。回答下列问题:(已知
的非线性光学晶体。回答下列问题:(已知 和
和 在同主族,且
在同主族,且 在第四周期)
在第四周期)
(1) 、
、 、
、 三种元素电负性由大到小的顺序为
三种元素电负性由大到小的顺序为_______ ;第一电离能
_______  (填“>”或“<”)。
(填“>”或“<”)。
(2)基态 原子核外电子排布式为
原子核外电子排布式为_______ ; 、
、 具有类似的晶体结构,其中熔点较高的是
具有类似的晶体结构,其中熔点较高的是_______ 。
(3)如下图为 晶体的片层结构,其中
晶体的片层结构,其中 的杂化方式为
的杂化方式为_______ ;硼酸在热水中比在冷水中溶解度显著增大的主要原因是(从硼酸晶体结构角度解释)________ 。

(4) 是目前正在开发的锂离子电池的新型固体电解质,其晶胞结构如图所示,已知晶胞参数apm。(提示:
是目前正在开发的锂离子电池的新型固体电解质,其晶胞结构如图所示,已知晶胞参数apm。(提示: )
)

①晶胞中含有的 个数为
个数为___________ 。
②设 为阿伏加德罗常数的值,
为阿伏加德罗常数的值, 的晶胞密度为
的晶胞密度为___________  (列出计算式)。
(列出计算式)。
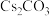 、
、 (
( )和
)和 首次合成了组成为
首次合成了组成为 的非线性光学晶体。回答下列问题:(已知
的非线性光学晶体。回答下列问题:(已知 和
和 在同主族,且
在同主族,且 在第四周期)
在第四周期)(1)
 、
、 、
、 三种元素电负性由大到小的顺序为
三种元素电负性由大到小的顺序为
 (填“>”或“<”)。
(填“>”或“<”)。(2)基态
 原子核外电子排布式为
原子核外电子排布式为 、
、 具有类似的晶体结构,其中熔点较高的是
具有类似的晶体结构,其中熔点较高的是(3)如下图为
 晶体的片层结构,其中
晶体的片层结构,其中 的杂化方式为
的杂化方式为
(4)
 是目前正在开发的锂离子电池的新型固体电解质,其晶胞结构如图所示,已知晶胞参数apm。(提示:
是目前正在开发的锂离子电池的新型固体电解质,其晶胞结构如图所示,已知晶胞参数apm。(提示: )
)
①晶胞中含有的
 个数为
个数为②设
 为阿伏加德罗常数的值,
为阿伏加德罗常数的值, 的晶胞密度为
的晶胞密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
2022-02-20更新
|
131次组卷
|
2卷引用:安徽省滁州市定远县育才学校2021-2022学年高三下学期第二次月考理科综合化学试题
名校
解题方法
6 . 镁、铜、硼及其化合物在医药、国防、材料领域应用广泛。请回答下列问题:
(1)铜是重要的金属材料铜属于元素周期表中的___________ 区元素,与铜同周期且基态原子最外层未成对电子数与基态铜原子相同的元素有___________ 种。
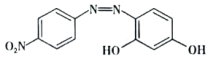
(2)镁元素是人体必需的微量元素,其中起作用的是 。碱性条件下,检验
。碱性条件下,检验 是否存在的化合物被称为“试镁灵”,其结构简式如图所示,其组成元素中第一电离能由大到小的顺序为
是否存在的化合物被称为“试镁灵”,其结构简式如图所示,其组成元素中第一电离能由大到小的顺序为___________ (用元素符号表示),分子中N原子的杂类型为___________ 。
(3)氨硼烷 是一种安全、高效的储氢材料,可由反应
是一种安全、高效的储氢材料,可由反应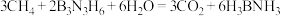 制得。
制得。
①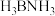 的结构与乙烷相似,
的结构与乙烷相似,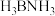 中存在配位键,提供孤电子对形成配位键的原子是
中存在配位键,提供孤电子对形成配位键的原子是___________ (填元素符号)。
② 的空间构型为
的空间构型为___________ , 的键角小于
的键角小于 的键角,原因为
的键角,原因为___________ 。
(4)一种由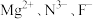 组成的化合物的立方晶胞如图所示:
组成的化合物的立方晶胞如图所示:

①该化合物的化学式为___________ , 的配位数为
的配位数为___________ 。
② 填充在由阴离子构成的八面体空隙中,则八面体空隙的填充率为
填充在由阴离子构成的八面体空隙中,则八面体空隙的填充率为___________  。
。
③若距离最近的两个 的核间距为
的核间距为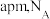 表示阿伏加德罗常数的值,则晶胞密度为
表示阿伏加德罗常数的值,则晶胞密度为___________  。
。
(1)铜是重要的金属材料铜属于元素周期表中的
(2)镁元素是人体必需的微量元素,其中起作用的是
 。碱性条件下,检验
。碱性条件下,检验 是否存在的化合物被称为“试镁灵”,其结构简式如图所示,其组成元素中第一电离能由大到小的顺序为
是否存在的化合物被称为“试镁灵”,其结构简式如图所示,其组成元素中第一电离能由大到小的顺序为
(3)氨硼烷
 是一种安全、高效的储氢材料,可由反应
是一种安全、高效的储氢材料,可由反应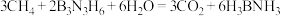 制得。
制得。①
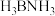 的结构与乙烷相似,
的结构与乙烷相似,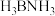 中存在配位键,提供孤电子对形成配位键的原子是
中存在配位键,提供孤电子对形成配位键的原子是②
 的空间构型为
的空间构型为 的键角小于
的键角小于 的键角,原因为
的键角,原因为(4)一种由
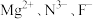 组成的化合物的立方晶胞如图所示:
组成的化合物的立方晶胞如图所示:
①该化合物的化学式为
 的配位数为
的配位数为②
 填充在由阴离子构成的八面体空隙中,则八面体空隙的填充率为
填充在由阴离子构成的八面体空隙中,则八面体空隙的填充率为 。
。③若距离最近的两个
 的核间距为
的核间距为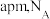 表示阿伏加德罗常数的值,则晶胞密度为
表示阿伏加德罗常数的值,则晶胞密度为 。
。
您最近一年使用:0次
2021-12-25更新
|
748次组卷
|
6卷引用:安徽省百校联盟2021-2022学年高三上学期12月联考化学试题
安徽省百校联盟2021-2022学年高三上学期12月联考化学试题(已下线)解密13 物质结构与性质(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)新疆维吾尔自治区2022届高三第二次诊断性测试(二模)理综化学试题(已下线)回归教材重难点11 物质结构与性质-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)回归教材重难点11 物质结构与性质(选考)-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)湖南省岳阳市一中2021-2022学年高三下学期第三次模拟考试试题
名校
解题方法
7 . 硅因为具有半导体的性质被认为是一种比较特殊的非金属元素,它的单质是硬度较大的非金属单质。铬单质为钢灰色金属,是自然界硬度最大的金属。
(1)若铬的一种同位素原子核内有28个中子,试写出该同位素原子的原子符号,写出基态铬原子的核外电子排布_______ 。
(2)与硅同周期的金属第一电离能由大到小排列:_______ 。与硅同周期的非金属电负性由小到大排列:_______ 。
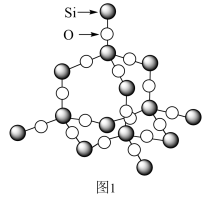
(3)图2为二氧化硅的晶胞示意图,由图可知,二氧化硅是_______ (选填“原子晶体”、“分子晶体”或“离子晶体”,下同)。与硅同主族的元素碳的氧化物干冰是_______ 。1mol二氧化硅晶体所含有的σ键个数为_______ 。1mol的乙炔含有π键的个数为_______ 。
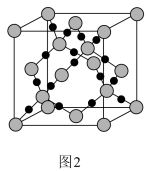
(4)已知二氧化硅的晶胞参数为anm,计算SiO2的密度_______ g/cm3。(列出计算式)

(1)若铬的一种同位素原子核内有28个中子,试写出该同位素原子的原子符号,写出基态铬原子的核外电子排布
(2)与硅同周期的金属第一电离能由大到小排列:
(3)图2为二氧化硅的晶胞示意图,由图可知,二氧化硅是

(4)已知二氧化硅的晶胞参数为anm,计算SiO2的密度
您最近一年使用:0次
名校
8 . (1)Cd与Zn同族且相邻,若Cd基态原子将次外层1个d电子激发进入最外层的np能级,则该激发态原子的外围电子排布式为_______ 。
(2)一水合甘氨酸锌[(H2NCH2COO)2Zn·H2O]是一种饲料添加剂,该化合物中所涉及的 第二周期元素的第一电离能由大到小的顺序是_______ (用元素符号表示);
(3)噻吩(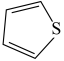 )和吡咯(
)和吡咯(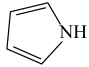 )形成配位化合物。噻吩难溶于水,吡咯能溶于水,原因为:
)形成配位化合物。噻吩难溶于水,吡咯能溶于水,原因为:_______ 。
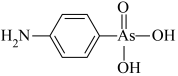
(4)含砷有机物“对氨基苯胂酸”的结构简式如图,As原子轨道杂化类型为_______ ,1mol对氨基苯胂酸含σ键数目为_______
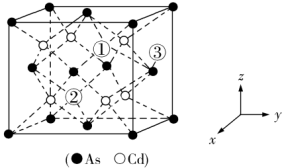
(5)砷化镉可以看作是石墨烯的3D版,其晶胞结构如图,As为面心立方堆积,Cd占据As围成的四面体空隙,空隙占有率75%,故Cd为“具有两个真空的立方晶格”,如图“①”和“②”位是“真空”。建立如图的原子坐标系,①号位的坐标为( ,
, ,
, ),则③号位原子坐标参数为
),则③号位原子坐标参数为_______ 。晶胞参数为apm,阿伏加德罗常数的值为NA,砷化镉的摩尔质量为Mg·mol-1,则该晶胞的密度为_______ g·cm-3(列计算式即可)
(2)一水合甘氨酸锌[(H2NCH2COO)2Zn·H2O]是一种饲料添加剂,该化合物中所涉及的 第二周期元素的第一电离能由大到小的顺序是
(3)噻吩(
 )和吡咯(
)和吡咯( )形成配位化合物。噻吩难溶于水,吡咯能溶于水,原因为:
)形成配位化合物。噻吩难溶于水,吡咯能溶于水,原因为:(4)含砷有机物“对氨基苯胂酸”的结构简式如图,As原子轨道杂化类型为

(5)砷化镉可以看作是石墨烯的3D版,其晶胞结构如图,As为面心立方堆积,Cd占据As围成的四面体空隙,空隙占有率75%,故Cd为“具有两个真空的立方晶格”,如图“①”和“②”位是“真空”。建立如图的原子坐标系,①号位的坐标为(
 ,
, ,
, ),则③号位原子坐标参数为
),则③号位原子坐标参数为
您最近一年使用:0次
2021-06-01更新
|
547次组卷
|
2卷引用:安徽省六校教育研究会2021-2022学年高三下学期第二次联考理综化学试题
9 . 铁的化合物在生活生产中应用广泛。回答下列问题:
(1)基态Fe原子共有___ 种不同能级的电子,Fe2+的核外电子排布式为____ 。
(2)氯化亚铁的熔点为674℃,而氯化铁的熔点仅为282℃,二者熔点存在差异的原因是____ 。
(3)高氯酸三三氮唑合铁(II)的化学式为[Fe(Htrz)3](ClO4)2,其中Htrz为1,2,4-三氮唑( )。
)。
①配合物中非金属元素的电负性最大的是____ ;
②1,2,4-三氮唑分子中碳原子的杂化方式是____ 。含σ键数为___ 个;
③ 的空间构型为
的空间构型为___ 。
(4)某种磁性氮化铁的结构如图所示,Fe原子构成六方最密堆积,N原子随机排列在其正四面体空隙中。

六棱柱底边长为apm,高为cpm,晶体的密度为ρg·cm-3.铁原子半径为___ ,阿伏加德罗常数的值NA为__ 。(列出计算式即可,sin60°=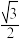 )
)
(1)基态Fe原子共有
(2)氯化亚铁的熔点为674℃,而氯化铁的熔点仅为282℃,二者熔点存在差异的原因是
(3)高氯酸三三氮唑合铁(II)的化学式为[Fe(Htrz)3](ClO4)2,其中Htrz为1,2,4-三氮唑(
 )。
)。①配合物中非金属元素的电负性最大的是
②1,2,4-三氮唑分子中碳原子的杂化方式是
③
 的空间构型为
的空间构型为(4)某种磁性氮化铁的结构如图所示,Fe原子构成六方最密堆积,N原子随机排列在其正四面体空隙中。

六棱柱底边长为apm,高为cpm,晶体的密度为ρg·cm-3.铁原子半径为
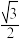 )
)
您最近一年使用:0次
名校
10 . 乙二胺在电刷镀铜溶液中能起到稳定剂的作用。回答下列问题。
(1)基态Cu原子最高能级组电子数为___________ 个。
(2)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子,如图所示:
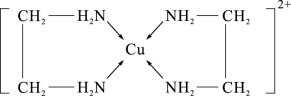
①配离子中含有的化学键类型有___________ 。
②C、N、O的第一电离能由大到小的顺序是___________ 。
③乙二胺分子中氮原子轨道的杂化类型为___________ 。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是___________ 。
(3)温度升高时,NaCl晶体出现缺陷,如图所示(当图中方格内填入Na+时,恰好构成氯化钠晶胞的 ,此时晶体的导电性大大增强,导电性增强的原因
,此时晶体的导电性大大增强,导电性增强的原因___________ ;在氯化钠晶体中两个相邻Cl-之间的间隙小于Na+直径,则___________ 是Na+最可能通过途径迁移到空位处(填图中序号)。
·
(4)某镍白铜合金的立方晶胞结构如图所示。
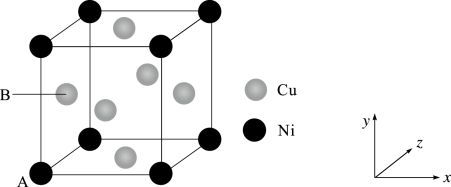
①原子A的原子坐标为(0,0,0),原子B的原子坐标为___________ 。
②若合金的密度为ρg/cm3,Ni原子之间最短距离为___________ nm(列出计算式)。
(1)基态Cu原子最高能级组电子数为
(2)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子,如图所示:

①配离子中含有的化学键类型有
②C、N、O的第一电离能由大到小的顺序是
③乙二胺分子中氮原子轨道的杂化类型为
(3)温度升高时,NaCl晶体出现缺陷,如图所示(当图中方格内填入Na+时,恰好构成氯化钠晶胞的
 ,此时晶体的导电性大大增强,导电性增强的原因
,此时晶体的导电性大大增强,导电性增强的原因·

(4)某镍白铜合金的立方晶胞结构如图所示。

①原子A的原子坐标为(0,0,0),原子B的原子坐标为
②若合金的密度为ρg/cm3,Ni原子之间最短距离为
您最近一年使用:0次
2021-05-07更新
|
985次组卷
|
6卷引用:安徽省宿州市2021届高三下学期第三次模拟考试理综化学试题
安徽省宿州市2021届高三下学期第三次模拟考试理综化学试题(已下线)押全国卷理综第35题 物质结构与性质-备战2021年高考化学临考题号押题(已下线)押山东卷第17题 物质结构与性质综合题-备战2021年高考化学临考题号押题(山东卷)江西省抚州市临川第一中学2021届高考5月模拟考试理综化学试题2021年山东高考化学试题变式题11-202022届江西省赣州市高三适应性考试(二模)理综化学试题



