解题方法
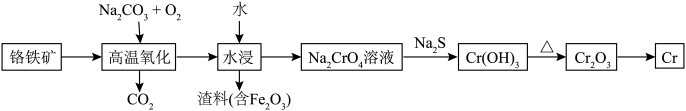
1 . 铬用于制不锈钢、汽车零件、工具、磁带和录像带等,铬铁矿炼铬过程中部分物质之间的转化关系如图。 原子的价电子排布式为
原子的价电子排布式为___________ ,最高能层上的电子占据的原子轨道轮廓图为___________ 形。
(2)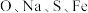 元素的电负性由小到大的顺序是
元素的电负性由小到大的顺序是___________ 。
(3) 的立体构型为
的立体构型为___________ 形,其中C的杂化轨道类型为___________ 。
(4)K和 位于同一周期,且核外最外层电子构型相同,但金属钾的熔点比金属铬低,原因为
位于同一周期,且核外最外层电子构型相同,但金属钾的熔点比金属铬低,原因为___________ 。
(5)将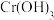 糊状物用盐酸溶解,经过一系列操作可制得
糊状物用盐酸溶解,经过一系列操作可制得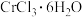 晶体,已知
晶体,已知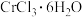 晶体有3种不同颜色,其配位数均为6,实验测得
晶体有3种不同颜色,其配位数均为6,实验测得 不同颜色的晶体分别与足量的硝酸银溶液反应,生成沉淀的物质的量如表所示。
不同颜色的晶体分别与足量的硝酸银溶液反应,生成沉淀的物质的量如表所示。
写出浅绿色晶体配合物的化学式:___________ 。
(6)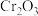 晶体为六方晶系,结构如图所示。图中“
晶体为六方晶系,结构如图所示。图中“ ”代表
”代表___________ (填“ ”或“
”或“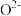 ”)。已知:六棱柱底边边长为
”)。已知:六棱柱底边边长为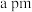 ,高为
,高为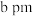 ,
, ,
,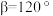 ,
, 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。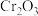 晶体的密度为
晶体的密度为___________  (列出计算式即可)。
(列出计算式即可)。
 原子的价电子排布式为
原子的价电子排布式为(2)
 元素的电负性由小到大的顺序是
元素的电负性由小到大的顺序是(3)
 的立体构型为
的立体构型为(4)K和
 位于同一周期,且核外最外层电子构型相同,但金属钾的熔点比金属铬低,原因为
位于同一周期,且核外最外层电子构型相同,但金属钾的熔点比金属铬低,原因为(5)将
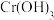 糊状物用盐酸溶解,经过一系列操作可制得
糊状物用盐酸溶解,经过一系列操作可制得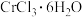 晶体,已知
晶体,已知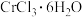 晶体有3种不同颜色,其配位数均为6,实验测得
晶体有3种不同颜色,其配位数均为6,实验测得 不同颜色的晶体分别与足量的硝酸银溶液反应,生成沉淀的物质的量如表所示。
不同颜色的晶体分别与足量的硝酸银溶液反应,生成沉淀的物质的量如表所示。| 晶体颜色 | 深绿色 | 浅绿色 | 紫色 |
 沉淀的物质的量/ 沉淀的物质的量/ | 1 | 2 | 3 |
(6)
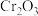 晶体为六方晶系,结构如图所示。图中“
晶体为六方晶系,结构如图所示。图中“ ”代表
”代表 ”或“
”或“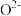 ”)。已知:六棱柱底边边长为
”)。已知:六棱柱底边边长为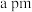 ,高为
,高为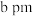 ,
, ,
,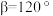 ,
, 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。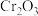 晶体的密度为
晶体的密度为 (列出计算式即可)。
(列出计算式即可)。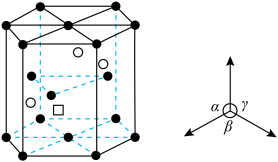
您最近一年使用:0次
解题方法
2 . 羰基钻催化剂可在温和条件下催化氢甲酰化反应,其结构为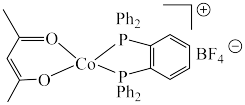 (Ph代表苯基)。回答下列问题:
(Ph代表苯基)。回答下列问题:
(2)羰基钴催化剂中位于第二周期的元素中,电负性由小到大的顺序为
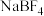 的晶体类型相同,
的晶体类型相同,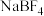 的熔点高于羰基钴催化剂的原因是
的熔点高于羰基钴催化剂的原因是(3)羰基钴催化剂阳离子中Co处于平面四边形中心,羰基钴催化剂中采取
 杂化的元素种数为
杂化的元素种数为 形成羰基钴催化剂过程中,
形成羰基钴催化剂过程中,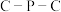 键角
键角(4)一种掺Co催化剂的晶胞结构及晶胞沿面对角线投影如下图所示。晶胞中与Co最近的氧原子所构成的几何形状为
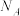 ,晶体的密度为
,晶体的密度为 ,则距离最近的两个氧原子间的距离为
,则距离最近的两个氧原子间的距离为 、
、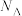 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2024-06-01更新
|
78次组卷
|
2卷引用:2024届青海省西宁市大通县高三下学期三模理科综合试题-高中化学
名校
解题方法
3 . 铜是人类最早使用的金属之一,铜的使用对早期人类文明的进步影响深远。回答下列问题:
(1)基态Cu2+的价电子排布式为___________ 。
(2)已知铜的某种配合物A的结构如图所示:
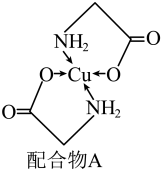
①A中所含的三种元素C、N、O的电负性由大到小的顺序为___________ 。
②配合物中氮原子的杂化轨道类型为___________ 。
③配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2,CO2是___________ (填“极性”或“非极性”)分子。
(3)铜盐是自然界中重要的盐,CuSO4中SO 的立体构型为
的立体构型为___________ ;Cu(NO3)2中的化学键类型为___________ 。
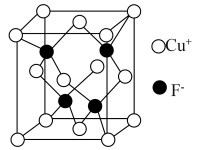
(4)CuF的晶胞结构如图所示。在CuF晶体中距离Cu+最近的F-有___________ 个。已知CuF的密度为7.1g/cm3,则CuF的晶胞参数a=___________ nm(列出计算式)。
(1)基态Cu2+的价电子排布式为
(2)已知铜的某种配合物A的结构如图所示:

①A中所含的三种元素C、N、O的电负性由大到小的顺序为
②配合物中氮原子的杂化轨道类型为
③配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2,CO2是
(3)铜盐是自然界中重要的盐,CuSO4中SO
 的立体构型为
的立体构型为(4)CuF的晶胞结构如图所示。在CuF晶体中距离Cu+最近的F-有

您最近一年使用:0次
2023-12-31更新
|
144次组卷
|
2卷引用:2024届青海省协作联考高三上学期一模理综试题
4 . 磷及其化合物用途广泛。回答下列问题:
(1)基态P原子核外电子的运动状态有___________ 种,其最高能级的电子云轮廓图为___________ 形。
(2)氟磷酸钙也称氟磷灰石,它的化学式为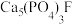 ,是牙釉的主要成分。
,是牙釉的主要成分。
①基态F原子价层电子的轨道表达式为___________ 。
②组成该化合物的四种元素电负性从大到小的顺序为___________ 。
(3)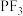 在常温常压下为无色无味的有毒气体,在空气中相当稳定,常用作氟化剂,其与
在常温常压下为无色无味的有毒气体,在空气中相当稳定,常用作氟化剂,其与 的空间结构及相应的键角如图一所示。
的空间结构及相应的键角如图一所示。

①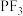 分子中中心原子的杂化方式为
分子中中心原子的杂化方式为___________ 杂化,其空间构型为___________ 。
②稳定性: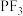
___________ (填“>”“<”或“=”) ;键角:
;键角: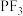 <
< 的原因是
的原因是___________ 。
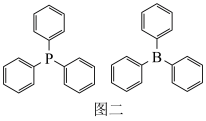
(4)三苯基磷与三苯基硼的结构简式如图二所示。下列说法正确的是___________(填字母)。
(5)磷锗锌晶体是一种红外非线性晶体,其晶胞结构如图所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,图中A点Zn原子的分数坐标为(0,0,0),B点P原子的坐标为(0.25,0.25,0.125)。
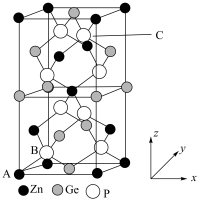
①C点P原子的坐标为___________ 。
②磷锗锌晶体的化学式为___________ 。
(1)基态P原子核外电子的运动状态有
(2)氟磷酸钙也称氟磷灰石,它的化学式为
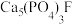 ,是牙釉的主要成分。
,是牙釉的主要成分。①基态F原子价层电子的轨道表达式为
②组成该化合物的四种元素电负性从大到小的顺序为
(3)
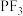 在常温常压下为无色无味的有毒气体,在空气中相当稳定,常用作氟化剂,其与
在常温常压下为无色无味的有毒气体,在空气中相当稳定,常用作氟化剂,其与 的空间结构及相应的键角如图一所示。
的空间结构及相应的键角如图一所示。
①
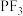 分子中中心原子的杂化方式为
分子中中心原子的杂化方式为②稳定性:
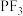
 ;键角:
;键角: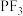 <
< 的原因是
的原因是(4)三苯基磷与三苯基硼的结构简式如图二所示。下列说法正确的是___________(填字母)。

| A.均为极性分子 | B.B、P的杂化方式相同 |
| C.两种分子中所有原子均可共面 | D.三苯基磷的沸点比三苯基硼的高 |
(5)磷锗锌晶体是一种红外非线性晶体,其晶胞结构如图所示。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标,图中A点Zn原子的分数坐标为(0,0,0),B点P原子的坐标为(0.25,0.25,0.125)。

①C点P原子的坐标为
②磷锗锌晶体的化学式为
您最近一年使用:0次
解题方法
5 . “天问一号”着陆火星,“嫦娥五号”采回月壤,探索宇宙离不开化学。镍铼合金是制造喷气发动机的燃烧室、涡轮叶片及排气喷嘴的重要材料。75号元素铼Re,熔点仅次于钨,是稀有金属之一。回答:
(1)在元素周期表中,铼与锰在同族,铼原子价层电子表达式为_____ 。
(2)Ni与CO能形成配合物Ni(CO)4(结构如图1所示),该分子中σ键与π键个数比为_____ 。SO2F2的分子结构如图2所示,键角α1>α2的原因主要是_____ 。
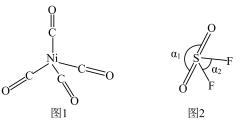
(3)硫酸镍溶于氨水形成[Ni(NH3)4]SO4蓝色溶液,[Ni(NH3)4]SO4中非金属元素H、N、O的电负性由大到小的顺序为_____ ,阴离子 的空间结构是
的空间结构是_____ 。(用文字描述),与 互为等电子体的分子是
互为等电子体的分子是_____ (写一种即可)。
(4)三氧化铼晶胞如图所示,摩尔质量为Mg/mol,晶胞密度为bg/cm3,铼原子配位数为_____ ,铼原子填在氧原子围成的_____ (填“四面体”“立方体"或“八面体”)空隙中,该晶胞的空间利用率为_____ (铼的原子半径为rRepm,氧原子半径为rOpm,列出计算式)。
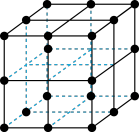
(1)在元素周期表中,铼与锰在同族,铼原子价层电子表达式为
(2)Ni与CO能形成配合物Ni(CO)4(结构如图1所示),该分子中σ键与π键个数比为

(3)硫酸镍溶于氨水形成[Ni(NH3)4]SO4蓝色溶液,[Ni(NH3)4]SO4中非金属元素H、N、O的电负性由大到小的顺序为
 的空间结构是
的空间结构是 互为等电子体的分子是
互为等电子体的分子是(4)三氧化铼晶胞如图所示,摩尔质量为Mg/mol,晶胞密度为bg/cm3,铼原子配位数为
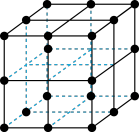
您最近一年使用:0次
解题方法
6 . 硫酸亚铁铵是一种蓝绿色的复盐,俗名为摩尔盐,化学式为(NH4)2Fe(SO4)2•6H2O。它在空气中稳定,是重要的化工原料,用途十分广泛。该物质隔绝空气加强热会发生分解,一种分解方式可表示为:(NH4)2Fe(SO4)2•6H2O=2NH3↑+FeO+2SO3↑+7H2O↑。请回答下列问题:
(1)基态铁原子的价电子排布式为___________ ,s电子的电子云形状为___________ 。
(2)摩尔盐中的组成元素N、O的电负性大小顺序是___________ 。
(3)SO2、SO3、SO 是三种常见含硫微粒。
是三种常见含硫微粒。
①SO 微粒的立体构型为
微粒的立体构型为___________ ,SO2中心原子的杂化方式为___________ 。
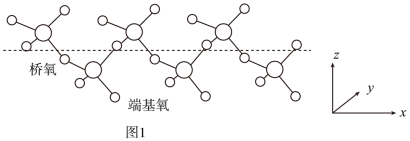
②固态SO3能以无限长链形式存在,结构如图1所示。与硫原子形成化学键更长的是___________ (填“桥氧”或“端基氧”),理由是___________ 。
(4)噻吩( )、吡咯(
)、吡咯(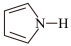 )都可与Fe3+形成配位化合物。在水中的溶解度噻吩
)都可与Fe3+形成配位化合物。在水中的溶解度噻吩___________ 吡咯(填“<”、“>”或“=”),理由是___________ 。
(5)氧化亚铁的一种晶胞与氯化钠晶胞类似,如图2所示。
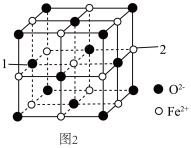
①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图2中原子1的坐标为(0, ,
, ),则原子2的坐标为
),则原子2的坐标为___________ 。
②Fe2+处于O2﹣围成的___________ 空隙中。(填“正四面体”或“正八面体”)
③该晶体的密度为ρg•cm﹣3,用N0表示阿伏加德罗常数的值,则该晶胞边长为___________ pm。
(1)基态铁原子的价电子排布式为
(2)摩尔盐中的组成元素N、O的电负性大小顺序是
(3)SO2、SO3、SO
 是三种常见含硫微粒。
是三种常见含硫微粒。①SO
 微粒的立体构型为
微粒的立体构型为②固态SO3能以无限长链形式存在,结构如图1所示。与硫原子形成化学键更长的是

(4)噻吩(
 )、吡咯(
)、吡咯( )都可与Fe3+形成配位化合物。在水中的溶解度噻吩
)都可与Fe3+形成配位化合物。在水中的溶解度噻吩(5)氧化亚铁的一种晶胞与氯化钠晶胞类似,如图2所示。

①以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图2中原子1的坐标为(0,
 ,
, ),则原子2的坐标为
),则原子2的坐标为②Fe2+处于O2﹣围成的
③该晶体的密度为ρg•cm﹣3,用N0表示阿伏加德罗常数的值,则该晶胞边长为
您最近一年使用:0次
2022-04-15更新
|
334次组卷
|
2卷引用:青海省西宁市2023届高三一模理科综合化学试题
解题方法
7 . 磷及其化合物在工农业生产中都有重要作用。
(1)磷原子核外电子排布式为_______ 。
(2)羟基磷灰石[Ca5(PO4)3OH]是牙齿中的重要矿物质,其中羟基(-OH)中氧原子的杂化方式为_______ , 的空间构型为
的空间构型为_______ ,该化合物中所含元素电负性最大的是_______ 。
(3)磷化硼为立方晶系晶体,该晶胞中原子的分数坐标为:
B:(0,0,0);( ,
, ,0);(
,0);( ,0,
,0, );(0,
);(0, ,
, )……
)……
P:( ,
, ,
, );(
);( ,
, ,
, );(
);( ,
, ,
, );(
);( ,
, ,
, )……
)……
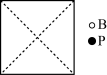
①请在图中画出磷化硼晶胞的俯视图_______ 。
②与每个磷原子紧邻的硼原子有_______ 个,与每个硼原子紧邻的硼原子有_______ 个。
(4)磷钇矿可提取稀土元素钇(Y),某磷钇矿的结构如图所示。该磷钇矿的化学式为_______ ,与 互为等电子体的阴离子有
互为等电子体的阴离子有_______ (写出一种离子符号)。已知晶胞参数a=0.69nm,c=0.60nm,阿伏加德罗常数的值为NA,则该磷钇矿的密度为_______ g·cm-3(列出计算式)。

(1)磷原子核外电子排布式为
(2)羟基磷灰石[Ca5(PO4)3OH]是牙齿中的重要矿物质,其中羟基(-OH)中氧原子的杂化方式为
 的空间构型为
的空间构型为(3)磷化硼为立方晶系晶体,该晶胞中原子的分数坐标为:
B:(0,0,0);(
 ,
, ,0);(
,0);( ,0,
,0, );(0,
);(0, ,
, )……
)……P:(
 ,
, ,
, );(
);( ,
, ,
, );(
);( ,
, ,
, );(
);( ,
, ,
, )……
)……①请在图中画出磷化硼晶胞的俯视图

②与每个磷原子紧邻的硼原子有
(4)磷钇矿可提取稀土元素钇(Y),某磷钇矿的结构如图所示。该磷钇矿的化学式为
 互为等电子体的阴离子有
互为等电子体的阴离子有
您最近一年使用:0次
2021-07-13更新
|
403次组卷
|
3卷引用:青海省西宁市大通回族土族自治县2021届高三下学期高考二模化学试题
青海省西宁市大通回族土族自治县2021届高三下学期高考二模化学试题(已下线)专题35 磷、砷及其化合物-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)湖南省长沙市宁乡市2022届高三下学期5月模拟考试化学试题
解题方法
8 . 第四周期过渡元素单质及其化合物在生活、生产中有广泛应用。回答下列问题:
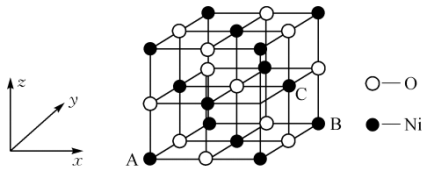
(1)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数是___________ ,配位体NH3的空间构型为___________ 。
(2)NiO的晶体结构如图所示,其中离子坐标参数A为(0,0,0),B为(1,1,0),则C原子的坐标参数为___________ 。
(3)已知TiC在碳化物中硬度最大,工业上一般在真空和高温(>1800℃)条件下用C还原TiO2制取TiC:TiO2+3C TiC+2CO↑。该反应中涉及的元素按电负性由大到小的顺序排列为
TiC+2CO↑。该反应中涉及的元素按电负性由大到小的顺序排列为___________ ;根据所给信息,可知TiC是___________ 晶体。
(4)已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示。
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因:___________ 。
(5)V2O5是一种常见的催化剂,在合成硫酸、硝酸中起到非常重要的作用。五氧化二钒的结构式为(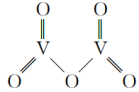 ),则该结构中σ键与π键个数之比为
),则该结构中σ键与π键个数之比为___________ 。V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4)。VO 与PO
与PO 的空间构型相同,其中V原子的杂化方式为
的空间构型相同,其中V原子的杂化方式为___________ 。
(1)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数是
(2)NiO的晶体结构如图所示,其中离子坐标参数A为(0,0,0),B为(1,1,0),则C原子的坐标参数为

(3)已知TiC在碳化物中硬度最大,工业上一般在真空和高温(>1800℃)条件下用C还原TiO2制取TiC:TiO2+3C
 TiC+2CO↑。该反应中涉及的元素按电负性由大到小的顺序排列为
TiC+2CO↑。该反应中涉及的元素按电负性由大到小的顺序排列为(4)已知Zn2+等过渡元素离子形成的水合离子的颜色如下表所示。
| 离子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
| 水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
(5)V2O5是一种常见的催化剂,在合成硫酸、硝酸中起到非常重要的作用。五氧化二钒的结构式为(
 ),则该结构中σ键与π键个数之比为
),则该结构中σ键与π键个数之比为 与PO
与PO 的空间构型相同,其中V原子的杂化方式为
的空间构型相同,其中V原子的杂化方式为
您最近一年使用:0次
解题方法
9 . 氮、磷化合物用途非常广泛,如:磷化硼(BP)、磷青铜(Cu3SnP)等。回答问题:
(1)锡(Sn)是第五周期ⅣA元素。基态锡原子的价电子排布式为_____ 。
(2)PH3分子的空间构型为______ 。PH3的键角小于NH3的原因是_____ 。
(3)羟基磷灰石[Ca5(PO4)3OH]是牙齿中的重要矿物质,其中羟基(-OH)中氧原子的杂化方式为_____ ,该化合物所含元素中电负性最大的是_______ 。
(4)磷酸和亚磷酸(H3PO3)是磷元素的两种含氧酸。亚磷酸与NaOH反应只生成Na2HPO3和NaH2PO3两种盐,则H3PO3的结构式为______ ,其为_____ 元酸,原因是_____ 。
(5)磷化硼(BP)是倍受关注的耐磨材料,可用作金属表面的保护层,其结构与金刚石类似,晶胞结构如图所示。

①磷化硼晶胞沿z轴在平面的投影图中,B原子构成的几何形状是_______ 。
②已知晶胞边长a pm,阿伏加 德罗常数为NA。则磷化硼晶体的密度为_____ g/cm3。
(1)锡(Sn)是第五周期ⅣA元素。基态锡原子的价电子排布式为
(2)PH3分子的空间构型为
(3)羟基磷灰石[Ca5(PO4)3OH]是牙齿中的重要矿物质,其中羟基(-OH)中氧原子的杂化方式为
(4)磷酸和亚磷酸(H3PO3)是磷元素的两种含氧酸。亚磷酸与NaOH反应只生成Na2HPO3和NaH2PO3两种盐,则H3PO3的结构式为
(5)磷化硼(BP)是倍受关注的耐磨材料,可用作金属表面的保护层,其结构与金刚石类似,晶胞结构如图所示。

①磷化硼晶胞沿z轴在平面的投影图中,B原子构成的几何形状是
②已知晶胞边长a pm,阿伏加 德罗常数为NA。则磷化硼晶体的密度为
您最近一年使用:0次
解题方法
10 . 工业上以Ni的氧化物作催化剂,将丙烯氨氧化制得丙烯腈( CH2=CHCN),然后以H3PO4-K3PO4等作为电解质溶液,电解丙烯腈制已二腈。已知总反应的化学方程式为:4CH2=CHCN+2H2O O2↑+2NC(CH2)4CN。
O2↑+2NC(CH2)4CN。
(1)基态Ni原子价层电子的轨道表达式为_______ ;在上述总反应的化学方程式中所涉及到的各元素中,电负性由小到大的顺序为_______ 。
(2)PO43-的空间构型是_______ ,CH2=CHCN中碳原子的杂化方式为_______ 。
(3)NC(CH2)4CN分子中σ键与π键数目之比为_______ 。
(4)已知K3PO4是离子晶体,写出其主要物理性质_____ (写出2条即可)。
(5)反应中核心元素碳有金刚石、石墨等多种同素异形体。设石墨晶体中碳碳键的键长为am,金刚石晶体中碳碳键的键长为bm,则a____ b(填“>”、“=”或“<”),原因________ 。
(6)金刚石的晶胞结构如下图1所示,已知ZnS晶胞与金刚石晶胞微粒排列方式相同,若图中a为Zn2+,则S2-处于ZnS晶胞中的位置为_________ 。

(7)石墨烯中部分碳原子被氧化后,转化为氧化石墨烯(如图2所示)
①石墨烯转化为氧化石墨烯时,1号C与相邻C原子间键能的变化是___ (填“变大”、“变小”“不变”)。
②石墨烯具有很大的比表面积,可用于制超级电容器。若石墨烯中碳碳键的键长为am,12g单层石墨烯的单面理论面积约为_______ m3(列出计算式即可)。
 O2↑+2NC(CH2)4CN。
O2↑+2NC(CH2)4CN。(1)基态Ni原子价层电子的轨道表达式为
(2)PO43-的空间构型是
(3)NC(CH2)4CN分子中σ键与π键数目之比为
(4)已知K3PO4是离子晶体,写出其主要物理性质
(5)反应中核心元素碳有金刚石、石墨等多种同素异形体。设石墨晶体中碳碳键的键长为am,金刚石晶体中碳碳键的键长为bm,则a
(6)金刚石的晶胞结构如下图1所示,已知ZnS晶胞与金刚石晶胞微粒排列方式相同,若图中a为Zn2+,则S2-处于ZnS晶胞中的位置为

(7)石墨烯中部分碳原子被氧化后,转化为氧化石墨烯(如图2所示)
①石墨烯转化为氧化石墨烯时,1号C与相邻C原子间键能的变化是
②石墨烯具有很大的比表面积,可用于制超级电容器。若石墨烯中碳碳键的键长为am,12g单层石墨烯的单面理论面积约为
您最近一年使用:0次



