解题方法
1 . 以电解铝废渣(主要含 、
、 、
、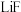 、
、 )为原料,制备电池级碳酸锂的工艺流程如图:
)为原料,制备电池级碳酸锂的工艺流程如图:

已知: 、
、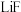 难溶于水,
难溶于水,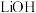 溶于水,
溶于水, 微溶于水,
微溶于水, 、
、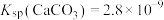 。
。
回答下列问题:
(1)基态Al原子核外电子有__________ 种不同的空间运动状态,Al原子的第一电离能低于Mg,原因是__________ 。
(2)电解氧化铝生成铝的化学方程式为__________ ,无碳电解铝技术是利用陶瓷材料替代碳作阳极,该技术的优点之一是__________ 。
(3)“气体1”是__________ (填化学式,下同),“滤渣1”的主要成分是__________ 。
(4)已知“碱解”同时生成白色沉淀,写出生成“气体2”的离子方程式:__________ 。
(5)“苛化”中存在如下反应: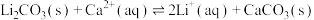 。通过计算解释生石灰能使
。通过计算解释生石灰能使 完全转化的原因:
完全转化的原因:__________ 。
(6)已知 可形成共价分子,
可形成共价分子, 为离子晶体,从电负性的角度解释其原因:
为离子晶体,从电负性的角度解释其原因:__________ 。
 、
、 、
、 、
、 )为原料,制备电池级碳酸锂的工艺流程如图:
)为原料,制备电池级碳酸锂的工艺流程如图:
已知:
 、
、 难溶于水,
难溶于水, 溶于水,
溶于水, 微溶于水,
微溶于水, 、
、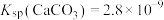 。
。回答下列问题:
(1)基态Al原子核外电子有
(2)电解氧化铝生成铝的化学方程式为
(3)“气体1”是
(4)已知“碱解”同时生成白色沉淀,写出生成“气体2”的离子方程式:
(5)“苛化”中存在如下反应:
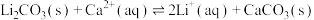 。通过计算解释生石灰能使
。通过计算解释生石灰能使 完全转化的原因:
完全转化的原因:(6)已知
 可形成共价分子,
可形成共价分子, 为离子晶体,从电负性的角度解释其原因:
为离子晶体,从电负性的角度解释其原因:
您最近一年使用:0次
解题方法
2 . 铜及其化合物在日常生产、生活中有着广泛的应用。回答下列问题:
(1)基态Cu原子价电子排布式为_______ 。
(2)K与Cu同周期,最外层电子数相同,但Cu的熔点远高于K,因为_______ 。
(3)含铜废液可以利用铜萃取剂M,通过如下反应实现铜离子的富集,进行回收。
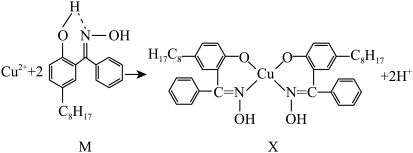
①M所含元素的电负性由大到小顺序是_______ (用元素符号表示)。
②X化合物中中心原子铜的配位数是_______ ,上述反应中断裂和生成的化学键有_______ (填字母序号)。
a.离子键 b.共价键 c.金属键 d.氢键 e.配位键
(4)高温下, 比CuO稳定的原因是
比CuO稳定的原因是_______ 。
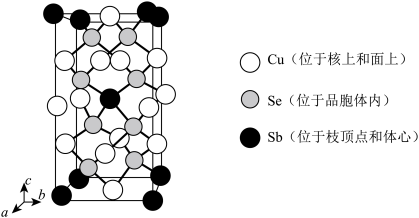
(5)离子型配合物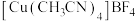 中,阴离子的空间构型为
中,阴离子的空间构型为_______ ,配体中碳原子的杂化方式是_______ 。
(6)由Cu,Sb,Se组成的热电材料,其晶胞结构如图所示, ,
,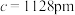 ,该晶体的密度是
,该晶体的密度是_______  (列式即可)
(列式即可)
(1)基态Cu原子价电子排布式为
(2)K与Cu同周期,最外层电子数相同,但Cu的熔点远高于K,因为
(3)含铜废液可以利用铜萃取剂M,通过如下反应实现铜离子的富集,进行回收。

①M所含元素的电负性由大到小顺序是
②X化合物中中心原子铜的配位数是
a.离子键 b.共价键 c.金属键 d.氢键 e.配位键
(4)高温下,
 比CuO稳定的原因是
比CuO稳定的原因是(5)离子型配合物
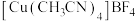 中,阴离子的空间构型为
中,阴离子的空间构型为(6)由Cu,Sb,Se组成的热电材料,其晶胞结构如图所示,
 ,
,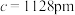 ,该晶体的密度是
,该晶体的密度是 (列式即可)
(列式即可)
您最近一年使用:0次
名校
解题方法
3 . 碳元素能形成多种单质及化合物,在生产生活中有重要的研究和应用价值。请根据以下信息,回答下列问题。
(1)邻氨基吡啶的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如下图所示。
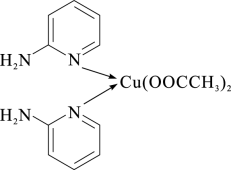
①在元素周期表中铜位于_______ 区(填“s”、“p”、“d”或“ds”)。C、N、O三种元素的电负性由大到小的顺序为_______ 。
②邻氨基吡啶的铜配合物中,Cu2+的配位数是_______ ,N原子的杂化类型有_______ 。
(2)化学工业科学家侯德榜利用下列反应最终制得了高质量的纯碱:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。
①1体积水可溶解约1体积CO2,1体积水可溶解约700体积NH3,NH3极易溶于水的原因是_______ ,反应时,向饱和NaCl溶液中先通入_______ 。
②NaHCO3分解得Na2CO3, 空间结构为
空间结构为_______ 。
(3)碳原子构成的单质具有多种同素异形体,也对应着有多种不同晶体类型。
①下图为石墨和石墨烯的结构示意图。石墨烯是从石墨材料中剥离出来,由碳原子组成的只有一层原子厚度的二维晶体。下列关于石墨与石墨烯的说法正确的是_______ 。
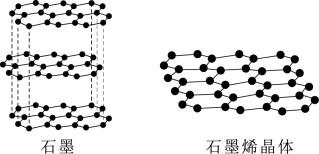
A.从石墨中剥离石墨烯需要破坏化学键
B.石墨中的碳原子采取sp3杂化
C.石墨属于混合型晶体,层与层之间存在分子间作用力
D.石墨烯中平均每个六元碳环含有2个碳原子
②利用皮秒激光照射悬浮在甲醇溶液中的多臂碳纳米管可以合成T-碳,T-碳的晶体结构可看成金刚石晶体中每个碳原子被正四面体结构单元(由四个碳原子组成)取代,如图所示(其中图(a)、(b)为T-碳的晶胞和俯视图,图(c)为金刚石晶胞)。
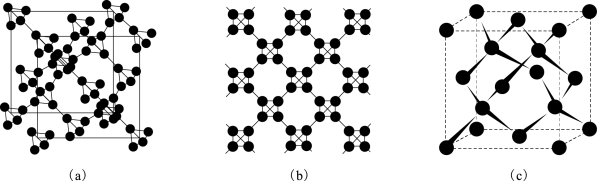
一个T-碳晶胞中含有_______ 个碳原子,T-碳的密度非常小为金刚石的一半,则T-碳晶胞的边长和金刚石晶胞的边长之比为_______ 。
(1)邻氨基吡啶的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如下图所示。

①在元素周期表中铜位于
②邻氨基吡啶的铜配合物中,Cu2+的配位数是
(2)化学工业科学家侯德榜利用下列反应最终制得了高质量的纯碱:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。
①1体积水可溶解约1体积CO2,1体积水可溶解约700体积NH3,NH3极易溶于水的原因是
②NaHCO3分解得Na2CO3,
 空间结构为
空间结构为(3)碳原子构成的单质具有多种同素异形体,也对应着有多种不同晶体类型。
①下图为石墨和石墨烯的结构示意图。石墨烯是从石墨材料中剥离出来,由碳原子组成的只有一层原子厚度的二维晶体。下列关于石墨与石墨烯的说法正确的是

A.从石墨中剥离石墨烯需要破坏化学键
B.石墨中的碳原子采取sp3杂化
C.石墨属于混合型晶体,层与层之间存在分子间作用力
D.石墨烯中平均每个六元碳环含有2个碳原子
②利用皮秒激光照射悬浮在甲醇溶液中的多臂碳纳米管可以合成T-碳,T-碳的晶体结构可看成金刚石晶体中每个碳原子被正四面体结构单元(由四个碳原子组成)取代,如图所示(其中图(a)、(b)为T-碳的晶胞和俯视图,图(c)为金刚石晶胞)。

一个T-碳晶胞中含有
您最近一年使用:0次
2022-06-26更新
|
377次组卷
|
2卷引用:贵州省遵义市2022届高三下学期三模理科综合化学试题
解题方法
4 . 2022年4月16日9时56分,“神舟十三号”载人飞船返回舱成功着陆。“神舟十三号”制作材料中包含了Cu、Ga、Ni、Xe等多种元素。回答下列问题:
(1)原子中的电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的用-
表示,与之相反的用- 之表示,称为电子的自旋磁量子数。对于基态的Ga原子,其价电子自旋磁量子数的代数和为
之表示,称为电子的自旋磁量子数。对于基态的Ga原子,其价电子自旋磁量子数的代数和为___________ 。 Ca、Ga、Ge 三种元素的电负性由大到小的顺序为______ 。
(2)Cu位于元素周期表的___________ (填 “s”、“p”、 “d”或“ds”)区,Cu催化烯烃硝化反应过程中会产生 ,键角:
,键角:
___________  (填“> ”或“<"),判断依据是
(填“> ”或“<"),判断依据是______ 。
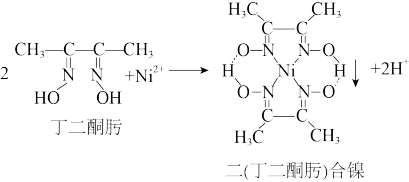
(3)N2+与丁二酮肟生成鲜红色二(丁二酮肟)合镍沉淀,该反应可用于检验Ni2+,原理如图,则丁二酮肟中碳原子的杂化轨道类型为___________ ,1 mol丁二酮肟分子中含有σ键的数目为___________ ,二 (丁二酮肟)合镍分子中存在的化学键有___________ (填字母序号)。
a.非极性键 b.π键 c.离子键 d.氢键 e.配位键
(4)XeF2晶体属四方晶系,晶胞结构如图所示,晶胞棱边夹角均为90°。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子分数坐标。如图中原子A的分数坐标为(0,0,0),原子B的分数坐标为( ,
, ,
, )。已知Xe-F键长为rpm,原子C的分数坐标为
)。已知Xe-F键长为rpm,原子C的分数坐标为___________ ;设NA为阿伏加德罗常数的值,XeF2的密度为___________ g·cm-3(列计算式)。
(1)原子中的电子有两种相反的自旋状态,若一种自旋状态用+
 表示,与之相反的用-
表示,与之相反的用- 之表示,称为电子的自旋磁量子数。对于基态的Ga原子,其价电子自旋磁量子数的代数和为
之表示,称为电子的自旋磁量子数。对于基态的Ga原子,其价电子自旋磁量子数的代数和为(2)Cu位于元素周期表的
 ,键角:
,键角:
 (填“> ”或“<"),判断依据是
(填“> ”或“<"),判断依据是(3)N2+与丁二酮肟生成鲜红色二(丁二酮肟)合镍沉淀,该反应可用于检验Ni2+,原理如图,则丁二酮肟中碳原子的杂化轨道类型为
a.非极性键 b.π键 c.离子键 d.氢键 e.配位键

(4)XeF2晶体属四方晶系,晶胞结构如图所示,晶胞棱边夹角均为90°。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子分数坐标。如图中原子A的分数坐标为(0,0,0),原子B的分数坐标为(
 ,
, ,
, )。已知Xe-F键长为rpm,原子C的分数坐标为
)。已知Xe-F键长为rpm,原子C的分数坐标为
您最近一年使用:0次
5 .  均为元素周期表第II A族元素。回答下列问题:
均为元素周期表第II A族元素。回答下列问题:
(1)基态 原子L能层有
原子L能层有______ 个运动状态不同的电子, 的第一电离能
的第一电离能______ (填“大于”或“小于”) 的第一电离能。
的第一电离能。
(2) 和
和 位于同一周期,且核外最外层电子排布相同,但金属
位于同一周期,且核外最外层电子排布相同,但金属 的熔、沸点等都比金属
的熔、沸点等都比金属 的高,原因是
的高,原因是______ 。
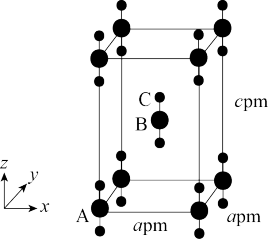
(3)氯气与熟石灰反应制漂白粉时会生成副产物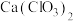 ,
,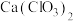 中电负性最小的元素是
中电负性最小的元素是______ (填元素符号); 的空间构型是
的空间构型是______ ; 原子的杂化方式为
原子的杂化方式为______ 。
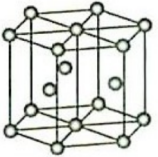
(4)离子化合物 的晶体结构如图所示。
的晶体结构如图所示。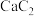 中的作用力为
中的作用力为______ ,从钙离子看该晶体属于______ 堆积,一个晶胞中含有的π键有______ 个。
(5)镁单质晶体中原子的堆积模型如图,已知图中底边长为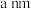 ,高为
,高为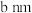 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则镁的密度为
,则镁的密度为______ (用含 、a、b的计算式表示)。
、a、b的计算式表示)。
 均为元素周期表第II A族元素。回答下列问题:
均为元素周期表第II A族元素。回答下列问题:(1)基态
 原子L能层有
原子L能层有 的第一电离能
的第一电离能 的第一电离能。
的第一电离能。(2)
 和
和 位于同一周期,且核外最外层电子排布相同,但金属
位于同一周期,且核外最外层电子排布相同,但金属 的熔、沸点等都比金属
的熔、沸点等都比金属 的高,原因是
的高,原因是(3)氯气与熟石灰反应制漂白粉时会生成副产物
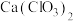 ,
,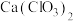 中电负性最小的元素是
中电负性最小的元素是 的空间构型是
的空间构型是 原子的杂化方式为
原子的杂化方式为(4)离子化合物
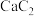 的晶体结构如图所示。
的晶体结构如图所示。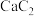 中的作用力为
中的作用力为
(5)镁单质晶体中原子的堆积模型如图,已知图中底边长为
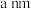 ,高为
,高为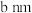 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则镁的密度为
,则镁的密度为 、a、b的计算式表示)。
、a、b的计算式表示)。
您最近一年使用:0次
2021-02-04更新
|
385次组卷
|
2卷引用:贵州省黔东南州2021届高三下学期3月高考模拟考试理综化学试题
解题方法
6 . 草酸铁铵{(NH4)3[Fe(C2O4)3]}常用于摄影和蓝色印刷等,其制备原理为:Fe(OH)3+3NH4HC2O4=(NH4)3[Fe(C2O4)3]+3H2O。
回答下列问题:
(1)基态C原子核外电子云有__ 种形状;基态铁原子最先失去__ 能级(填能级符号)上的电子。
(2)(NH4)3[Fe(C2O4)3]中C2O 作为配体时两个单键氧能同时作为配位原子与金属离子形成环状结构。
作为配体时两个单键氧能同时作为配位原子与金属离子形成环状结构。
①该配合物中所含非金属元素的电负性由大到小的顺序为__ (用元素符号表示)。
②上述配合物的中心离子配位数为___ 。
③1molC2O 中含有σ键的数目为
中含有σ键的数目为__ 在多原子分子中如有相互平行的p轨道,它们连贯重叠在一起构成一个整体,p电子在多个原子间运动形成π型化学键,这种不局限在两个原子之间的π键称为离域π键简称大π键。如苯的大π键可表示为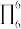 (π的右下角“6”表示6个原子,右上角“6”表示6个电子),C2O
(π的右下角“6”表示6个原子,右上角“6”表示6个电子),C2O 的大π键可表示为
的大π键可表示为__ 。
(3)写出一种与NH 所含价电子数和原子总数均相等微粒的化学式
所含价电子数和原子总数均相等微粒的化学式__ ;N元素的一种同素异形体N4中所有原子均满足8电子稳定结构,N4的结构式为__ ;CH4、NH3、H2O分子中键角由大到小的顺序为__ 。
(4)铁的某种晶胞沿面对角线的位置切下之后可以得到如图所示的藏面。假设铁原子半径为rpm,NA为阿伏加德罗常数的值,则铁晶体密度为__ g·cm-3。

回答下列问题:
(1)基态C原子核外电子云有
(2)(NH4)3[Fe(C2O4)3]中C2O
 作为配体时两个单键氧能同时作为配位原子与金属离子形成环状结构。
作为配体时两个单键氧能同时作为配位原子与金属离子形成环状结构。①该配合物中所含非金属元素的电负性由大到小的顺序为
②上述配合物的中心离子配位数为
③1molC2O
 中含有σ键的数目为
中含有σ键的数目为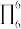 (π的右下角“6”表示6个原子,右上角“6”表示6个电子),C2O
(π的右下角“6”表示6个原子,右上角“6”表示6个电子),C2O 的大π键可表示为
的大π键可表示为(3)写出一种与NH
 所含价电子数和原子总数均相等微粒的化学式
所含价电子数和原子总数均相等微粒的化学式(4)铁的某种晶胞沿面对角线的位置切下之后可以得到如图所示的藏面。假设铁原子半径为rpm,NA为阿伏加德罗常数的值,则铁晶体密度为

您最近一年使用:0次
2021-01-31更新
|
549次组卷
|
2卷引用:贵州省盘州市2021届高三第一次模拟考试理科综合化学试题
7 . 钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料,回答下列问题:
(1)基态Ti原子的核外电子排布式为____________ 。
(2)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是____________ 。
(3)CaTiO3的晶胞如图(a)所示,其组成元素的电负性大小顺序是__________ ;金属离子与氧离子间的作用力为__________ ,Ca2+的配位数是__________ 。
(4)一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I﹣和有机碱离子 ,其晶胞如图(b)所示。其中Pb2+与图(a)中
,其晶胞如图(b)所示。其中Pb2+与图(a)中__________ 的空间位置相同,有机碱 中,N原子的杂化轨道类型是
中,N原子的杂化轨道类型是__________ ;若晶胞参数为a nm,则晶体密度为_________ g·cm-3(列出计算式)。_______ 、_______ 。
(1)基态Ti原子的核外电子排布式为
(2)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是
| 化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | ﹣24.12 | 38.3 | 155 |
(3)CaTiO3的晶胞如图(a)所示,其组成元素的电负性大小顺序是
(4)一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I﹣和有机碱离子
 ,其晶胞如图(b)所示。其中Pb2+与图(a)中
,其晶胞如图(b)所示。其中Pb2+与图(a)中 中,N原子的杂化轨道类型是
中,N原子的杂化轨道类型是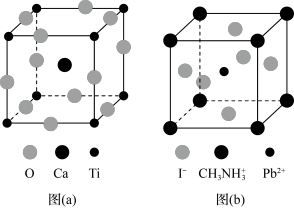
您最近一年使用:0次
2020-07-08更新
|
15474次组卷
|
21卷引用:贵州省罗甸县边阳中学2022届高三模拟测试化学试题
贵州省罗甸县边阳中学2022届高三模拟测试化学试题2020年全国统一考试化学试题(新课标Ⅱ)(已下线)专题17 物质结构与性质(选修)-2020年高考真题和模拟题化学分项汇编(已下线)专题11 物质结构与性质——备战2021年高考化学纠错笔记(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)押全国卷理综第35题 物质结构与性质-备战2021年高考化学临考题号押题北京一零一中学2021-2022学年高三上学期10月月考化学试题(已下线)解密13 物质结构与性质(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)2020年全国卷Ⅱ化学真题变式题江西省九江市2022届第二次高考模拟统一考试理综化学试题(已下线)专题13 物质结构与性质—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)回归教材重难点11 物质结构与性质(选考)-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)押全国卷理综第35题 物质结构与性质-备战2022年高考化学临考题号押题(课标全国卷)(已下线)专题18物质结构与性质(选修)-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题18物质结构与性质(选修)-五年(2018~2022)高考真题汇编(全国卷)(已下线)专题九 物质结构与性质-实战高考·二轮复习核心突破(已下线)专题02 物质结构专题-【大题精做】冲刺2023年高考化学大题突破+限时集训(新高考专用)(已下线)专题20 结构与性质四川省成都锦江区嘉祥外国语高级中学2023-2024学年高三下学期第一次诊断性考试理科综合试题-高中化学河南省开封市铁路中学2020-2021学年高二下学期期中考试化学试题重庆市万州第二高级中学2021-2022学年高二下学期6月第三次质量检测化学试题
名校
解题方法
8 . 含镁、氮、磷、砷等元素的化合物在化工生产、药物化学及催化化学等领域应用广泛。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是_____ (填序号)。
A.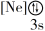 B.
B.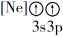 C.
C.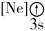 D.
D.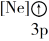
(2)晶格能又叫点阵能。它是1mol 离子化合物中的正、负离子从相互分离的气态结合成离子晶体时所放出的能量。MgO 晶格能可通过如图所示的Borm Haber循环计算得到。

Mg的第二电离能为______ kJ·mol-1;MgO的晶格能为___________ kJ·mol-1。
(3)乙二胺(H2NCH2CH2NH2) 是一种有机化合物,其中N原子的杂化类型是____ ,该有机化合物能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是______ ,其中与乙二胺形成的化合物稳定性相对较高的是_______ (填 “Mg2+ ”或“Cu2+” )。
(4) PCl5是一种白色固体,加热到160°C不经过液态阶段就变成蒸气,测得180°C下的蒸气密度(折合成标准状况)为9.3g·L-1,分子的极性为零,P-Cl键长为204pm和211pm两种。在180°C下PCl5蒸气中存在的分子形式为____ (填化学式),分子的空间构型为______ ,P、Cl的电负性由大到小顺序为________ 。
(5)砷和铟组成的一种化合物属于半导体材料,其晶胞结构如图所示。已知晶胞的参数为a pm,阿伏加 德罗常数的值为NA,则该晶体的密度为_____ g. cm-3(用含a和NA的代数式表示)。
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是
A.
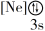 B.
B.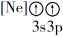 C.
C.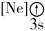 D.
D.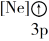
(2)晶格能又叫点阵能。它是1mol 离子化合物中的正、负离子从相互分离的气态结合成离子晶体时所放出的能量。MgO 晶格能可通过如图所示的Borm Haber循环计算得到。

Mg的第二电离能为
(3)乙二胺(H2NCH2CH2NH2) 是一种有机化合物,其中N原子的杂化类型是
(4) PCl5是一种白色固体,加热到160°C不经过液态阶段就变成蒸气,测得180°C下的蒸气密度(折合成标准状况)为9.3g·L-1,分子的极性为零,P-Cl键长为204pm和211pm两种。在180°C下PCl5蒸气中存在的分子形式为
(5)砷和铟组成的一种化合物属于半导体材料,其晶胞结构如图所示。已知晶胞的参数为a pm,阿伏加 德罗常数的值为NA,则该晶体的密度为

您最近一年使用:0次
名校
解题方法
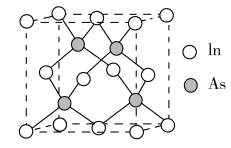
9 . 砷化镓是继硅之后研究最深入、应用最广泛的半导体材料。回答下列问题:
(1)Ga基态原子核外电子排布式为________________ ,As基态原子核外有__________ 个未成对电子。
(2)Ga、As、Se的第一电离能由大到小的顺序是__________ ,Ga、As、Se的电负性由大到小的顺序是__________________ 。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:________ ,GaF的熔点超过1000℃,可能的原因是__________________________ 。
(4)二水合草酸镓的结构如图1所示,其中镓原子的配位数为__________ ,草酸根离子中碳原子的杂化轨道类型为__________ 。
(5)砷化镓的立方晶胞结构如图2所示,晶胞参数为a=0.565nm,砷化镓晶体的密度为__________ g·cm-3(设NA为阿伏加 德罗常数的值,列出计算式即可)。
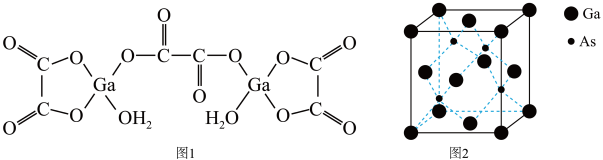
(1)Ga基态原子核外电子排布式为
(2)Ga、As、Se的第一电离能由大到小的顺序是
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:
| 镓的卤化物 | CaCl3 | CaBr3 | CaI3 |
| 熔点/℃ | 77.75 | 122.3 | 211.5 |
| 沸点/℃ | 201.2 | 279 | 346 |
(5)砷化镓的立方晶胞结构如图2所示,晶胞参数为a=0.565nm,砷化镓晶体的密度为

您最近一年使用:0次
2020-02-11更新
|
240次组卷
|
6卷引用:贵州省遵义第二教育集团2020届高三上学期第一次大联考理科综合化学试题
名校
解题方法
10 . (1)钒是第四周期元素,工业上有广泛应用。写出钒原子的价电子排布图______________ ,V2O5常用作SO2转化为SO3的催化剂,S单质的常见形式为S8,其环状结构如图所示,S原子的杂化轨道类型为_________________ .

(2)光气(COCl2)是一种重要的有机中间体,其分子的立体构型为_________ ,其三种元素的电负性由小到大的顺序为___________________ ,写出与COCl2互为等电子体的分子和离子:___ (各写一种)。
(3)[Co(N3)(NH3)5]SO4中Co的配位数为_________ ,其配离子中含有的化学键类型为__________ ,C、N、O中第一电离能最大的为_______ ,其原因是____________________ 。
(4)如图为金刚石的晶胞,其中原子坐标参数为A(0,0,0);B( ,0,
,0, );C(
);C( ,
, ,
, );则D原子的坐标参数为
);则D原子的坐标参数为__________ 。

(5)晶体锌为体心立方结构,如图所示。已知锌晶体的密度为dg/cm3,NA代表阿伏加 德罗常数的值。锌晶体中锌原子之间最近的核间距(D)=_______ mm。


(2)光气(COCl2)是一种重要的有机中间体,其分子的立体构型为
(3)[Co(N3)(NH3)5]SO4中Co的配位数为
(4)如图为金刚石的晶胞,其中原子坐标参数为A(0,0,0);B(
 ,0,
,0, );C(
);C( ,
, ,
, );则D原子的坐标参数为
);则D原子的坐标参数为
(5)晶体锌为体心立方结构,如图所示。已知锌晶体的密度为dg/cm3,NA代表阿伏加 德罗常数的值。锌晶体中锌原子之间最近的核间距(D)=

您最近一年使用:0次



