名校
1 . 乙肝新药的中间体化合物J的一种合成路线如图:
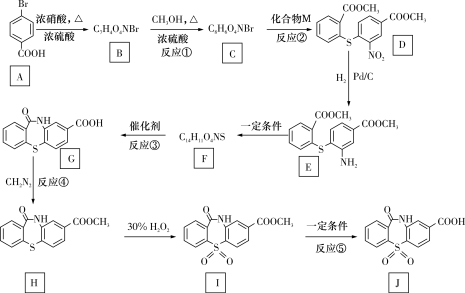
已知: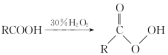 ,回答下列问题:
,回答下列问题:
(1)A的化学名称为___________ ,C中含氧官能团的名称为___________ 。
(2)M的结构简式为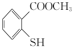
①M中电负性最强的元素是___________ 。
②M与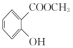 相比,M的水溶性更
相比,M的水溶性更_________ (填“大”或“小”),原因是__________ 。
(3)写出反应③的化学方程式:___________ 。
(4)化合物Q是A的同系物,相对分子质量比A的多14;Q的同分异构体中,同时满足下列条件(不考虑立体异构):
a.能与 溶液发生显色反应;
溶液发生显色反应;
b.能发生银镜反应;
c.苯环上有2个取代基;
其中核磁共振氢谱有五组峰,且峰面积之比为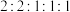 的结构简式为
的结构简式为___________ 。
(5)以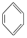 和
和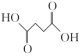 为原料,参照上述合成路线,设计三步合成
为原料,参照上述合成路线,设计三步合成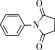 的路线
的路线_________ (无机试剂任选)。

已知:
 ,回答下列问题:
,回答下列问题:(1)A的化学名称为
(2)M的结构简式为

①M中电负性最强的元素是
②M与
 相比,M的水溶性更
相比,M的水溶性更(3)写出反应③的化学方程式:
(4)化合物Q是A的同系物,相对分子质量比A的多14;Q的同分异构体中,同时满足下列条件(不考虑立体异构):
a.能与
 溶液发生显色反应;
溶液发生显色反应;b.能发生银镜反应;
c.苯环上有2个取代基;
其中核磁共振氢谱有五组峰,且峰面积之比为
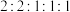 的结构简式为
的结构简式为(5)以
 和
和 为原料,参照上述合成路线,设计三步合成
为原料,参照上述合成路线,设计三步合成 的路线
的路线
您最近一年使用:0次
2 . 硫酸铈铵[(NH4)4Ce(SO4)4]是分析化学常用的滴定剂。以氟碳铈矿(含CeFCO3、BaF2、SiO2等)为原料制备硫酸铈铵的工艺流程如图所示。

已知部分信息如下:
①Ce3+在空气中易被氧化为Ce4+。
②“沉铈”时发生的反应之一: 。
。
回答下列问题:
(1) CeFCO3中电负性最大的是___________ (填元素符号),画出H2O的VSEPR模型:___________ 。
(2)“焙烧”中常采用高压空气、逆流操作(空气从焙烧炉下部通入,矿粉从中上部加入),这样操作的目的是___________ 。
(3)“酸浸”中,铈浸出率与温度的关系如图1所示,铈浸出率与硫酸浓度的关系如图2所示。工业生产应选择的适宜条件是___________ 。

(4)“沉铈”时,硫脲作___________ (填“还原剂”或“氧化剂”)。
(5)“溶解”时,为防止 被氧化,可以加入
被氧化,可以加入___________ (填标号)。
a.KMnO4 b.NaClO c.CH3CHO
(6)在有机合成中,硫酸铈铵常作合成丙酸异戊酯的催化剂、其他条件相同,酯产率与催化剂质量的关系如图3所示。工业生产中,选择的最佳催化剂质量为___________

(7)测定产品纯度。称取w g产品溶于水,配制成250mL溶液,准确量取25.00mL配制的溶液于锥形瓶中。加入 溶液,恰好完全反应。该产品纯度为
溶液,恰好完全反应。该产品纯度为___________ %。(杂质不参与反应,滴定反应为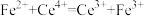 )
)

已知部分信息如下:
①Ce3+在空气中易被氧化为Ce4+。
②“沉铈”时发生的反应之一:
 。
。回答下列问题:
(1) CeFCO3中电负性最大的是
(2)“焙烧”中常采用高压空气、逆流操作(空气从焙烧炉下部通入,矿粉从中上部加入),这样操作的目的是
(3)“酸浸”中,铈浸出率与温度的关系如图1所示,铈浸出率与硫酸浓度的关系如图2所示。工业生产应选择的适宜条件是

(4)“沉铈”时,硫脲作
(5)“溶解”时,为防止
 被氧化,可以加入
被氧化,可以加入a.KMnO4 b.NaClO c.CH3CHO
(6)在有机合成中,硫酸铈铵常作合成丙酸异戊酯的催化剂、其他条件相同,酯产率与催化剂质量的关系如图3所示。工业生产中,选择的最佳催化剂质量为

(7)测定产品纯度。称取w g产品溶于水,配制成250mL溶液,准确量取25.00mL配制的溶液于锥形瓶中。加入
 溶液,恰好完全反应。该产品纯度为
溶液,恰好完全反应。该产品纯度为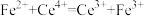 )
)
您最近一年使用:0次
2023-09-03更新
|
71次组卷
|
2卷引用:湖南省岳阳市湘阴县知源高级中学等学校联考2024届高三上学期第一次月考化学试题
名校
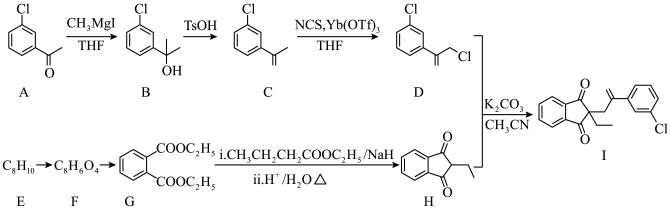
3 . 以A和芳香烃E为原料制备除草剂茚草酮中间体(Ⅰ)的合成路线如下:
(1)A中所含官能团的名称为__________ 。
(2)B→C的反应类型为__________ 。
(3)D中碳原子的杂化轨道类型有__________ ;其中,电负性最大的元素为__________ 。
(4)写出F→G的化学方程式__________ 。
(5)B的同分异构体中,满足下列条件的结构有______ 种;其中,核磁共振氢谱有四组峰,且峰面积之比为6∶2∶2∶1的结构简式为__________ 。
条件:①含有苯环;
②与 溶液发生显色反应;
溶液发生显色反应;
③含有2个甲基,且连在同一个碳原子上。
(6)利用原子示踪技术追踪G→H的反应过程:
(1)A中所含官能团的名称为
(2)B→C的反应类型为
(3)D中碳原子的杂化轨道类型有
(4)写出F→G的化学方程式
(5)B的同分异构体中,满足下列条件的结构有
条件:①含有苯环;
②与
 溶液发生显色反应;
溶液发生显色反应;③含有2个甲基,且连在同一个碳原子上。
(6)利用原子示踪技术追踪G→H的反应过程:
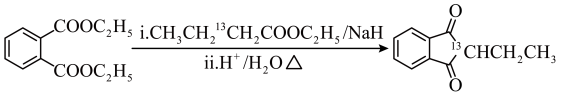
根据上述信息,写出以乙醇和 为原料合成
为原料合成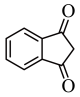 的路线(无机试剂任选)
的路线(无机试剂任选)
您最近一年使用:0次
2023-02-19更新
|
2308次组卷
|
9卷引用:湖南师范大学附属中学2024届高三上学期月考(二) 化学试题
湖南师范大学附属中学2024届高三上学期月考(二) 化学试题湖南师范大学附属中学2023-2024学年高三上学期月考化学试卷(二) 广东省深圳市2022-2023学年高三第一次调研考试化学试题(已下线)广东省深圳市2022-2023学年高三第一次调研考试变式题(有机综合题)重庆市南开中学校2023届高三模拟考试化学试题(已下线)专题21 有机推断题(已下线)广东省广州市天河区2023届高三二模化学试题变式题(有机推断题)(已下线)化学-2023年高考押题预测卷02(广东卷)(含考试版、全解全析、参考答案、答题卡)(已下线)山东省名校联盟2024届高三下学期5月模拟考试化学试题
名校
解题方法
4 . 卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
(1)氟原子激发态的电子排布式有_______ (填标号)。
A. B.
B.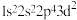 C.
C.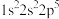
(2)O、F、Cl电负性由大到小的顺序为_______ ; 分子的空间结构为
分子的空间结构为_______ ; 的熔、沸点低于
的熔、沸点低于 ,原因是
,原因是_______ 。
(3)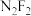 (二氟氮烯)分子中,氮原子的杂化类型为
(二氟氮烯)分子中,氮原子的杂化类型为 ,则
,则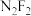 的结构式为
的结构式为_______ 。
(4) 晶体与NaCl晶体结构相似。
晶体与NaCl晶体结构相似。
①设阿伏加德罗常数的值为 ,距离最近的两个
,距离最近的两个 间距为apm,NiO的摩尔质量为
间距为apm,NiO的摩尔质量为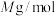 ,则NiO晶体的密度为
,则NiO晶体的密度为_______  。
。
②晶体普遍存在各种缺陷。某种NiO晶体中存在如图所示的缺陷:当一个 空缺,会有两个
空缺,会有两个 被两个
被两个 所取代,但晶体仍呈电中性。经测定某氧化镍样品中
所取代,但晶体仍呈电中性。经测定某氧化镍样品中 与
与 的离子数之比为6∶91.若该晶体的化学式为
的离子数之比为6∶91.若该晶体的化学式为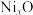 ,则
,则
_______ 。

(1)氟原子激发态的电子排布式有
A.
 B.
B.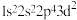 C.
C.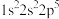
(2)O、F、Cl电负性由大到小的顺序为
 分子的空间结构为
分子的空间结构为 的熔、沸点低于
的熔、沸点低于 ,原因是
,原因是(3)
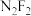 (二氟氮烯)分子中,氮原子的杂化类型为
(二氟氮烯)分子中,氮原子的杂化类型为 ,则
,则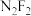 的结构式为
的结构式为(4)
 晶体与NaCl晶体结构相似。
晶体与NaCl晶体结构相似。①设阿伏加德罗常数的值为
 ,距离最近的两个
,距离最近的两个 间距为apm,NiO的摩尔质量为
间距为apm,NiO的摩尔质量为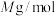 ,则NiO晶体的密度为
,则NiO晶体的密度为 。
。②晶体普遍存在各种缺陷。某种NiO晶体中存在如图所示的缺陷:当一个
 空缺,会有两个
空缺,会有两个 被两个
被两个 所取代,但晶体仍呈电中性。经测定某氧化镍样品中
所取代,但晶体仍呈电中性。经测定某氧化镍样品中 与
与 的离子数之比为6∶91.若该晶体的化学式为
的离子数之比为6∶91.若该晶体的化学式为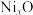 ,则
,则

您最近一年使用:0次
名校
解题方法
5 . 硒(Se)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(AIE)效应以来,AIE在发光材料、生物医学等领域引起广泛关注。一种含Se的新型AIE分子IV的合成路线如图:
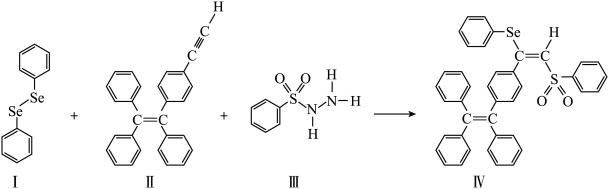
(1)Se与S同族,基态硒原子价电子排布式为_____ 。
(2) 的沸点低于H2O,其原因是
的沸点低于H2O,其原因是_____ 。
(3)关于I~III三种反应物,下列说法正确的有_____ (填标号)。
A.I中仅有σ键
B.I中的Se-Se为非极性共价键
C.II易溶于水
D.III中原子的杂化轨道类型有sp与sp2
E.I~III含有的元素中,O电负性最大
(4)IV中具有孤对电子的原子有_____ 。
(5)研究发现,给小鼠喂食适量硒酸钠(Na2SeO4)可减轻重金属铊引起的中毒,SeO 的空间结构为
的空间结构为_____ 。
(6)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。
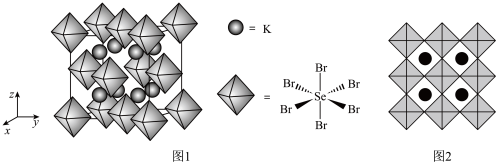
①X的化学式为_____ 。
②设X的最简式的式量为Mr,晶体密度为ρg•cm-3,则X中相邻K之间的最短距离为_____ nm(列出计算式,NA为阿伏加德罗常数的值)。

(1)Se与S同族,基态硒原子价电子排布式为
(2)
 的沸点低于H2O,其原因是
的沸点低于H2O,其原因是(3)关于I~III三种反应物,下列说法正确的有
A.I中仅有σ键
B.I中的Se-Se为非极性共价键
C.II易溶于水
D.III中原子的杂化轨道类型有sp与sp2
E.I~III含有的元素中,O电负性最大
(4)IV中具有孤对电子的原子有
(5)研究发现,给小鼠喂食适量硒酸钠(Na2SeO4)可减轻重金属铊引起的中毒,SeO
 的空间结构为
的空间结构为(6)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。

①X的化学式为
②设X的最简式的式量为Mr,晶体密度为ρg•cm-3,则X中相邻K之间的最短距离为
您最近一年使用:0次
2022-12-06更新
|
174次组卷
|
2卷引用:湖南省长沙市雅礼中学2022-2023学年高三上学期第四次月考化学试题
名校
解题方法
6 . 锑钾[Sb-K]合金、镍钴锰酸锂[LiNixCoyMn(1-x-y)O2]、磷酸铁钠[NaFePO4]分别作为钾离子电池、三元锂离子电池、钠离子电池的电极材料。这些电池成为目前实现碳中和研发的热点。请按要求回答下列问题。
(1)上述电池涉及的主族元素中,电负性最大的是_______ 。
(2)Sb是比P的周期数大2的同主族元素。基态Sb原子价电子排布式为_______ 。
(3)在回收电极材料中的Co时,测得溶液中c(Co2+)=1.0 mol·L-1,通入NH3生成 Co(OH)2沉淀,则Co2+沉淀完全时溶液的c(OH-)最小为_______ mol·L-1,(已知沉淀完全时c(Co2+)≤1.0×10-5 mol·L-1,此温度下Ksp[Co(OH)2]=4.0×10-15,溶液体积变化忽略不计)。
(4)钠离子电池电极材料制备:向含Fe3+的溶液中加入过量Na2HPO4溶液,过滤后 进一步处理得FePO4沉淀。然后将FePO4与NaI混合,在He气氛中加热,制得NaFePO4.已知常温下

 +H+ ,Ka2 =6.2×10-8,
+H+ ,Ka2 =6.2×10-8, 

 +H+Ka3 =4.8×10-13。
+H+Ka3 =4.8×10-13。
①钠离子电池工作时,NaFePO4转化为FePO4,则NaFePO4在电池_______ (填"正" 或"负”)极放电。
②NaI在制NaFePO4的反应中的作用:_______ 。
③Na2HPO4溶液中含P元素离子的浓度由大到小的顺序为_______ 。
(5)立方晶系锑钾合金的晶胞结构如图1所示,其中晶胞的一部分如图2所示。

①该晶胞中,Sb和K的原子数之比为_______ 。
②该晶体的密度为_______ g·cm-3(设阿伏加德罗常数的值为NA,用含a、NA的代数式表示)
(1)上述电池涉及的主族元素中,电负性最大的是
(2)Sb是比P的周期数大2的同主族元素。基态Sb原子价电子排布式为
(3)在回收电极材料中的Co时,测得溶液中c(Co2+)=1.0 mol·L-1,通入NH3生成 Co(OH)2沉淀,则Co2+沉淀完全时溶液的c(OH-)最小为
(4)钠离子电池电极材料制备:向含Fe3+的溶液中加入过量Na2HPO4溶液,过滤后 进一步处理得FePO4沉淀。然后将FePO4与NaI混合,在He气氛中加热,制得NaFePO4.已知常温下


 +H+ ,Ka2 =6.2×10-8,
+H+ ,Ka2 =6.2×10-8, 

 +H+Ka3 =4.8×10-13。
+H+Ka3 =4.8×10-13。①钠离子电池工作时,NaFePO4转化为FePO4,则NaFePO4在电池
②NaI在制NaFePO4的反应中的作用:
③Na2HPO4溶液中含P元素离子的浓度由大到小的顺序为
(5)立方晶系锑钾合金的晶胞结构如图1所示,其中晶胞的一部分如图2所示。

①该晶胞中,Sb和K的原子数之比为
②该晶体的密度为
您最近一年使用:0次
7 . 火药是我国古代四大发明之一、黑火药爆炸时发生反应:S+2KNO3+3C=K2S+N2↑+3CO2↑,CuSO4能与K2S反应生成CuS沉淀。回答下列问题:
(1)基态Cu原子价电子排布图为___________ ,基态S原子核外电子空间运动状态有___________ 种。
(2)C、N、O的电负性从大到小的顺序为___________ ,(CN)2分子中σ键与π键的个数比为___________ 。
(3)KNO3中N原子的杂化方式为___________ ,与 互为等电子体的其中一种阴离子的化学式为
互为等电子体的其中一种阴离子的化学式为___________ 。
(4)C3N4晶体和金刚石结构类似,且金刚石的熔点比C3N4低,分析其原因:___________ 。
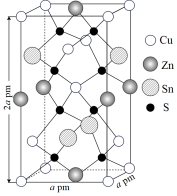
(5)已知含铜矿石一锌黄锡矿(K型)是制备薄膜太阳能电池的重要原料,其晶胞结构如图所示(晶胞参数α=β=γ= 90°)。该晶体的化学式为___________ , 晶体密度ρ=___________ g·cm-3)(用含有NA的代数式表示)。
(1)基态Cu原子价电子排布图为
(2)C、N、O的电负性从大到小的顺序为
(3)KNO3中N原子的杂化方式为
 互为等电子体的其中一种阴离子的化学式为
互为等电子体的其中一种阴离子的化学式为(4)C3N4晶体和金刚石结构类似,且金刚石的熔点比C3N4低,分析其原因:
(5)已知含铜矿石一锌黄锡矿(K型)是制备薄膜太阳能电池的重要原料,其晶胞结构如图所示(晶胞参数α=β=γ= 90°)。该晶体的化学式为

您最近一年使用:0次
名校
解题方法
8 . 高压不仅会引发物质的相变,也会导致新类型化学键的形成。回答下列问题:
(1)在50—300GPa的高压下,Na或Cl2反应生成如图所示晶胞的NaCl晶体,其中大灰球为氯,小黑球为钠。

①生成该晶体的反应的化学方程式为____ 。
②该NaCl晶体的密度为____ g•cm-3。(已知晶胞参数为apm,阿伏加德罗常数为NAmol-1)
(2)在超高压(300GPa)下,金属钠和氦可形成化合物。结构中,钠离子按简单立方排布,形成如图所示的立方体空隙,电子对(2e-)和氦原子交替分布填充在立方体的中心。

①若用NaxHey(2e-)z表示该晶体的组成,则x:y:z=___ 。
②若将氦原子放在晶胞顶点,则电子对(2e-)在晶胞中的分数坐标为(0.5,0,0)、(0,0.5,0)、(0,0,0.5)、____ 。
(3)若在高压条件下形成的氨晶体中,氨分子中的每个H均参与一个氢键的形成。则N原子的杂化方式为____ ,N原子邻接____ 个氢原子,1mol氨晶体中有____ mol氢键。该氨晶体与普通氨晶体相比熔点____ (填“高”、“低”或“相同”),原因是____ 。该氨晶体中氨分子的热稳定性与普通氨晶体中氨分子的热稳定性____ (填“高”、“低”或“相同”)。
(4)上述晶体中所涉及元素(Na、C1、He)的第一电离能的由大到小的顺序为____ (用元素符号填空),所涉及元素(H、Na、N)的电负性的大小为_____ (用元素符号填空)。
(1)在50—300GPa的高压下,Na或Cl2反应生成如图所示晶胞的NaCl晶体,其中大灰球为氯,小黑球为钠。

①生成该晶体的反应的化学方程式为
②该NaCl晶体的密度为
(2)在超高压(300GPa)下,金属钠和氦可形成化合物。结构中,钠离子按简单立方排布,形成如图所示的立方体空隙,电子对(2e-)和氦原子交替分布填充在立方体的中心。

①若用NaxHey(2e-)z表示该晶体的组成,则x:y:z=
②若将氦原子放在晶胞顶点,则电子对(2e-)在晶胞中的分数坐标为(0.5,0,0)、(0,0.5,0)、(0,0,0.5)、
(3)若在高压条件下形成的氨晶体中,氨分子中的每个H均参与一个氢键的形成。则N原子的杂化方式为
(4)上述晶体中所涉及元素(Na、C1、He)的第一电离能的由大到小的顺序为
您最近一年使用:0次
名校
解题方法
9 . 金属镁、铝可用于制造轻质合金、精密仪器等,26Mg是26Al衰变的产物,可用于地质年代的研究。回答下列问题:
(1)若将基态镁原子最高能级的电子排布图表示为 ,则它违背的电子排布规律是
,则它违背的电子排布规律是_______ 、_______ ;基态铝原子核外电子所处最高能级轨道的形状为_______ 。
(2)EDTA与硬水中的Ca2+、Mg2+结合,使Ca2+、Mg2+浓度降低,避免结成锅炉水垢,Mg2EDTA的结构简式为 。
。
①Mg2EDTA中组成元素的电负性由大到小的顺序为_______ (用元素符号表示)。
②Mg2EDTA分子内的原子中属于sp3杂化的是_______ (用元素符号表示)。
(3)镁与铍均属于碱土金属元素,氯化铍在1000℃时,完全离解为BeCl2单体,BeCl2单体的空间构型为_______ 。
(4)在熔融条件下,铝的氧化物导电,氯化物不导电,则铝的氧化物为_______ 晶体;一定条件下,铝的氯化物为二聚体,二聚体中所含的化学键为_______ (填标号)。
A.离子键 B.极性键 C.非极性键 D.配位键
(5)由Mg、Al、O构成的透明陶瓷立方晶胞结构信息如图所示:

①该透明陶瓷的化学式为_______ 。
②已知两个最近的Mg原子之间的距离为anm,设NA为阿伏加德罗常数的值,则该透明陶瓷立方晶胞的密度为_______ g·cm−3(用含a、NA的代数式表示)。
(1)若将基态镁原子最高能级的电子排布图表示为
 ,则它违背的电子排布规律是
,则它违背的电子排布规律是(2)EDTA与硬水中的Ca2+、Mg2+结合,使Ca2+、Mg2+浓度降低,避免结成锅炉水垢,Mg2EDTA的结构简式为
 。
。①Mg2EDTA中组成元素的电负性由大到小的顺序为
②Mg2EDTA分子内的原子中属于sp3杂化的是
(3)镁与铍均属于碱土金属元素,氯化铍在1000℃时,完全离解为BeCl2单体,BeCl2单体的空间构型为
(4)在熔融条件下,铝的氧化物导电,氯化物不导电,则铝的氧化物为
A.离子键 B.极性键 C.非极性键 D.配位键
(5)由Mg、Al、O构成的透明陶瓷立方晶胞结构信息如图所示:

①该透明陶瓷的化学式为
②已知两个最近的Mg原子之间的距离为anm,设NA为阿伏加德罗常数的值,则该透明陶瓷立方晶胞的密度为
您最近一年使用:0次
2022-05-24更新
|
459次组卷
|
3卷引用:湖南省永州市第一中学中2022届高三下学期第二次模拟考试化学试题
10 . 我国科学家合成介孔Fe—N—C催化剂大幅度提高了锌空气(O2)燃料电池的寿命和性能。请回答下列问题:
(1)锌元素位于周期表的____ 区。
(2)N、C、O、Zn的电负性由大到小排序为____ (填元素符号)
(3)在N、C、O的简单氢化物中,沸点最高的是____ (填化学式,下同),属于非极性分子的有____ 。
(4) [Zn(NH3)2(H2O)2]2+只有一种结构,则[Zn(NH3)4]2+的空间构型为____ (填“正方形”或“正四面体形”)
(5)我国科学家开发高效稳定荧光OLED器件,其材料的结构如图所示,碳原子杂化类型有____ 。

(6)我国科学家开发铜催化剂,实现二氧化碳高选择电还原制乙烯,如图所示。

①同温同压下,相同气体体积的CO2、C2H4含σ键数目之比为____ 。
②基态原子第一电离能:I1(Cu)____ I1(Zn)(填“>”“<”或“=”)。
(7)碳化铁立方晶胞如图所示,将碳原子看成插入铁晶胞中,晶胞体积保持不变。已知晶胞参数为acm,NA代表阿伏加德罗常数的值。

两个铁原子最近距离为____ cm;碳化铁的晶体密度为____ g•cm-3。
(1)锌元素位于周期表的
(2)N、C、O、Zn的电负性由大到小排序为
(3)在N、C、O的简单氢化物中,沸点最高的是
(4) [Zn(NH3)2(H2O)2]2+只有一种结构,则[Zn(NH3)4]2+的空间构型为
(5)我国科学家开发高效稳定荧光OLED器件,其材料的结构如图所示,碳原子杂化类型有

(6)我国科学家开发铜催化剂,实现二氧化碳高选择电还原制乙烯,如图所示。

①同温同压下,相同气体体积的CO2、C2H4含σ键数目之比为
②基态原子第一电离能:I1(Cu)
(7)碳化铁立方晶胞如图所示,将碳原子看成插入铁晶胞中,晶胞体积保持不变。已知晶胞参数为acm,NA代表阿伏加德罗常数的值。

两个铁原子最近距离为
您最近一年使用:0次



