火药是我国古代四大发明之一、黑火药爆炸时发生反应:S+2KNO3+3C=K2S+N2↑+3CO2↑,CuSO4能与K2S反应生成CuS沉淀。回答下列问题:
(1)基态Cu原子价电子排布图为___________ ,基态S原子核外电子空间运动状态有___________ 种。
(2)C、N、O的电负性从大到小的顺序为___________ ,(CN)2分子中σ键与π键的个数比为___________ 。
(3)KNO3中N原子的杂化方式为___________ ,与 互为等电子体的其中一种阴离子的化学式为
互为等电子体的其中一种阴离子的化学式为___________ 。
(4)C3N4晶体和金刚石结构类似,且金刚石的熔点比C3N4低,分析其原因:___________ 。
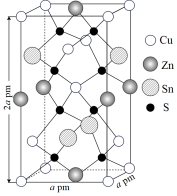
(5)已知含铜矿石一锌黄锡矿(K型)是制备薄膜太阳能电池的重要原料,其晶胞结构如图所示(晶胞参数α=β=γ= 90°)。该晶体的化学式为___________ , 晶体密度ρ=___________ g·cm-3)(用含有NA的代数式表示)。
(1)基态Cu原子价电子排布图为
(2)C、N、O的电负性从大到小的顺序为
(3)KNO3中N原子的杂化方式为
 互为等电子体的其中一种阴离子的化学式为
互为等电子体的其中一种阴离子的化学式为(4)C3N4晶体和金刚石结构类似,且金刚石的熔点比C3N4低,分析其原因:
(5)已知含铜矿石一锌黄锡矿(K型)是制备薄膜太阳能电池的重要原料,其晶胞结构如图所示(晶胞参数α=β=γ= 90°)。该晶体的化学式为

更新时间:2022-06-11 18:47:53
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
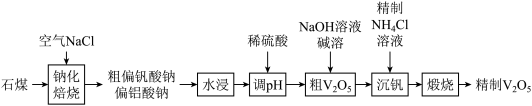
【推荐1】 (五氧化二钒)可作为化学工业中的催化剂,广泛用于冶金化工等行业,工业上以石煤(含有
(五氧化二钒)可作为化学工业中的催化剂,广泛用于冶金化工等行业,工业上以石煤(含有 、
、 、
、 等)来制备
等)来制备 的一种工艺流程如下:
的一种工艺流程如下:
已知:① (偏钒酸铵)是白色粉末,微溶于冷水,可溶于热水
(偏钒酸铵)是白色粉末,微溶于冷水,可溶于热水
② 、
、 沉淀生成和溶解的pH如表所示:
沉淀生成和溶解的pH如表所示:
回答下列问题:
(1)写出基态V原子价电子轨道表示式:_______ 。
(2)“钠化焙烧”过程中 转化为可溶性
转化为可溶性 ,同时有黄绿色气体生成,其化学方程式为
,同时有黄绿色气体生成,其化学方程式为_______ 。焙烧炉中可用 代替NaCl与石煤焙烧制得偏钒酸钠。用
代替NaCl与石煤焙烧制得偏钒酸钠。用 代替NaCl的优点是
代替NaCl的优点是_______ 。
(3)“调pH”分两步操作完成:第一步向水浸后溶液中加入稀硫酸“沉铝”,调节pH的范围为_______ ,过滤;第二步继续向滤液中滴加稀硫酸,调节pH的范围为_______ ,过滤得到粗 。
。
(4)“沉钒”时加入精制 溶液,若温度超过80℃以后沉钒率将会下降,其原因是
溶液,若温度超过80℃以后沉钒率将会下降,其原因是_______ 。
(5)已知:室温下,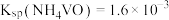 、
、 ,向偏钒酸铵的悬浊液中加入
,向偏钒酸铵的悬浊液中加入 ,当溶液中
,当溶液中 时,溶液中的
时,溶液中的
_______ 。
(6)产品纯度测定:将mg产品溶于足量稀硫酸配成100mL ,溶液。取20.00mL该溶液于锥形瓶中,用a mol/L
,溶液。取20.00mL该溶液于锥形瓶中,用a mol/L 标准液进行滴定,经过三次滴定,达到滴定终点时平均消耗标准液的体积为20.00mL。
标准液进行滴定,经过三次滴定,达到滴定终点时平均消耗标准液的体积为20.00mL。
资料:钒的盐类的颜色五光十色,有绿的、红的、黑的、黄的,绿的碧如翡翠,黑的犹如浓墨。这些色彩缤纷的钒的化合物,常被制成鲜艳的颜料。如: 溶液为黄色,
溶液为黄色, 溶液为蓝色,而
溶液为蓝色,而 则是红色的,黄色、蓝色混合后的颜色为黄绿色。
则是红色的,黄色、蓝色混合后的颜色为黄绿色。
①完成下列滴定过程的离子方程式________

②该滴定实验不需要另外加入指示剂,达到滴定终点的现象是_______ 。
③产品中 的质量分数是
的质量分数是_______ %。
 (五氧化二钒)可作为化学工业中的催化剂,广泛用于冶金化工等行业,工业上以石煤(含有
(五氧化二钒)可作为化学工业中的催化剂,广泛用于冶金化工等行业,工业上以石煤(含有 、
、 、
、 等)来制备
等)来制备 的一种工艺流程如下:
的一种工艺流程如下:
已知:①
 (偏钒酸铵)是白色粉末,微溶于冷水,可溶于热水
(偏钒酸铵)是白色粉末,微溶于冷水,可溶于热水②
 、
、 沉淀生成和溶解的pH如表所示:
沉淀生成和溶解的pH如表所示:| 物质 | 溶液pH | |||
| 开始沉淀 | 完全沉淀 | 沉淀开始溶解 | 沉淀完全溶解 | |
 | 2.2 | 5.1 | 7.1 | 8.1 |
 | 3.3 | 4.7 | 8.7 | 12.8 |
(1)写出基态V原子价电子轨道表示式:
(2)“钠化焙烧”过程中
 转化为可溶性
转化为可溶性 ,同时有黄绿色气体生成,其化学方程式为
,同时有黄绿色气体生成,其化学方程式为 代替NaCl与石煤焙烧制得偏钒酸钠。用
代替NaCl与石煤焙烧制得偏钒酸钠。用 代替NaCl的优点是
代替NaCl的优点是(3)“调pH”分两步操作完成:第一步向水浸后溶液中加入稀硫酸“沉铝”,调节pH的范围为
 。
。(4)“沉钒”时加入精制
 溶液,若温度超过80℃以后沉钒率将会下降,其原因是
溶液,若温度超过80℃以后沉钒率将会下降,其原因是(5)已知:室温下,
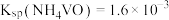 、
、 ,向偏钒酸铵的悬浊液中加入
,向偏钒酸铵的悬浊液中加入 ,当溶液中
,当溶液中 时,溶液中的
时,溶液中的
(6)产品纯度测定:将mg产品溶于足量稀硫酸配成100mL
 ,溶液。取20.00mL该溶液于锥形瓶中,用a mol/L
,溶液。取20.00mL该溶液于锥形瓶中,用a mol/L 标准液进行滴定,经过三次滴定,达到滴定终点时平均消耗标准液的体积为20.00mL。
标准液进行滴定,经过三次滴定,达到滴定终点时平均消耗标准液的体积为20.00mL。资料:钒的盐类的颜色五光十色,有绿的、红的、黑的、黄的,绿的碧如翡翠,黑的犹如浓墨。这些色彩缤纷的钒的化合物,常被制成鲜艳的颜料。如:
 溶液为黄色,
溶液为黄色, 溶液为蓝色,而
溶液为蓝色,而 则是红色的,黄色、蓝色混合后的颜色为黄绿色。
则是红色的,黄色、蓝色混合后的颜色为黄绿色。①完成下列滴定过程的离子方程式

②该滴定实验不需要另外加入指示剂,达到滴定终点的现象是
③产品中
 的质量分数是
的质量分数是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】工业废水中常含有一定量的Cr2O 和CrO
和CrO ,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为:
,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为:
CrO
 Cr2O
Cr2O
 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
其中第①步存在平衡:2CrO (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O
(橙色)+H2O
(1)24Cr的价层 电子轨道表示式为______ 。
(2)Cr元素在自然界有4种同位素,其丰度如表所示:
则 元素的近似相对原子质量为
元素的近似相对原子质量为______ (结果保留2位小数)。
(3)若第①步中平衡体系的pH=2,则该溶液显_____ 色;向该溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀)则平衡_____ 移动(填“向左”或“向右”或“不变”)。
(4)能说明第①步反应达平衡状态的是_____ (填字母)。
A.Cr2O 和CrO
和CrO 的浓度相同 B.2v(Cr2O
的浓度相同 B.2v(Cr2O )=v(CrO
)=v(CrO ) C.溶液的颜色不变
) C.溶液的颜色不变
(5)第②步中,还原1molCr2O 离子,需要
离子,需要_____ mol的FeSO4•7H2O。
(6)第③步生成Cr(OH)3沉淀前,先向[Cr3+]=0.1mol•L-1的溶液中加碱,调节pH至_____~___________ 分离回收Fe(OH)3。
(已知:常温下,Fe(OH)3的溶度积Ksp=1×10-39,Cr(OH)3的溶度积Ksp=1×10-32;某种离子的浓度小于10-5mol•L-1时,认为其完全沉淀)
铬酸钠(Na2CrO4)常用于印染、颜料、油漆等领域,25℃时铬酸钠溶液中含铬微粒的分布分数与pH值关系如图所示。

(7)写出Na2CrO4水解的离子方程式______ ,计算25℃时该反应的水解常数Kh=______ 。
(8)pH=5时,[Na+]______ 2[CrO ]+2[HCrO
]+2[HCrO ]+2[Cr2O
]+2[Cr2O ](填“>”、“<”或“=”)。
](填“>”、“<”或“=”)。
 和CrO
和CrO ,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为:
,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为:CrO

 Cr2O
Cr2O
 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓其中第①步存在平衡:2CrO
 (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O
(橙色)+H2O(1)24Cr的
(2)Cr元素在自然界有4种同位素,其丰度如表所示:
| 质量数 | 50 | 52 | 53 | 54 |
| 丰度 | 4.31% | 83.76% | 9.55% | 2.38% |
 元素的近似相对原子质量为
元素的近似相对原子质量为(3)若第①步中平衡体系的pH=2,则该溶液显
(4)能说明第①步反应达平衡状态的是
A.Cr2O
 和CrO
和CrO 的浓度相同 B.2v(Cr2O
的浓度相同 B.2v(Cr2O )=v(CrO
)=v(CrO ) C.溶液的颜色不变
) C.溶液的颜色不变(5)第②步中,还原1molCr2O
 离子,需要
离子,需要(6)第③步生成Cr(OH)3沉淀前,先向[Cr3+]=0.1mol•L-1的溶液中加碱,调节pH至_____~______
(已知:常温下,Fe(OH)3的溶度积Ksp=1×10-39,Cr(OH)3的溶度积Ksp=1×10-32;某种离子的浓度小于10-5mol•L-1时,认为其完全沉淀)
铬酸钠(Na2CrO4)常用于印染、颜料、油漆等领域,25℃时铬酸钠溶液中含铬微粒的分布分数与pH值关系如图所示。

(7)写出Na2CrO4水解的离子方程式
(8)pH=5时,[Na+]
 ]+2[HCrO
]+2[HCrO ]+2[Cr2O
]+2[Cr2O ](填“>”、“<”或“=”)。
](填“>”、“<”或“=”)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】X、Y、Z、W、N五种元素中,X原子核外的M层中只有两个成对电子,Y原子的外围电子排布式为nsnnpn+1,Z是地壳内含量(质量分数)最高的元素,W的核电荷数是X与Z的核电荷数之和,N在元素周期表的各元素中电负性最大。
(1)Z元素基态原子的电子排布图为_______________________
(2)W的元素符号是_______ ,在周期表中的位置是_____________ ,其基态原子的电子排布式为_________ ,在形成化合物时它的最高化合价为____________
(3)Y的氢化物的VSEPR模型是_________ ,属于_________ 分子(填极性或非极性),
(4)X的氢化物的沸点_____ Z的氢化物的沸点(填大于、小于或等于),原因是_________
(5)用氢键表示式写出N的氢化物溶液中存在的所有氢键_______________________
(1)Z元素基态原子的电子排布图为
(2)W的元素符号是
(3)Y的氢化物的VSEPR模型是
(4)X的氢化物的沸点
(5)用氢键表示式写出N的氢化物溶液中存在的所有氢键
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】磷是重要的生命元素之一,存在于细胞、蛋白质、骨骼和牙齿中。回答下列问题:
(1)基态P原子核外电子占据的原子轨道数为___________ 。
(2)白磷与足量热的NaOH溶液反应产生磷化氢(PH3)和次磷酸钠(NaH2PO2),其反应的化学方程式为P4+3NaOH(热,浓)+3H2O=3NaH2PO2+PH3.白磷(4P)中P的杂化类型为___________ ,次磷酸(H3PO2)的结构式为___________ ,次磷酸钠中各元素的电负性由大到小的顺序是___________ ,写出一种与PH3互为等电子体的离子___________ (填微粒符号)。
(3)PH3与过渡金属Pt形成的一种配合物[PtCl2(PH3)2]比[PtCl2(NH3)2]稳定的原因是___________ 。
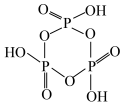
(4)磷酸聚合可以生成链状多磷酸或环状多磷酸。其中环状多磷酸是由3个或3个以上磷氧四面体通过共用氧原子环状连接而成,常见的三聚环状多磷酸结构如图所示,则n聚环状多磷酸的通式为___________ (用含n的式子表示)。
(5)磷化铝熔点为2000°C,其结构与晶体硅类似,磷化铝晶胞结构如图所示,晶胞中磷原子空间堆积方式为___________ ,已知该晶体的密度为ρg·cm-3,则最近的Al和P原子间的核间距为___________ pm(用NA表示阿伏加德罗常数的值,列出计算式即可)。

(1)基态P原子核外电子占据的原子轨道数为
(2)白磷与足量热的NaOH溶液反应产生磷化氢(PH3)和次磷酸钠(NaH2PO2),其反应的化学方程式为P4+3NaOH(热,浓)+3H2O=3NaH2PO2+PH3.白磷(4P)中P的杂化类型为
(3)PH3与过渡金属Pt形成的一种配合物[PtCl2(PH3)2]比[PtCl2(NH3)2]稳定的原因是
(4)磷酸聚合可以生成链状多磷酸或环状多磷酸。其中环状多磷酸是由3个或3个以上磷氧四面体通过共用氧原子环状连接而成,常见的三聚环状多磷酸结构如图所示,则n聚环状多磷酸的通式为

(5)磷化铝熔点为2000°C,其结构与晶体硅类似,磷化铝晶胞结构如图所示,晶胞中磷原子空间堆积方式为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】【化学一选修3:物质结构与性质】A、B、C、D、E五种元素的原子序数依次增大。A 是原子半径最小的元素;B的最外层电子数是次外层电子数的2倍; D的L能层有两对成对电子;E+的核外有三个能层,且都外于全满状态。试回答下列问题:
(1)基态E原子核外电子的排布式为___________________ 。
(2)B、C、D三种元素的电负性由大到小的顺序是____________ (填元素符号)。A、C、D三种元素形成的常见离子化合物中阳离子的空间构型为_____________ ,阴离子的中心原子轨道采用______________ 杂化。
(3)E(CA3) 离子的颜色是
离子的颜色是___________ ;含有化学键类型是_____________ ;离子中C原子杂化轨道类型是__________________ 。
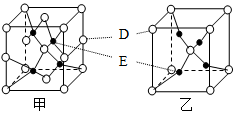
(4)D、E能形成两种晶体,其晶胞分别如甲、乙两图。晶体乙中,E的配位数为_________ ;在一定条件下,甲和C2A4反应生成乙,同时生成在常温下分别为气体和液体的另外两种常见无污染物质。该化学反应方程式为______________________ 。
(5)若甲的密度为ρ g/cm3,NA表示阿伏伽德罗常数,则甲晶胞的边长可表示为_________ cm。
(1)基态E原子核外电子的排布式为
(2)B、C、D三种元素的电负性由大到小的顺序是
(3)E(CA3)
 离子的颜色是
离子的颜色是(4)D、E能形成两种晶体,其晶胞分别如甲、乙两图。晶体乙中,E的配位数为

(5)若甲的密度为ρ g/cm3,NA表示阿伏伽德罗常数,则甲晶胞的边长可表示为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】按照要求回答下列问题。
(1)基态Cu原子的电子排布式为_______ 。
(2)在基态13N原子中,核外存在_______ 对自旋相反的电子。
(3)NH3BH3分子中,与N原子相连的H原子呈正电性(Hδ+),与B原子相连的H原子呈负电性(Hδ-),电负性由小到大的顺序为_______ 。
(4)等浓度、等体积的醋酸和氢氧化钠混合后,溶液中离子浓度大小顺序为_______ 。
(5)已知常温下H2C2O4的电离平衡常数Ka1=5.4×10-2,Ka2=5.4×10-5,反应NH3·H2O+HC2O
 NH
NH +C2O
+C2O +H2O的平衡常数K=9.45×104,则 NH3·H2O的电离平衡常数Kb=
+H2O的平衡常数K=9.45×104,则 NH3·H2O的电离平衡常数Kb=_______ 。
(6)已知钼酸钠溶液中c(MoO )=0.40 mol/L,c(CO
)=0.40 mol/L,c(CO )=0.08 mol/L,由钼酸钠溶液制备钼酸钠晶体时,需要加入Ba(OH)2固体以除去CO
)=0.08 mol/L,由钼酸钠溶液制备钼酸钠晶体时,需要加入Ba(OH)2固体以除去CO ,当BaMoO4开始沉淀时,CO
,当BaMoO4开始沉淀时,CO 的去除率是
的去除率是_______ 【已知Ksp(BaCO3)=1.0×10-9,Ksp(BaMoO4)=4.0×10-8,忽略溶液的体积变化】。
(1)基态Cu原子的电子排布式为
(2)在基态13N原子中,核外存在
(3)NH3BH3分子中,与N原子相连的H原子呈正电性(Hδ+),与B原子相连的H原子呈负电性(Hδ-),电负性由小到大的顺序为
(4)等浓度、等体积的醋酸和氢氧化钠混合后,溶液中离子浓度大小顺序为
(5)已知常温下H2C2O4的电离平衡常数Ka1=5.4×10-2,Ka2=5.4×10-5,反应NH3·H2O+HC2O

 NH
NH +C2O
+C2O +H2O的平衡常数K=9.45×104,则 NH3·H2O的电离平衡常数Kb=
+H2O的平衡常数K=9.45×104,则 NH3·H2O的电离平衡常数Kb=(6)已知钼酸钠溶液中c(MoO
 )=0.40 mol/L,c(CO
)=0.40 mol/L,c(CO )=0.08 mol/L,由钼酸钠溶液制备钼酸钠晶体时,需要加入Ba(OH)2固体以除去CO
)=0.08 mol/L,由钼酸钠溶液制备钼酸钠晶体时,需要加入Ba(OH)2固体以除去CO ,当BaMoO4开始沉淀时,CO
,当BaMoO4开始沉淀时,CO 的去除率是
的去除率是
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐1】I.2022年4月,大型运输机运—20向塞尔维亚远程投送“常规军事物质”,展示了大国重器“鲲鹏”的突出性能,为世人瞩目。
(1)运—20的外壳大量使用了AM系列Mg—Al—Mn,铝的价电子排布图为___ ,第一电离能铝___ (填“大于”、“等于”或“小于”)镁。
(2)为了减轻飞机的起飞重量并保持机身强度,运—20使用了大量的树脂材料,其中一种树脂材料的部分结构如图1所示,其中碳原子的杂化方式为____ ,其个数比为____ 。

II.大型飞机的高推重比发动机被誉为航空工业皇冠上的“宝石”,采用大量的金属钨作为耐高温耐磨损材料。
(3)钨元素位于第六周期第VIB族,价电子排布的能级与Cr相同,但排布方式与Cr有所不同,请写出钨原子的价层电子排布式___ 。
(4)图2为碳和钨形成的一种化合物的晶胞模型,碳原子和钨原子个数比为___ ,其中一个钨原子周围距离最近且相等的碳原子有___ 个。

(5)已知该晶胞边长为acm,高为hcm,NA为阿伏加德罗常数。摩尔质量为Mg·mol-1。该晶体密度为____ g·cm-3。
(1)运—20的外壳大量使用了AM系列Mg—Al—Mn,铝的价电子排布图为
(2)为了减轻飞机的起飞重量并保持机身强度,运—20使用了大量的树脂材料,其中一种树脂材料的部分结构如图1所示,其中碳原子的杂化方式为

II.大型飞机的高推重比发动机被誉为航空工业皇冠上的“宝石”,采用大量的金属钨作为耐高温耐磨损材料。
(3)钨元素位于第六周期第VIB族,价电子排布的能级与Cr相同,但排布方式与Cr有所不同,请写出钨原子的价层电子排布式
(4)图2为碳和钨形成的一种化合物的晶胞模型,碳原子和钨原子个数比为

(5)已知该晶胞边长为acm,高为hcm,NA为阿伏加德罗常数。摩尔质量为Mg·mol-1。该晶体密度为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】 具有钙钛矿型结构,因具有优异的电极化特性、铁磁性、非磁绝缘性等而备受关注。回答下列问题:
具有钙钛矿型结构,因具有优异的电极化特性、铁磁性、非磁绝缘性等而备受关注。回答下列问题:
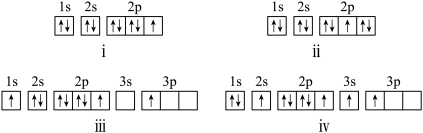
(1)下列F原子轨道表达式所表示的状态,能量由高到低的顺序正确的是_______  填选项字母
填选项字母 。
。
A.


(2)相同压强下,HF、HCl、HBr的沸点由高到低的顺序为_________ ,原因为_______ 。
(3)F元素可形成多种重要化合物,如 、
、 、
、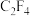 等。其中
等。其中 的VSEPR模型为
的VSEPR模型为_____________ ; 中N原子的杂化形式为
中N原子的杂化形式为__________ ;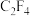 中
中 键与
键与 键的数目之比为
键的数目之比为_________ 。
(4)组成KCoF3的原子的第一电离能由小到大的顺序为___________ (用元素符号表示);其中三种原子基态时所含未成对电子数最多的是_________ (填元素符号)。
(5)KCoF3的立方晶胞结构如图所示,其中 采用简单立方堆积。
采用简单立方堆积。

①与K+紧邻的F原子个数为__________ 。
②若晶胞参数为anm,阿伏加 德罗常数的值为NA,则晶体密度为_______  (用含a、NA的代数式表示)。
(用含a、NA的代数式表示)。
 具有钙钛矿型结构,因具有优异的电极化特性、铁磁性、非磁绝缘性等而备受关注。回答下列问题:
具有钙钛矿型结构,因具有优异的电极化特性、铁磁性、非磁绝缘性等而备受关注。回答下列问题:(1)下列F原子轨道表达式所表示的状态,能量由高到低的顺序正确的是
 填选项字母
填选项字母 。
。
A.


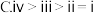

(2)相同压强下,HF、HCl、HBr的沸点由高到低的顺序为
(3)F元素可形成多种重要化合物,如
 、
、 、
、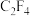 等。其中
等。其中 的VSEPR模型为
的VSEPR模型为 中N原子的杂化形式为
中N原子的杂化形式为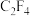 中
中 键与
键与 键的数目之比为
键的数目之比为(4)组成KCoF3的原子的第一电离能由小到大的顺序为
(5)KCoF3的立方晶胞结构如图所示,其中
 采用简单立方堆积。
采用简单立方堆积。
①与K+紧邻的F原子个数为
②若晶胞参数为anm,阿伏加 德罗常数的值为NA,则晶体密度为
 (用含a、NA的代数式表示)。
(用含a、NA的代数式表示)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】元素周期表中第四周期的某些元素在生产、生活中有着广泛的应用。回答下列问题:
(1)砷在自然界中分布广泛,主要用于制砷铅合金、砷铜合金。基态砷原子的价电子排布式为___________ ,砷、硒、溴三种元素电负性由小到大的顺序为___________ (填元素符号), 的空间构型是
的空间构型是___________ 形。
(2)科学家在研究金属矿物质组分的过程中,发现了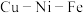 等多种金属互化物。确定某种金属互化物是晶体还是非晶体的实验是
等多种金属互化物。确定某种金属互化物是晶体还是非晶体的实验是___________ 。
(3) 能与
能与 反应生成
反应生成 ,其中碳原子的杂化方式是
,其中碳原子的杂化方式是___________ , 键和
键和 键数目之比为
键数目之比为___________ 。
(4) 是钴的一种配合物,向
是钴的一种配合物,向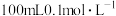 该配合物的溶液中加入足量
该配合物的溶液中加入足量 溶液,生成
溶液,生成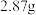 白色沉淀,则该配合物的化学式为
白色沉淀,则该配合物的化学式为___________ ,中心离子的配位数为___________ 。
(5)某离子型铁的氧化物晶胞如图所示,它由X、Y组成,则该氧化物的化学式为___________ 。已知该晶体的密度为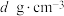 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体的晶胞参数
,则该晶体的晶胞参数
___________  (用含
(用含 和
和 的代数式表示)。
的代数式表示)。
(1)砷在自然界中分布广泛,主要用于制砷铅合金、砷铜合金。基态砷原子的价电子排布式为
 的空间构型是
的空间构型是(2)科学家在研究金属矿物质组分的过程中,发现了
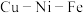 等多种金属互化物。确定某种金属互化物是晶体还是非晶体的实验是
等多种金属互化物。确定某种金属互化物是晶体还是非晶体的实验是(3)
 能与
能与 反应生成
反应生成 ,其中碳原子的杂化方式是
,其中碳原子的杂化方式是 键和
键和 键数目之比为
键数目之比为(4)
 是钴的一种配合物,向
是钴的一种配合物,向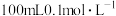 该配合物的溶液中加入足量
该配合物的溶液中加入足量 溶液,生成
溶液,生成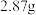 白色沉淀,则该配合物的化学式为
白色沉淀,则该配合物的化学式为(5)某离子型铁的氧化物晶胞如图所示,它由X、Y组成,则该氧化物的化学式为
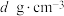 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则该晶体的晶胞参数
,则该晶体的晶胞参数
 (用含
(用含 和
和 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐1】金属钛因具有强度高、耐蚀性好、耐热性高等特点而被广泛用于各个领域。
(1)基态 Ti 原子核外电子排布的最高能级符号是____ 。与钛同周期的元素中基态原子未成对电子数与钛相同的有__________ 种。
(2)钛比钢轻,比铝硬,是一种新兴的结构材料。钛硬度比铝大的原因是_____ 。
(3)半夹心结构催化剂 M 其结构如图所示:

①组成该物的质元素中,电负性最大的是___________ (填元素符号)
②M中不含_________ (填标号)
a.π键 b.σ键 c.配位键 d.离子键 e.氢键
(4)TiO2能溶于浓硫酸并析出一种离子晶体,已知其中阳离子是以链状聚合物形式存在的钛酰阳离子,其结构如图所示,其化学式是______ 写出一种与阴离子 互为等电子体的分子
互为等电子体的分子______ 。

(5)钛单质的晶胞如图所示,该晶胞为______ 堆积(填堆积方式),钛原子的配位数是_______ ,已知晶胞参数:a=0.295nm,c=0.469nm。则该钛晶体的密度为___________ g·cm-3(NA表示阿伏加 德罗常数的数值,列出计算式即可)

(1)基态 Ti 原子核外电子排布的最高能级符号是
(2)钛比钢轻,比铝硬,是一种新兴的结构材料。钛硬度比铝大的原因是
(3)半夹心结构催化剂 M 其结构如图所示:

①组成该物的质元素中,电负性最大的是
②M中不含
a.π键 b.σ键 c.配位键 d.离子键 e.氢键
(4)TiO2能溶于浓硫酸并析出一种离子晶体,已知其中阳离子是以链状聚合物形式存在的钛酰阳离子,其结构如图所示,其化学式是
 互为等电子体的分子
互为等电子体的分子
(5)钛单质的晶胞如图所示,该晶胞为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐2】铁、锌、铜等过渡金属元素及其化合物在生产、生活中有着广泛应用。回答下列问题:
(1)基态Cu的核外电子排布式为___________ 。
(2)甘氨酸锌[(H2NCH2COO)2Zn]是 某种饲料添加剂,在该化合物中所涉及到的元素中,第一电离能最大的是______ ; C原子的杂化方式为:___________ 。
(3)Fe3+可与噻吩( )和吡咯(
)和吡咯( )形成配位化合物。试比较二者在水中的溶解度大小:噻吩
)形成配位化合物。试比较二者在水中的溶解度大小:噻吩___________ 吡咯(填“大于 ”或“小于”或“等于”),原因为:_____ 。
(4)硫酸亚铁铵[(NH4)2Fe(SO4)2]俗名摩尔盐,是一种重要的化工原料。固态摩尔盐的晶体类型为___________ ; 的空间构型为
的空间构型为___________ 。
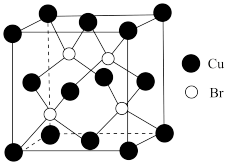
(5)某种铜的溴化物晶体结构如图所示。则该化合物的化学式为___________ ,设晶胞参数为anm,该铜的溴化物晶体的密度为___________ g·m-3。(用含a和NA的式子表示,NA为阿伏加德罗常数)
(1)基态Cu的核外电子排布式为
(2)甘氨酸锌[(H2NCH2COO)2Zn]是 某种饲料添加剂,在该化合物中所涉及到的元素中,第一电离能最大的是
(3)Fe3+可与噻吩(
 )和吡咯(
)和吡咯( )形成配位化合物。试比较二者在水中的溶解度大小:噻吩
)形成配位化合物。试比较二者在水中的溶解度大小:噻吩(4)硫酸亚铁铵[(NH4)2Fe(SO4)2]俗名摩尔盐,是一种重要的化工原料。固态摩尔盐的晶体类型为
 的空间构型为
的空间构型为(5)某种铜的溴化物晶体结构如图所示。则该化合物的化学式为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
解题方法
【推荐3】近日,科学家利用铁配合物催化氮气选择性转化成肼。如图所示(Et为乙基)。

回答下列问题:
(1)基态Fe原子最外层电子排布式为_______ 。基态N原子有_______ 种空间运动状态不同的电子。
(2)Fe(depe)(N2)所含元素中,电负性最大的元素是_______ 。P原子的杂化类型是_______ 。Fe(depe)(N2)中σ键数目和π键数目之比为_______ 。
(3)N2H4和H2S的相对分子质量相同,但是常温常压下,N2H4呈液态,而H2S呈气态,其主要原因是_______ 。
(4)NH3的VSEPR模型为_______ 。1molN2H4最多能与_______ molH+反应。
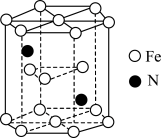
(5)铁和氮形成一种晶胞如图所示。已知:NA为阿伏加德罗常数的值,六棱柱底边的边长为apm,高为bpm,该晶体中Fe、N原子个数最简比为_______ 。该晶体的密度为_______ g·cm-3(只列计算式)。

回答下列问题:
(1)基态Fe原子最外层电子排布式为
(2)Fe(depe)(N2)所含元素中,电负性最大的元素是
(3)N2H4和H2S的相对分子质量相同,但是常温常压下,N2H4呈液态,而H2S呈气态,其主要原因是
(4)NH3的VSEPR模型为
(5)铁和氮形成一种晶胞如图所示。已知:NA为阿伏加德罗常数的值,六棱柱底边的边长为apm,高为bpm,该晶体中Fe、N原子个数最简比为

您最近一年使用:0次



