解题方法
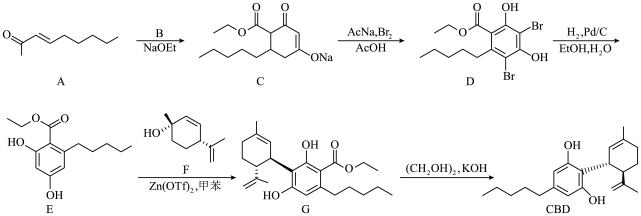
1 . 大麻二酚(CBD)具有降血糖、抗肿瘤、抗焦虑等多种生物活性。以下是CBD在医药工业上的一种合成路线,回答下列问题。___________ 。
(2)B的结构为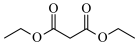 ,其化学名称是
,其化学名称是___________ ;D中含氧官能团的名称是___________ 。
(3)写出由E生成G的化学方程式___________ ,该反应类型为___________ 。
(4)已知X和A具有不同的官能团,其相对分子质量比A小14,同时满足如下条件的X的同分异构体Y共有___________ 种。(不考虑立体异构)
①1molY能与2mol[Ag(NH3)2]OH反应;②含有六元碳环。
满足上述条件的同分异构体中,只含有一个手性碳原子的Z是___________ (写出结构简式)。
(5)已知:R-CN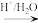 R-COOH.设计以Z与HCN为原料合成
R-COOH.设计以Z与HCN为原料合成 的路线(用流程图表示,其他无机试剂自选):
的路线(用流程图表示,其他无机试剂自选):___________ 。
(2)B的结构为
 ,其化学名称是
,其化学名称是(3)写出由E生成G的化学方程式
(4)已知X和A具有不同的官能团,其相对分子质量比A小14,同时满足如下条件的X的同分异构体Y共有
①1molY能与2mol[Ag(NH3)2]OH反应;②含有六元碳环。
满足上述条件的同分异构体中,只含有一个手性碳原子的Z是
(5)已知:R-CN
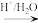 R-COOH.设计以Z与HCN为原料合成
R-COOH.设计以Z与HCN为原料合成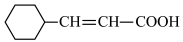 的路线(用流程图表示,其他无机试剂自选):
的路线(用流程图表示,其他无机试剂自选):
您最近一年使用:0次
名校
解题方法
2 . 晶体的特殊性质是科学家不断研究和探索的新领域,根据你对晶体的认识,回答下列问题。
(1)一种发光二极管的半导体材料为GaAsxP1-x,该化合物中Ga、As、P的电负性从大到小的顺序为_______ 。
(2)下表列出了钠的卤化物和硅的卤化物的熔点:
从表中可以看出,钠的卤化物的熔点比相应的硅的卤化物的熔点高很多,请用所学知识简单解释:_______ 。
(3)磷化硼(BP)是受高度关注的耐磨材料,可作为金属表面的保护层,其结构与金刚石类似,晶胞结构如图所示。B的杂化类型为_______ 。磷化硼晶胞沿z轴在xy平面的投影图中,B原子构成的几何形状是_______ 。已知晶胞边长为458pm,假设 是阿伏加德罗常数的值,则磷化硼晶体的密度是
是阿伏加德罗常数的值,则磷化硼晶体的密度是_______ g•cm-3(列出计算式)。
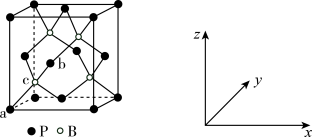
(4)原子坐标参数可表示晶胞内部各原子的相对位置。上图中原子坐标参数a为(0,0,0),b为( ,0,
,0, ),则c原子的坐标参数为
),则c原子的坐标参数为_______ 。
(1)一种发光二极管的半导体材料为GaAsxP1-x,该化合物中Ga、As、P的电负性从大到小的顺序为
(2)下表列出了钠的卤化物和硅的卤化物的熔点:
| NaX | NaF | NaCl | NaBr | NaI |
| 熔点/℃ | 995 | 801 | 775 | 651 |
| SiX4 | SiF4 | SiCl4 | SiBr4 | SiI4 |
| 熔点/℃ | -90.2 | -70.4 | 5.2 | 120.5 |
(3)磷化硼(BP)是受高度关注的耐磨材料,可作为金属表面的保护层,其结构与金刚石类似,晶胞结构如图所示。B的杂化类型为
 是阿伏加德罗常数的值,则磷化硼晶体的密度是
是阿伏加德罗常数的值,则磷化硼晶体的密度是
(4)原子坐标参数可表示晶胞内部各原子的相对位置。上图中原子坐标参数a为(0,0,0),b为(
 ,0,
,0, ),则c原子的坐标参数为
),则c原子的坐标参数为
您最近一年使用:0次
名校
解题方法
3 . 据世界权威刊物《自然》最近报道,选择碲化锆 (ZrTe5) 为材料验证了三维量子霍尔效应,并发现了金属-绝缘体的转换。Te属于ⅥA族元素。回答下列问题:
(1)锆(Zr)的简化电子排布式为[Kr]4d25s2,锆原子中d轨道上的电子数是_______ ,Zr2+的价层电子轨道表示式是_______ 。
(2)Zr、Te、Cl的电负性由大到小的顺序是_______ ,H2O、H2Se、H2Te的沸点由高到低的顺序是_______ 酸性强弱比较: H2SO4_______ H2TeO4 (填“>”或“<”)。
(3)H2Te和CO2均为三原子分子,但它们的键角差别较大,试用杂化轨道理论解释,理由是_______ 。
(4)[Zr(C2H5O)2]2+是 Zr4+形成的一种配离子,其中的配位原子是_______ (填原子符号),1个[Zr(C2H5O)2]2+离子中含共价键的数目是_______ 。
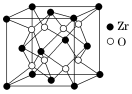
(5)立方氧化锆是一种人工合成的氧化物,其硬度极高,可用于陶瓷和耐火材料,其晶胞结构如图所示。Zr原子的配位数是_______ 。 若晶胞中距离最近的两个氧原子间的距离为a nm,则立方氧化锆的密度为_______ g·cm-3 (写出计算表达式)。
(1)锆(Zr)的简化电子排布式为[Kr]4d25s2,锆原子中d轨道上的电子数是
(2)Zr、Te、Cl的电负性由大到小的顺序是
(3)H2Te和CO2均为三原子分子,但它们的键角差别较大,试用杂化轨道理论解释,理由是
(4)[Zr(C2H5O)2]2+是 Zr4+形成的一种配离子,其中的配位原子是
(5)立方氧化锆是一种人工合成的氧化物,其硬度极高,可用于陶瓷和耐火材料,其晶胞结构如图所示。Zr原子的配位数是

您最近一年使用:0次
名校
4 . 铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
(1)基态钴原子的核外未成对电子数为_______ 。
(2) 的晶体结构与晶体硅的相似,其中C原子的杂化方式为
的晶体结构与晶体硅的相似,其中C原子的杂化方式为_______ 。
(3) 的熔点为
的熔点为 ,沸点为
,沸点为 ,
, 的晶体类型是
的晶体类型是_______ 。
(4)橙红色晶体羰基钴的熔点为 ,分子式为
,分子式为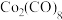 ,是一种重要的无机金属配合物,可溶于多数有机溶剂。三种元素电负性由大到小的顺序为(填元素符号)
,是一种重要的无机金属配合物,可溶于多数有机溶剂。三种元素电负性由大到小的顺序为(填元素符号)_______ 。元素铁、钴、镍并称铁系元素,性质具有相似性。某含镍化合物结构如图所示,分子内 的作用力不可能含有_______ (填序号)。
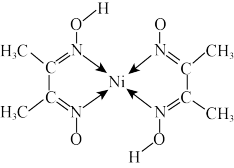
A.离子键 B.共价键 C.金属键 D.配位键 E.氢键 F.范德华力
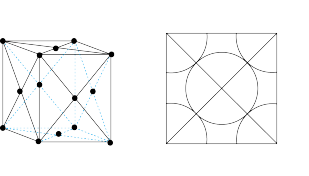
(5)铜为面心立方最密堆积的金属,其晶胞结构如图所示,已知铜原子的半径为 ,则铜晶体的密度
,则铜晶体的密度
_______  (只需列出计算式)。
(只需列出计算式)。
(1)基态钴原子的核外未成对电子数为
(2)
 的晶体结构与晶体硅的相似,其中C原子的杂化方式为
的晶体结构与晶体硅的相似,其中C原子的杂化方式为(3)
 的熔点为
的熔点为 ,沸点为
,沸点为 ,
, 的晶体类型是
的晶体类型是(4)橙红色晶体羰基钴的熔点为
 ,分子式为
,分子式为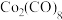 ,是一种重要的无机金属配合物,可溶于多数有机溶剂。三种元素电负性由大到小的顺序为(填元素符号)
,是一种重要的无机金属配合物,可溶于多数有机溶剂。三种元素电负性由大到小的顺序为(填元素符号)
A.离子键 B.共价键 C.金属键 D.配位键 E.氢键 F.范德华力
(5)铜为面心立方最密堆积的金属,其晶胞结构如图所示,已知铜原子的半径为
 ,则铜晶体的密度
,则铜晶体的密度
 (只需列出计算式)。
(只需列出计算式)。
您最近一年使用:0次
2022-10-08更新
|
212次组卷
|
2卷引用:山西省大同市博盛中学2022-2023学年高三上学期第二次质量检测化学试题
2022高三·全国·专题练习
5 . 以 、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
(1)基态O原子的电子排布式_______ ,其中未成对电子有_______ 个。
(2)Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是_______ 。
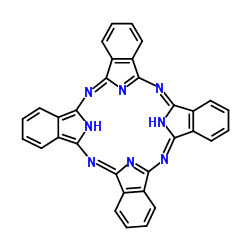
(3)酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取_______ 杂化。邻苯二甲酸酐( )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺(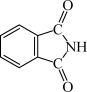 )都是合成酞菁的原料,后者熔点高于前者,主要原因是
)都是合成酞菁的原料,后者熔点高于前者,主要原因是_______ 。
(4)金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为_______ 。
(5)ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn-N键中离子键成分的百分数小于Zn-O键,原因是_______ 。
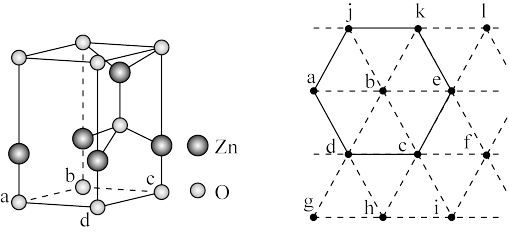
(6)下图为某ZnO晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。 为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面_______ 、_______ 。
 、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:(1)基态O原子的电子排布式
(2)Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是
(3)酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取
 )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺( )都是合成酞菁的原料,后者熔点高于前者,主要原因是
)都是合成酞菁的原料,后者熔点高于前者,主要原因是
(4)金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为
(5)ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn-N键中离子键成分的百分数小于Zn-O键,原因是
(6)下图为某ZnO晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。
 为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面
您最近一年使用:0次
2022-07-04更新
|
9173次组卷
|
11卷引用:山西省晋中市祁县中学2022-2023学年高三上学期10月月考化学试题
山西省晋中市祁县中学2022-2023学年高三上学期10月月考化学试题(已下线)专题17 物质结构与性质(综合题)-2022年高考真题模拟题分项汇编2022年海南省高考真题化学试题(已下线)2022年海南省高考真题变式题15-19(已下线)热点情景汇编-专题十四 结构性质中的新材料(已下线)专题九 物质结构与性质-实战高考·二轮复习核心突破(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)专题17 物质结构与性质综合题-2023年高考化学真题题源解密(新高考专用)(已下线)第19练 物质结构与性质综合题难点突破-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)【知识图鉴】单元讲练测选择性必修2第三章03单元测
6 . 硒( )是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(
)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光( )效应以来,
)效应以来, 在发光材料、生物医学等领域引起广泛关注。一种含
在发光材料、生物医学等领域引起广泛关注。一种含 的新型
的新型 分子
分子 的合成路线如下:
的合成路线如下: 与S同族,基态硒原子价电子排布式为
与S同族,基态硒原子价电子排布式为_______ 。
(2) 的沸点低于
的沸点低于 ,其原因是
,其原因是_______ 。
(3)关于I~III三种反应物,下列说法正确的有_______ 。
A.I中仅有 键
键
B.I中的 键为非极性共价键
键为非极性共价键
C.II易溶于水
D.II中原子的杂化轨道类型只有 与
与
E.I~III含有的元素中,O电负性最大
(4)IV中具有孤对电子的原子有_______ 。
(5)硒的两种含氧酸的酸性强弱为
_______  (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠( )可减轻重金属铊引起的中毒。
)可减轻重金属铊引起的中毒。 的立体构型为
的立体构型为_______ 。
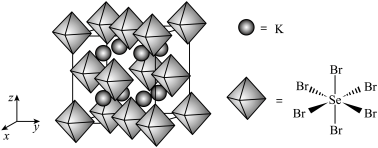
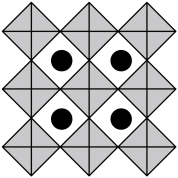
(6)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。_______ 。
②设X的最简式的式量为 ,晶体密度为
,晶体密度为 ,则X中相邻K之间的最短距离为
,则X中相邻K之间的最短距离为_______  (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 )是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(
)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光( )效应以来,
)效应以来, 在发光材料、生物医学等领域引起广泛关注。一种含
在发光材料、生物医学等领域引起广泛关注。一种含 的新型
的新型 分子
分子 的合成路线如下:
的合成路线如下: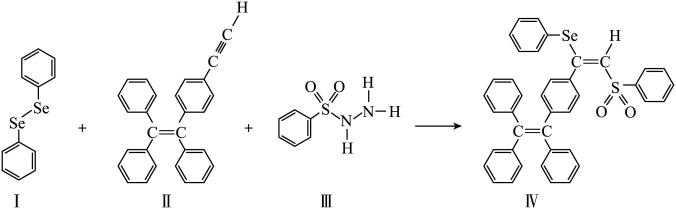
 与S同族,基态硒原子价电子排布式为
与S同族,基态硒原子价电子排布式为(2)
 的沸点低于
的沸点低于 ,其原因是
,其原因是(3)关于I~III三种反应物,下列说法正确的有
A.I中仅有
 键
键B.I中的
 键为非极性共价键
键为非极性共价键C.II易溶于水
D.II中原子的杂化轨道类型只有
 与
与
E.I~III含有的元素中,O电负性最大
(4)IV中具有孤对电子的原子有
(5)硒的两种含氧酸的酸性强弱为

 (填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(
(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠( )可减轻重金属铊引起的中毒。
)可减轻重金属铊引起的中毒。 的立体构型为
的立体构型为(6)我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。
②设X的最简式的式量为
 ,晶体密度为
,晶体密度为 ,则X中相邻K之间的最短距离为
,则X中相邻K之间的最短距离为 (列出计算式,
(列出计算式, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
2022-06-10更新
|
12643次组卷
|
28卷引用:山西省晋城市第一中学2022-2023学年高三上学期第五次调研考试化学试题
山西省晋城市第一中学2022-2023学年高三上学期第五次调研考试化学试题2022年新高考广东化学高考真题(已下线)2022年广东卷高考真题变式题(17-21)(已下线)专题17 物质结构与性质(综合题)-2022年高考真题模拟题分项汇编(已下线)专题18 物质结构与性质(综合题)-三年(2020-2022)高考真题分项汇编(已下线)专题九 物质结构与性质-实战高考·二轮复习核心突破(已下线)第一部分 二轮专题突破 大题突破4 物质结构与性质大题研究(选考)(已下线)题型11 物质结构与性质的综合分析与推断(已下线)回归教材重难点12 原子、分子和晶体结构再归纳-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)(已下线)专题20 结构与性质(已下线)专题20 结构与性质(已下线)T35-物质结构与性质(已下线)专题17 物质结构与性质综合题-2023年高考化学真题题源解密(新高考专用)广东省汕头市金禧中学2023-024学年高三上学期第一次阶段考试化学试题上海市实验学校2023-2024学年高三上学期第一次月考化学试题四川省眉山市仁寿第一中学校(北校区)2023-2024学年高三上学期11月期中考试理综化学试题山东省日照神州天立高级中学高复部2023-2024学年高三上学期12月份阶段性测试化学试题北京市东直门中学2023-2024学年高三上学期12月阶段测试化学试题2024届四川省眉山市仁寿县高三下学期三诊模拟联考理综试题-高中化学(已下线)第19练 物质结构与性质综合题难点突破-2022年【暑假分层作业】高二化学(2023届一轮复习通用)山东省菏泽市单县二中2021-2022学年高二下学期期末测试化学试题广东省广州中学2022-2023学年高二下学期期中考试化学试题江西省景德镇一中2022-2023学年高二下学期期中考试(19班)化学试题河南省淮滨高级中学2022-2023学年高二下学期期中教学质量检测化学试题(已下线)第21练 物质结构与性质综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)河南省信阳市第十高级中学2022-2023学年高二下学期期中教学质量检测化学试卷广东省四会中学、广信中学2023-2024学年高二下学期第一次联合考试化学试题广东省广州市第六十五中学2023-2024学年高二下学期期中考试化学试题
7 . 铁、钴、镍等金属及其化合物在科学研究和工业生产中应用非常广泛。回答下列问题:
(1)基态铁原子的核外电子排布式为___________ 。
(2)K3[Fe(CN)6 ]溶液可以检验Fe2+。K3[Fe(CN)6]中含有的σ键与π键的数目之比___________ , 与CN-互为等电子体的分子有___________ (举一例,填化学式)。
(3)酞菁钴的结构简式如图所示,其中三种非金属元素的电负性由大到小的顺序为___________ 。

(4)NiSO4是制备磁性材料和催化剂的重要中间体, 的空间构型为
的空间构型为___________ ,硫原子的杂化方式为___________ 。
(5)某氮化铁的晶胞结构如图所示:
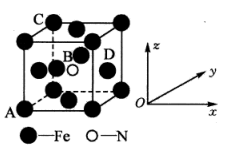
①原子坐标参数表示晶胞内部各原子的相对位置。如图晶胞中,原子坐标参数A(0,0,0);B为( ,
, ,
, );C为(0,1,1)。则D原子的坐标参数为
);C为(0,1,1)。则D原子的坐标参数为___________ 。
②若该晶体的密度是ρg·cm-3 ,则晶胞中两个最近的Fe的核间距为___________ cm(用含ρ的代数式表示,NA表示阿伏加德罗常数的值)。
(1)基态铁原子的核外电子排布式为
(2)K3[Fe(CN)6 ]溶液可以检验Fe2+。K3[Fe(CN)6]中含有的σ键与π键的数目之比
(3)酞菁钴的结构简式如图所示,其中三种非金属元素的电负性由大到小的顺序为

(4)NiSO4是制备磁性材料和催化剂的重要中间体,
 的空间构型为
的空间构型为(5)某氮化铁的晶胞结构如图所示:

①原子坐标参数表示晶胞内部各原子的相对位置。如图晶胞中,原子坐标参数A(0,0,0);B为(
 ,
, ,
, );C为(0,1,1)。则D原子的坐标参数为
);C为(0,1,1)。则D原子的坐标参数为②若该晶体的密度是ρg·cm-3 ,则晶胞中两个最近的Fe的核间距为
您最近一年使用:0次
解题方法
8 . 我国科学家开发了一种高电化学活性和水氧稳定的方酸锂可作为电池电解质的锂补偿剂和锂源。回答下列问题:
(1)方酸可用作合成有机光导体、液晶显示材料等的中间体,其结构如图所示。

①1 mol方酸中含有的σ键数目为___________ ,其中 C的杂化轨道类型是___________ 。
②羧基中的羟基极性越大,越易电离出H+。三氟乙酸(CF3COOH)的酸性大于三氯乙酸(CCl3COOH),试从键的极性分析其原因可能是___________ 。
(2)LiClO4 、LiBF4、LiPF4等离子液体也常作为锂离子电池的电解质。
①LiClO4中阴离子的空间结构名称是___________ 。
② 是一种配离子,请从配位键来解释其形成过程:
是一种配离子,请从配位键来解释其形成过程:___________ 。
③LiPF6在一定条件下可分解生成PF5比较PF5和PCl5的热分解温度高低,利用键参数说明理由:_______ 。
(3)1975年,锂键首次被实验证实,即X…Li-Y(X代表NH3, , H2O,CH3OCH3;Y代表Cl,Br)。锂键和氢键类似,但也有不同,下列有关说法错误的是___________(填字母)。
, H2O,CH3OCH3;Y代表Cl,Br)。锂键和氢键类似,但也有不同,下列有关说法错误的是___________(填字母)。
(4)磷酸亚铁锂是一种锂离子电池的正极材料,其晶胞结构示意图如图(a)所示,其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO4的单元数有___________ 个,电池充电时,LiFePO4脱出部分Li+ ,形成Li1-xFePO4,结构示意图如图(b)所示,则x=___________ 。

(5)用于制造激光器的KH2PO4大晶体是由水溶液结晶出来的。分别用 、●表示
、●表示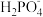 和K+,KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是
和K+,KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是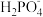 、K+在晶胞xz面、yz面上的位置,则晶胞在x轴方向上的投影图为
、K+在晶胞xz面、yz面上的位置,则晶胞在x轴方向上的投影图为___________ (填字母)。

(1)方酸可用作合成有机光导体、液晶显示材料等的中间体,其结构如图所示。

①1 mol方酸中含有的σ键数目为
②羧基中的羟基极性越大,越易电离出H+。三氟乙酸(CF3COOH)的酸性大于三氯乙酸(CCl3COOH),试从键的极性分析其原因可能是
(2)LiClO4 、LiBF4、LiPF4等离子液体也常作为锂离子电池的电解质。
①LiClO4中阴离子的空间结构名称是
②
 是一种配离子,请从配位键来解释其形成过程:
是一种配离子,请从配位键来解释其形成过程:③LiPF6在一定条件下可分解生成PF5比较PF5和PCl5的热分解温度高低,利用键参数说明理由:
(3)1975年,锂键首次被实验证实,即X…Li-Y(X代表NH3,
 , H2O,CH3OCH3;Y代表Cl,Br)。锂键和氢键类似,但也有不同,下列有关说法错误的是___________(填字母)。
, H2O,CH3OCH3;Y代表Cl,Br)。锂键和氢键类似,但也有不同,下列有关说法错误的是___________(填字母)。| A.形成氢键(X-H…Y)三原子不一定在一条直线上。 |
| B.氢键具有部分共价键的性质,锂键可能具有部分离子键的性质 |
| C.电负性:Cl>Br;第一电离能:Cl>Br |
D. 分子间能形成氢键, CH3OCH3分子间不能形成氢键 分子间能形成氢键, CH3OCH3分子间不能形成氢键 |

(5)用于制造激光器的KH2PO4大晶体是由水溶液结晶出来的。分别用
 、●表示
、●表示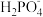 和K+,KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是
和K+,KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是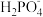 、K+在晶胞xz面、yz面上的位置,则晶胞在x轴方向上的投影图为
、K+在晶胞xz面、yz面上的位置,则晶胞在x轴方向上的投影图为
您最近一年使用:0次
9 . 总订单数已经超过1000架的国产大飞机C919预定在今年交付,其制造使用了较多含硼材料(如硼纤维、氮化硼等),多项技术打破了外国垄断。
(1)原子的能量由核电荷数、电子数、_______ 三个因素共同决定;基态B原子的核外电子填充在_______ 个轨道中。
(2)耐高温材料立方BN制备流程中用到NH3、BCl3和触媒剂Ca3B2N4。
①Ca、B、N三种元素电负性从大到小的顺序为_______ 。
②BCl3中B原子的_______ 轨道与Cl原子的_______ 轨道形成σ键;形成BCl3过程中基态B原子价电子层电子先激发,再杂化,激发后B原子的价电子排布图为_______ 。
③BCl3在四氯化碳中的溶解度远大于NH3,原因是_______ 。
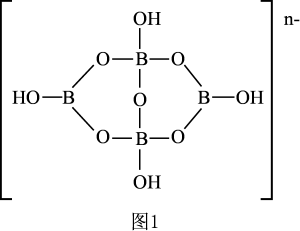
(3)硼砂是非常重要的含硼矿物。一种硼砂阴离子的结构如图1所示,则1mol该阴离子存在的配位键物质的量为_______ ,n=_______ 。
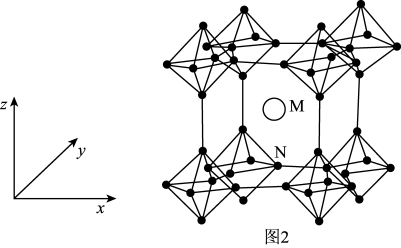
(4)制造硼合金的原料硼化钙(CaB6)晶胞结构如图2所示,硼原子全部组成B6正八面体,各个顶点通过B-B键互相连接成三维骨架。已知该晶体晶胞参数为apm,B6八面体中B-B键的键长为dpm,M点原子的坐标参数为( ,
, ,
, ),则N点原子的坐标参数为(___,1,0)。
),则N点原子的坐标参数为(___,1,0)。_______
(1)原子的能量由核电荷数、电子数、
(2)耐高温材料立方BN制备流程中用到NH3、BCl3和触媒剂Ca3B2N4。
①Ca、B、N三种元素电负性从大到小的顺序为
②BCl3中B原子的
③BCl3在四氯化碳中的溶解度远大于NH3,原因是
(3)硼砂是非常重要的含硼矿物。一种硼砂阴离子的结构如图1所示,则1mol该阴离子存在的配位键物质的量为

(4)制造硼合金的原料硼化钙(CaB6)晶胞结构如图2所示,硼原子全部组成B6正八面体,各个顶点通过B-B键互相连接成三维骨架。已知该晶体晶胞参数为apm,B6八面体中B-B键的键长为dpm,M点原子的坐标参数为(
 ,
, ,
, ),则N点原子的坐标参数为(___,1,0)。
),则N点原子的坐标参数为(___,1,0)。
您最近一年使用:0次
2022-05-03更新
|
466次组卷
|
5卷引用:山西省临汾市2022届高三下学期考前适应性训练考试(三)理科综合化学试题
山西省临汾市2022届高三下学期考前适应性训练考试(三)理科综合化学试题(已下线)专项17 物质结构与性质综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)(已下线)专题18物质结构与性质(选修)-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题17物质结构与性质(综合题)-2022年高考真题+模拟题汇编(全国卷)(已下线)专题18物质结构与性质(选修)-五年(2018~2022)高考真题汇编(全国卷)
解题方法
10 . 碳元素在自然界中分布很广,是存在形式最复杂的元素。实验室可用邻二氮菲( )与Fe2+形成的红色配合物(如下图)测定铁的含量。
)与Fe2+形成的红色配合物(如下图)测定铁的含量。
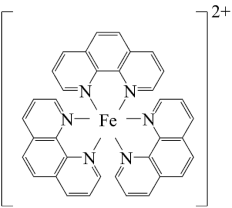
回答下列问题:
(1)基态Fe原子核外电子的空间运动状态有__________ 种。
(2)红色配合物中H、C、N、Fe四种元素的电负性从大到小的顺序为__________ 。
(3)邻二氮菲分子中C、N两种元素原子的杂化方式分别为__________ 、__________ 。
(4)红色配离子的中心原子的配位数为__________ 。
(5)红色配离子中不存在的作用力有__________ 。
A. σ键 B.π键 C.离子键 D.氢键 E.配位键
(6)临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+易被氧化成Fe3+的原因是__________ 。
(7)三甲胺[N(CH3)3]和乙二胺(H2N-CH2-CH2-NH2)均属于胺,但三甲胺比乙二胺的沸点低得多,原因是__________ 。
(8)汽车安全气囊产生气体的功臣是叠氮化钠(NaN3),N 的空间构型为
的空间构型为__________ 。
(9)钨和碳能形成耐高温、耐磨材料碳化钨,其晶体结构如下图所示,六棱柱的底边长为apm,高为bpm,设阿伏加德罗常数的值为NA,则碳化钨晶体的密度是__________ g·cm-3(列出计算表达式)。

 )与Fe2+形成的红色配合物(如下图)测定铁的含量。
)与Fe2+形成的红色配合物(如下图)测定铁的含量。
回答下列问题:
(1)基态Fe原子核外电子的空间运动状态有
(2)红色配合物中H、C、N、Fe四种元素的电负性从大到小的顺序为
(3)邻二氮菲分子中C、N两种元素原子的杂化方式分别为
(4)红色配离子的中心原子的配位数为
(5)红色配离子中不存在的作用力有
A. σ键 B.π键 C.离子键 D.氢键 E.配位键
(6)临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+易被氧化成Fe3+的原因是
(7)三甲胺[N(CH3)3]和乙二胺(H2N-CH2-CH2-NH2)均属于胺,但三甲胺比乙二胺的沸点低得多,原因是
(8)汽车安全气囊产生气体的功臣是叠氮化钠(NaN3),N
 的空间构型为
的空间构型为(9)钨和碳能形成耐高温、耐磨材料碳化钨,其晶体结构如下图所示,六棱柱的底边长为apm,高为bpm,设阿伏加德罗常数的值为NA,则碳化钨晶体的密度是

您最近一年使用:0次



