山西省临汾市2022届高三下学期考前适应性训练考试(三)理科综合化学试题
山西
高三
三模
2022-05-10
708次
整体难度:
适中
考查范围:
常见无机物及其应用、有机化学基础、认识化学科学、化学实验基础、化学反应原理、物质结构与性质
山西省临汾市2022届高三下学期考前适应性训练考试(三)理科综合化学试题
山西
高三
三模
2022-05-10
708次
整体难度:
适中
考查范围:
常见无机物及其应用、有机化学基础、认识化学科学、化学实验基础、化学反应原理、物质结构与性质
一、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
1. 下列生产活动与相应化学原理不相符的是
| 选项 | 生产活动 | 化学原理 |
| A | 过氧化钠用于呼吸面具的制造 | 过氧化钠与人呼出的H2O、CO2都能发生反应生成O2 |
| B | 葡萄酒生产时用SO2做食品添加剂 | 二氧化硫具有还原性,且有防腐作用 |
| C | 用氧化铁和铝粉组成的混合物焊接钢轨 | 氧化铁和铝粉剧烈反应放出大量的热,使产物单质铁呈熔融状态 |
| D | 用乙二醇合成涤纶 | 乙二醇与水分子间可形成氢键,可互溶 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-05-03更新
|
359次组卷
|
5卷引用:山西省临汾市2022届高三下学期考前适应性训练考试(三)理科综合化学试题
山西省临汾市2022届高三下学期考前适应性训练考试(三)理科综合化学试题(已下线)专题05元素及其化合物-2022年高考真题+模拟题汇编(全国卷)(已下线)专题05元素及其化合物-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题05元素及其化合物-五年(2018~2022)高考真题汇编(全国卷)广东省东莞实验中学2022-2023学年高三上学期第一次月考化学试题
单选题
|
适中(0.65)
2. 2021年诺贝尔生理学或医学奖颁发给发现温度和触觉感受器的两位科学家,其中温度感受器的发现与辣椒素有关。辣椒素的结构如图所示,下列有关辣椒素的说法错误的是
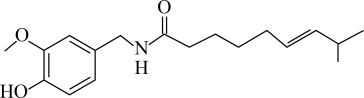

| A.分子中存在四种官能团 |
| B.分子中所有碳原子可能处于同一平面内 |
| C.属于芳香类化合物 |
| D.可发生取代反应、加成反应、氧化反应 |
您最近一年使用:0次
单选题
|
适中(0.65)
解题方法
3. 下列关于离子反应或离子共存表达正确的是
A.以下离子在0.1mol·L-1NaOH溶液中能大量共存:Na+、K+、 、 、 |
| B.以下离子在0.1mol·L-1K2CO3溶液中能大量共存:Na+、Ba2+、Cl-、OH- |
C.向氯化铝溶液中滴加过量氨水:4NH3·H2O+Al3+= +4 +4 +2H2O +2H2O |
| D.漂白粉漂白原理:Ca(ClO)2+2CO2+2H2O=Ca(HCO3)2+2HClO |
【知识点】 离子方程式的正误判断解读 限定条件下的离子共存解读 漂白粉和漂粉精
您最近一年使用:0次
2022-05-03更新
|
1435次组卷
|
6卷引用:山西省临汾市2022届高三下学期考前适应性训练考试(三)理科综合化学试题
山西省临汾市2022届高三下学期考前适应性训练考试(三)理科综合化学试题(已下线)专项04 离子反应-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)(已下线)专题03离子反应-2022年高考真题+模拟题汇编(全国卷)(已下线)专题03离子反应-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题03离子反应-五年(2018~2022)高考真题汇编(全国卷)(已下线)1.2.3 离子共存(好题帮)-备战2023年高考化学一轮复习考点帮(新教材新高考)?
单选题
|
较易(0.85)
名校
解题方法
4. 下列物质除杂的过程中,不能实现目的的是
| 原物(杂质) | 除杂试剂 | 除杂方法 | |
| A | CO2(H2S) | CuSO4溶液 | 洗气 |
| B | 碳粉(MnO2) | 浓盐酸 | 加热后过滤 |
| C | 乙酸(乙醇) | 饱和Na2CO3溶液 | 蒸馏 |
| D | 硝基苯(NO2) | NaOH溶液 | 分液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-03-08更新
|
807次组卷
|
6卷引用:安徽省江南十校2022届高三下学期3月一模联考理综化学试题
安徽省江南十校2022届高三下学期3月一模联考理综化学试题山西省临汾市2022届高三下学期考前适应性训练考试(三)理科综合化学试题(已下线)专题11化学实验基础-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题11化学实验基础-五年(2018~2022)高考真题汇编(全国卷)江西省赣州厚德外国语学校、丰城中学2022-2023学年高三上学期10月联考化学试题(已下线)二轮专题强化练 专题17 典型实验装置及化学实验基本操作
单选题
|
适中(0.65)
5. 酸性水系锌锰电池在放电时电极上的MnO2部分脱落,会造成电池效率“损失”。最新研究表明,向体系中加入少量KI固体能使电池持续大电流放电,提高电池的工作效率,原理如图所示。下列说法错误的是


| A.加入KI降低了正极反应的活化能 |
B.I-与剥落的MnO2反应生成的 能恢复“损失”的能量 能恢复“损失”的能量 |
| C.放电时,正极区溶液的pH减小 |
| D.放电时,若消耗1molZn,正极区电解质溶液理论上增重89g |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
6. 科学家研究发现某离子液体有助于盐湖水提取锂,其结构式如图。其中X、Y、Z、W、E、Q均为短周期主族非金属元素,且原子序数依次增大。
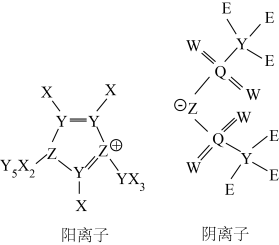
下列说法正确的是

下列说法正确的是
| A.最高价含氧酸的酸性:Z>Y>Q | B.简单氢化物的沸点:W>E>Z>Y |
| C.简单离子半径:Q>E>W>Z | D.Z、W组成的化合物共有三种 |
您最近一年使用:0次
2022-05-03更新
|
915次组卷
|
8卷引用:山西省临汾市2022届高三下学期考前适应性训练考试(三)理科综合化学试题
山西省临汾市2022届高三下学期考前适应性训练考试(三)理科综合化学试题(已下线)专项08 物质结构 元素周期律-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)(已下线)专题06物质结构元素周期律-五年(2018~2022)高考真题汇编(全国卷)(已下线)专题06物质结构元素周期律-2022年高考真题+模拟题汇编(全国卷)(已下线)专题06物质结构元素周期律-三年(2020~2022)高考真题汇编(全国卷)(已下线)微专题31 元素推断的破解-备战2023年高考化学一轮复习考点微专题江西省南昌市八一中学2022届高三下学期第三次模拟考试理科综合化学试题上海市黄浦区2023年高中学业等级考调研测试(4月)化学试题
单选题
|
适中(0.65)
7. 天然溶洞的形成与水体中含碳物种的浓度有密切关系。已知K(CaCO3)=10-8.7,某溶洞水体中lgc(X)(X为HCO 、CO
、CO 或Ca2+)与pH变化的关系如下图所示。下列说法错误的是
或Ca2+)与pH变化的关系如下图所示。下列说法错误的是
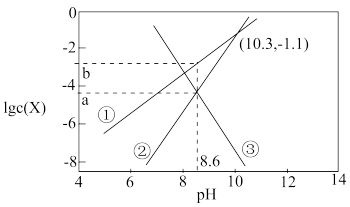
 、CO
、CO 或Ca2+)与pH变化的关系如下图所示。下列说法错误的是
或Ca2+)与pH变化的关系如下图所示。下列说法错误的是
A.曲线②代表CO | B.H2CO3的第二级电离常数为10-10.3 |
| C.a=-4.35,b=-2.75 | D.pH=10.3时,c(Ca2+)=10-7.6 mol·L-1 |
【知识点】 难溶电解质的溶解平衡 溶度积 弱电解质的电离平衡常数
您最近一年使用:0次
2022-03-22更新
|
1161次组卷
|
4卷引用:八省八校(T8联考湖北版)2021-2022学年高三下学期第二次联考化学试题
八省八校(T8联考湖北版)2021-2022学年高三下学期第二次联考化学试题 湖北省随州市曾都区第一中学2022届高三下学期第二次学业水平选择性模拟考试化学试题山西省临汾市2022届高三下学期考前适应性训练考试(三)理科综合化学试题(已下线)三轮冲刺卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(湖北专用)
二、解答题 添加题型下试题
解答题-工业流程题
|
适中(0.65)
8. 铈可用作生产催化剂、电弧电极、特种玻璃等。现以氟碳铈矿(CeFCO3,含Fe2O3、FeO等杂质)为原料制备铈,其工艺流程如图所示。
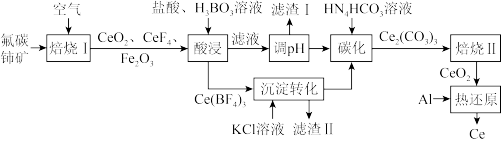
请回答下列问题:
(1)“焙烧I”时,空气与矿料逆流而行的目的是_______ ;CeFCO3发生反应的化学方程式为_______ 。
(2)“酸浸”反应体现了盐酸的_______ 性质,“滤渣I”、“滤渣II”的主要成分分别为_______ 、_______ (填化学式)。
(3)“调pH”时c(Ce3+)=0.10mol·L-1,为了除去杂质同时避免Ce元素损失,25℃下溶液pH范围应调节为3.0~7.0,则Ksp[Ce(OH)3]=_______ (不考虑溶液体积变化)。
(4)“碳化”时,不能用(NH4)2CO3溶液代替NH4HCO3溶液的原因是_______ 。
(5)“热还原”反应的化学方程式为_______ 。

请回答下列问题:
(1)“焙烧I”时,空气与矿料逆流而行的目的是
(2)“酸浸”反应体现了盐酸的
(3)“调pH”时c(Ce3+)=0.10mol·L-1,为了除去杂质同时避免Ce元素损失,25℃下溶液pH范围应调节为3.0~7.0,则Ksp[Ce(OH)3]=
(4)“碳化”时,不能用(NH4)2CO3溶液代替NH4HCO3溶液的原因是
(5)“热还原”反应的化学方程式为
【知识点】 氧化还原反应方程式的配平解读 盐类水解的应用 溶度积常数相关计算解读
您最近一年使用:0次
解答题-实验探究题
|
适中(0.65)
名校
9. 草酸(H2C2O4)及其盐类化合物在化学工业中有重要作用。请回答下列问题:
(1)实验室中可以在50℃左右,用浓硝酸在硝酸汞催化下氧化乙炔(C2H2)气体来制备草酸。其主要装置如下图。
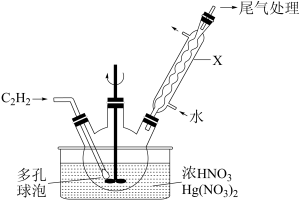
C2H2的电子式为____ ;仪器X的名称为____ ;装置中浓硝酸的还原产物为NO2,生成草酸的化学方程式为____ ,若反应温度高于50℃,生成草酸的速率会减慢,主要原因是____ 。
(2)三草酸合铁酸钾{K3[Fe(C2O4)3]·3H2O}为绿色晶体,溶于水,难溶于乙醇,可作有机反应的催化剂。某实验小组用(NH4)2Fe(SO4)2·6H2O为原料制备三草酸合铁酸钾的步骤如下:
①称取5g(NH4)2Fe(SO4)2·6H2O固体,溶解,加硫酸酸化,搅拌下加入25mL1mol·L-1H2C2O4溶液,静置,析出黄色的FeC2O4·2H2O沉淀,过滤并洗涤沉淀2~3次。
②将上述FeC2O4·2H2O沉淀溶解在10mL饱和草酸钾溶液中,再加入20mL饱和H2C2O4溶液,保持溶液温度40℃左右,缓慢滴加3%H2O2溶液,不断搅拌,沉淀慢慢变为深棕色;加热至沸腾30min,再加入8~9mL草酸溶液,控制pH在3~4,变为绿色透明的三草酸合铁酸钾溶液。
③加热浓缩,缓慢加入95%的乙醇,冷却结晶、过滤,洗涤晶体2~3次,干燥、称量。
其中,生成FeC2O4·2H2O的化学方程式为____ ;保持溶液温度40℃所采用的加热方法是____ ,加热至沸腾30min的目的是____ ;洗涤晶体所用试剂为____ 。
(3)制得的三草酸合铁酸钾晶体中往往会混有少量草酸。为测定K3[Fe(C2O4)3]·3H2O(M=491g/mol)的纯度,进行如下实验:
称取样品10.72g,加稀硫酸溶解后配成100mL溶液。取20.00mL配制的溶液,用浓度为0.2000mol·L-1的KMnO4溶液滴定至终点时消耗KMnO4溶液28.00mL。已知:5H2C2O4+2 +6H+=2Mn2++10CO2↑+8H2O,样品中K3[Fe(C2O4)3]·3H2O的质量分数为
+6H+=2Mn2++10CO2↑+8H2O,样品中K3[Fe(C2O4)3]·3H2O的质量分数为_______ (保留两位小数)。
(1)实验室中可以在50℃左右,用浓硝酸在硝酸汞催化下氧化乙炔(C2H2)气体来制备草酸。其主要装置如下图。

C2H2的电子式为
(2)三草酸合铁酸钾{K3[Fe(C2O4)3]·3H2O}为绿色晶体,溶于水,难溶于乙醇,可作有机反应的催化剂。某实验小组用(NH4)2Fe(SO4)2·6H2O为原料制备三草酸合铁酸钾的步骤如下:
①称取5g(NH4)2Fe(SO4)2·6H2O固体,溶解,加硫酸酸化,搅拌下加入25mL1mol·L-1H2C2O4溶液,静置,析出黄色的FeC2O4·2H2O沉淀,过滤并洗涤沉淀2~3次。
②将上述FeC2O4·2H2O沉淀溶解在10mL饱和草酸钾溶液中,再加入20mL饱和H2C2O4溶液,保持溶液温度40℃左右,缓慢滴加3%H2O2溶液,不断搅拌,沉淀慢慢变为深棕色;加热至沸腾30min,再加入8~9mL草酸溶液,控制pH在3~4,变为绿色透明的三草酸合铁酸钾溶液。
③加热浓缩,缓慢加入95%的乙醇,冷却结晶、过滤,洗涤晶体2~3次,干燥、称量。
其中,生成FeC2O4·2H2O的化学方程式为
(3)制得的三草酸合铁酸钾晶体中往往会混有少量草酸。为测定K3[Fe(C2O4)3]·3H2O(M=491g/mol)的纯度,进行如下实验:
称取样品10.72g,加稀硫酸溶解后配成100mL溶液。取20.00mL配制的溶液,用浓度为0.2000mol·L-1的KMnO4溶液滴定至终点时消耗KMnO4溶液28.00mL。已知:5H2C2O4+2
 +6H+=2Mn2++10CO2↑+8H2O,样品中K3[Fe(C2O4)3]·3H2O的质量分数为
+6H+=2Mn2++10CO2↑+8H2O,样品中K3[Fe(C2O4)3]·3H2O的质量分数为【知识点】 共价型分子结构式、电子式解读 常见无机物的制备解读 物质含量的测定
您最近一年使用:0次
2022-05-03更新
|
1080次组卷
|
2卷引用:山西省临汾市2022届高三下学期考前适应性训练考试(三)理科综合化学试题
解答题-原理综合题
|
较难(0.4)
10. 研究NOx、SO2和CO等气体的相关反应对治理大气污染、建设生态文明具有重要意义。请回答下列问题:
(1)已知:①NO2(g)+CO(g)⇌CO2(g)+NO(g)△H1=-233kJ·mol-1
②N2(g)+O2(g)⇌NO(g)△H2=+179kJ·mol-1
③2NO(g)+O2(g)⇌2NO2(g)△H3=-111.9kJ·mol-1
则2NO2(g)+4CO(g)⇌4CO2(g)+N2(g)△H=_______ 。
(2)研究发现(1)中反应③分两步进行:
第一步:快反应2NO(g)⇌N2O2(g)△H<0
第二步:慢反应N2O2(g)+O2(g)⇌2NO2(g)△H<0
活化能大小比较:Ea(第一步)_______ Ea(第二步)(填“大于”、“等于”或“小于”)。
(3)在混有NO2(g)和N2O4(g)的VL密闭容器中发生反应2NO2(g)⇌N2O4(g)△H<0,随着温度升高,体系中各物质平衡时的物质的量分数的变化关系如图1所示。曲线_____ (填“a”或“b”)表示NO2的物质的量分数x%与温度的变化关系。若T1℃时,混合气体的物质的量为zmol,升温至T2℃,反应tmin达到平衡,该过程以N2O4表示的平均化学反应速率为v0mol·L-1·min-1,则T2℃时平衡体系中n(N2O4)=____ mol(用含z、v0、t的式子表示),此时物质的量分数平衡常数Kx=____ (用物质的量分数代替平衡浓度)。

(4)V2O5/炭基材料(活性炭、活性焦、活炭纤维)也可以脱硫脱硝。V2O5/炭基材料脱硫原理是:SO2在炭表面被吸附,吸附态SO2在炭表面被催化氧化为SO3,SO3再转化为硫酸盐等。
①V2O5/炭基材料脱硫时,通过红外光谱发现脱硫开始后催化剂表面出现了VOSO4的吸收峰,再通入O2后VOSO4吸收峰消失,该脱硫反应过程可表示为:SO2+V2O5+O2=VOSO4(配平方程式)_____ 、____ (用化学方程式表示)。
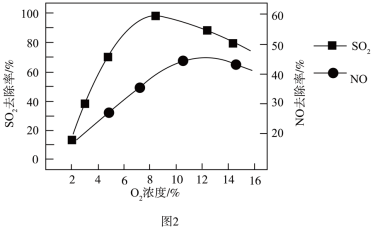
②气体流速和温度一定时,烟气中O2浓度对V2O5/炭基材料催化剂脱硫脱硝活性的影响如图2所示。当O2浓度过高时,去除率下降的可能原因是_______ 。
(1)已知:①NO2(g)+CO(g)⇌CO2(g)+NO(g)△H1=-233kJ·mol-1
②N2(g)+O2(g)⇌NO(g)△H2=+179kJ·mol-1
③2NO(g)+O2(g)⇌2NO2(g)△H3=-111.9kJ·mol-1
则2NO2(g)+4CO(g)⇌4CO2(g)+N2(g)△H=
(2)研究发现(1)中反应③分两步进行:
第一步:快反应2NO(g)⇌N2O2(g)△H<0
第二步:慢反应N2O2(g)+O2(g)⇌2NO2(g)△H<0
活化能大小比较:Ea(第一步)
(3)在混有NO2(g)和N2O4(g)的VL密闭容器中发生反应2NO2(g)⇌N2O4(g)△H<0,随着温度升高,体系中各物质平衡时的物质的量分数的变化关系如图1所示。曲线

(4)V2O5/炭基材料(活性炭、活性焦、活炭纤维)也可以脱硫脱硝。V2O5/炭基材料脱硫原理是:SO2在炭表面被吸附,吸附态SO2在炭表面被催化氧化为SO3,SO3再转化为硫酸盐等。
①V2O5/炭基材料脱硫时,通过红外光谱发现脱硫开始后催化剂表面出现了VOSO4的吸收峰,再通入O2后VOSO4吸收峰消失,该脱硫反应过程可表示为:SO2+V2O5+O2=VOSO4(配平方程式)
②气体流速和温度一定时,烟气中O2浓度对V2O5/炭基材料催化剂脱硫脱硝活性的影响如图2所示。当O2浓度过高时,去除率下降的可能原因是

您最近一年使用:0次
解答题-结构与性质
|
适中(0.65)
11. 总订单数已经超过1000架的国产大飞机C919预定在今年交付,其制造使用了较多含硼材料(如硼纤维、氮化硼等),多项技术打破了外国垄断。
(1)原子的能量由核电荷数、电子数、_______ 三个因素共同决定;基态B原子的核外电子填充在_______ 个轨道中。
(2)耐高温材料立方BN制备流程中用到NH3、BCl3和触媒剂Ca3B2N4。
①Ca、B、N三种元素电负性从大到小的顺序为_______ 。
②BCl3中B原子的_______ 轨道与Cl原子的_______ 轨道形成σ键;形成BCl3过程中基态B原子价电子层电子先激发,再杂化,激发后B原子的价电子排布图为_______ 。
③BCl3在四氯化碳中的溶解度远大于NH3,原因是_______ 。
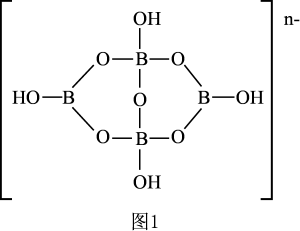
(3)硼砂是非常重要的含硼矿物。一种硼砂阴离子的结构如图1所示,则1mol该阴离子存在的配位键物质的量为_______ ,n=_______ 。
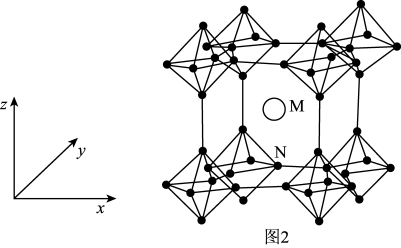
(4)制造硼合金的原料硼化钙(CaB6)晶胞结构如图2所示,硼原子全部组成B6正八面体,各个顶点通过B-B键互相连接成三维骨架。已知该晶体晶胞参数为apm,B6八面体中B-B键的键长为dpm,M点原子的坐标参数为( ,
, ,
, ),则N点原子的坐标参数为(___,1,0)。
),则N点原子的坐标参数为(___,1,0)。_______
(1)原子的能量由核电荷数、电子数、
(2)耐高温材料立方BN制备流程中用到NH3、BCl3和触媒剂Ca3B2N4。
①Ca、B、N三种元素电负性从大到小的顺序为
②BCl3中B原子的
③BCl3在四氯化碳中的溶解度远大于NH3,原因是
(3)硼砂是非常重要的含硼矿物。一种硼砂阴离子的结构如图1所示,则1mol该阴离子存在的配位键物质的量为

(4)制造硼合金的原料硼化钙(CaB6)晶胞结构如图2所示,硼原子全部组成B6正八面体,各个顶点通过B-B键互相连接成三维骨架。已知该晶体晶胞参数为apm,B6八面体中B-B键的键长为dpm,M点原子的坐标参数为(
 ,
, ,
, ),则N点原子的坐标参数为(___,1,0)。
),则N点原子的坐标参数为(___,1,0)。
您最近一年使用:0次
2022-05-03更新
|
466次组卷
|
5卷引用:山西省临汾市2022届高三下学期考前适应性训练考试(三)理科综合化学试题
山西省临汾市2022届高三下学期考前适应性训练考试(三)理科综合化学试题(已下线)专项17 物质结构与性质综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)(已下线)专题18物质结构与性质(选修)-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题17物质结构与性质(综合题)-2022年高考真题+模拟题汇编(全国卷)(已下线)专题18物质结构与性质(选修)-五年(2018~2022)高考真题汇编(全国卷)
解答题-有机推断题
|
适中(0.65)
名校
12. 普瑞巴林(pregabalin)常用于治疗糖尿病和带状疱疹引起的神经痛,其合成路线如下:

已知:i.R1CHO+R2-CH2COOR
 +H2O
+H2O
ii.RCOOH+CO(NH2)2 RCONH2+NH3↑+CO2↑
RCONH2+NH3↑+CO2↑
回答下列问题:
(1)A的化学名称为_______ ,-NH2的电子式为_______ 。
(2)B的结构简式为_______ 。
(3)反应②的反应类型是_______ 。
(4)D中有_______ 个手性碳原子。
(5)写出反应④的化学方程式_______ 。
(6)H是G的同系物,其碳原子数比G少四个,则H可能的结构(不考虑立体异构)有_______ 种,其中-NH2在链端的有_______ (写结构简式)。
(7)写出以1,6-己二酸为原料制备聚戊内酰胺( )的合成路线
)的合成路线_______ (其他无机试剂和有机溶剂任选)。

已知:i.R1CHO+R2-CH2COOR

 +H2O
+H2Oii.RCOOH+CO(NH2)2
 RCONH2+NH3↑+CO2↑
RCONH2+NH3↑+CO2↑回答下列问题:
(1)A的化学名称为
(2)B的结构简式为
(3)反应②的反应类型是
(4)D中有
(5)写出反应④的化学方程式
(6)H是G的同系物,其碳原子数比G少四个,则H可能的结构(不考虑立体异构)有
(7)写出以1,6-己二酸为原料制备聚戊内酰胺(
 )的合成路线
)的合成路线
您最近一年使用:0次
2022-05-03更新
|
1446次组卷
|
6卷引用:山西省临汾市2022届高三下学期考前适应性训练考试(三)理科综合化学试题
山西省临汾市2022届高三下学期考前适应性训练考试(三)理科综合化学试题(已下线)专项18 有机化学基础综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)(已下线)专题18有机化学基础(综合题)-2022年高考真题+模拟题汇编(全国卷)(已下线)专题19有机化学基础(选修)-五年(2018~2022)高考真题汇编(全国卷)江西省南昌市八一中学2022届高三下学期第三次模拟考试理科综合化学试题2024届四川省宜宾市第四中学校高三上学期一诊模拟考试理综试题
试卷分析
整体难度:适中
考查范围:常见无机物及其应用、有机化学基础、认识化学科学、化学实验基础、化学反应原理、物质结构与性质
试卷题型(共 12题)
题型
数量
单选题
7
解答题
5
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 二氧化硫与其他强氧化剂的反应 过氧化钠 铝热反应 生活中常见的几种醇 | |
| 2 | 0.65 | 有机官能团的性质及结构 有机分子中原子共面的判断 多官能团有机物的结构与性质 | |
| 3 | 0.65 | 离子方程式的正误判断 限定条件下的离子共存 漂白粉和漂粉精 | |
| 4 | 0.85 | 物质分离、提纯的常见化学方法 物质分离、提纯综合应用 | |
| 5 | 0.65 | 原电池原理理解 原电池正负极判断 原电池电极反应式书写 原电池原理的综合应用 | |
| 6 | 0.65 | 元素金属性与非金属性递变规律的理解及应用 微粒半径大小的比较方法 根据原子结构进行元素种类推断 | |
| 7 | 0.65 | 难溶电解质的溶解平衡 溶度积 弱电解质的电离平衡常数 | |
| 二、解答题 | |||
| 8 | 0.65 | 氧化还原反应方程式的配平 盐类水解的应用 溶度积常数相关计算 | 工业流程题 |
| 9 | 0.65 | 共价型分子结构式、电子式 常见无机物的制备 物质含量的测定 | 实验探究题 |
| 10 | 0.4 | 盖斯定律与热化学方程式 化学平衡的移动及其影响因素 温度对化学平衡移动的影响 化学平衡常数的有关计算 | 原理综合题 |
| 11 | 0.65 | 电子排布式 元素性质与电负性的关系 简单配合物的成键 晶胞的有关计算 | 结构与性质 |
| 12 | 0.65 | 分子的手性 加成反应 有机合成综合考查 多官能团有机物的结构与性质 | 有机推断题 |



