名校
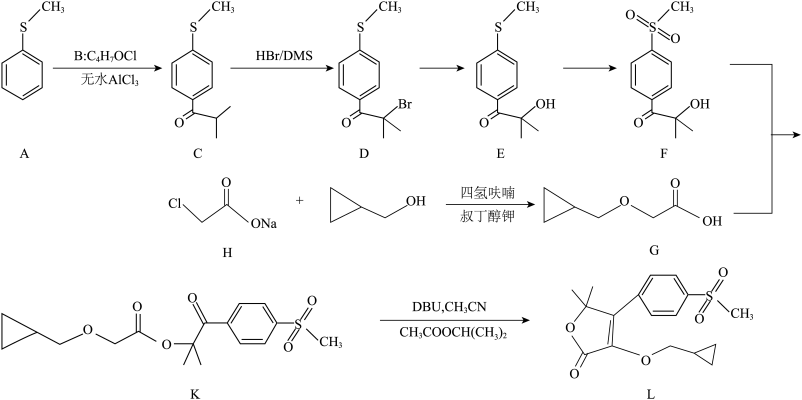
1 . 非罗考昔(化合物L)是一种非甾体抗炎药,其中一种合成路线如下(部分皮应条件略去):______ ,化合物L中所有元素电负性由大到小顺序为_______ 。
(2)已知羧基中羟基被氯取代称之为酰氯,则化合物B的名称为_______ 。
(3)从化合物A生成L的全过程中,下列说法正确的有_______ 。
A.有碳氧双键和碳氢单键断裂,也有碳碳双键和碳氧单键形成
B.反应物K中,碳原子采取的杂化方式有: 、
、 ,并且存在手性碳原子
,并且存在手性碳原子
C.化合物G中碳氧原子间的σ键与π键的个数之比为
(4)基于上述反应原理,利用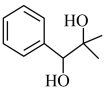 、
、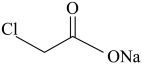 、
、 合成
合成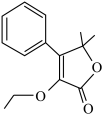
_______ 。
c.最后一步反应中,有机反应物为_______ (写结构简式)。
(2)已知羧基中羟基被氯取代称之为酰氯,则化合物B的名称为
(3)从化合物A生成L的全过程中,下列说法正确的有
A.有碳氧双键和碳氢单键断裂,也有碳碳双键和碳氧单键形成
B.反应物K中,碳原子采取的杂化方式有:
 、
、 ,并且存在手性碳原子
,并且存在手性碳原子C.化合物G中碳氧原子间的σ键与π键的个数之比为

(4)基于上述反应原理,利用
 、
、 、
、 合成
合成
a.从 出发,第一步的化学方程式为
出发,第一步的化学方程式为
c.最后一步反应中,有机反应物为
您最近一年使用:0次
解题方法
2 . 恩格列净是治疗2型糖尿病的一种原料药,其关键中间体(F)的合成路线如下:
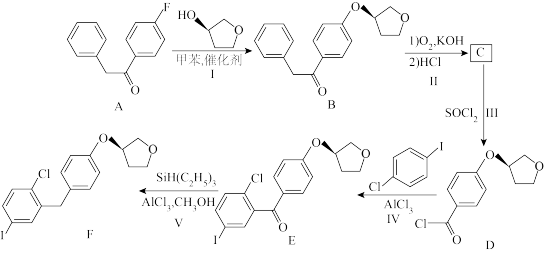
已知: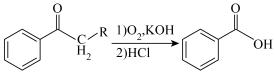 +RCOOH
+RCOOH
回答下列问题:
(1)B分子含有的官能团名称为
(2)反应Ⅰ在
(3)反应Ⅱ生成两种有机物,一种为C,另一种产物的结构简式为
(4)
 易水解:
易水解: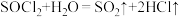 。反应Ⅲ的化学方程式为
。反应Ⅲ的化学方程式为(5)V的反应类型为
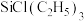 ,若反应中Si的化合价不变,则
,若反应中Si的化合价不变,则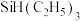 中三种元素按电负性由大到小排列为
中三种元素按电负性由大到小排列为(6)芳香族化合物G是C的同分异构体,请写出符合下列条件的G的结构简式
①能与 溶液反应产生气体
溶液反应产生气体
②核磁共振氢谱有四组峰且峰面积比为6∶3∶2∶1。
您最近一年使用:0次
名校
3 . 三氯甲硅烷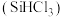 是制取高纯硅的重要原料,常温下为无色液体,沸点为
是制取高纯硅的重要原料,常温下为无色液体,沸点为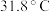 ,熔点为
,熔点为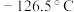 ,易水解。实验室根据反应
,易水解。实验室根据反应 ,利用如下装置制备
,利用如下装置制备 粗品(加热及夹持装置略)。回答下列问题:
粗品(加热及夹持装置略)。回答下列问题:
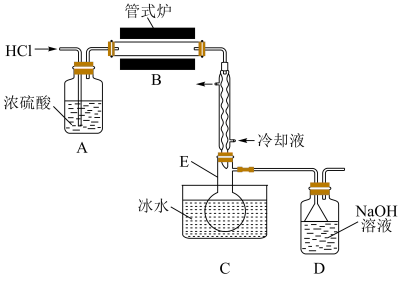
(1)制备 时进行操作:(i)……;(ii)将盛有硅粉的瓷舟置于管式炉中;(iii)通入
时进行操作:(i)……;(ii)将盛有硅粉的瓷舟置于管式炉中;(iii)通入 、一段时间后接通冷凝装置,加热开始反应。操作(i)为
、一段时间后接通冷凝装置,加热开始反应。操作(i)为___________ ;判断制备反应结束的实验现象是___________ 。图示装置存在的两处缺陷是___________ ,装置 的名称为
的名称为___________ 。
(2)已知电负性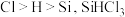 在浓
在浓 溶液中发生反应的化学方程式为
溶液中发生反应的化学方程式为___________ 。
(3)采用如下方法测定溶有少量 的
的 纯度。
纯度。
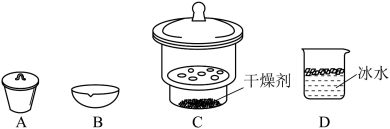
 样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:①
样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:①___________ ,②___________ (填操作名称),③称量等操作,测得所得固体氧化物质量为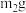 ,从下列仪器中选出①、②中需使用的仪器,依次为
,从下列仪器中选出①、②中需使用的仪器,依次为___________ (填标号)。测得样品纯度为___________ (用含 的代数式表示)。
的代数式表示)。
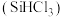 是制取高纯硅的重要原料,常温下为无色液体,沸点为
是制取高纯硅的重要原料,常温下为无色液体,沸点为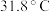 ,熔点为
,熔点为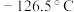 ,易水解。实验室根据反应
,易水解。实验室根据反应 ,利用如下装置制备
,利用如下装置制备 粗品(加热及夹持装置略)。回答下列问题:
粗品(加热及夹持装置略)。回答下列问题:
(1)制备
 时进行操作:(i)……;(ii)将盛有硅粉的瓷舟置于管式炉中;(iii)通入
时进行操作:(i)……;(ii)将盛有硅粉的瓷舟置于管式炉中;(iii)通入 、一段时间后接通冷凝装置,加热开始反应。操作(i)为
、一段时间后接通冷凝装置,加热开始反应。操作(i)为 的名称为
的名称为(2)已知电负性
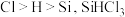 在浓
在浓 溶液中发生反应的化学方程式为
溶液中发生反应的化学方程式为(3)采用如下方法测定溶有少量
 的
的 纯度。
纯度。 样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:①
样品经水解、干燥等预处理过程得硅酸水合物后,进行如下实验操作:①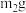 ,从下列仪器中选出①、②中需使用的仪器,依次为
,从下列仪器中选出①、②中需使用的仪器,依次为 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
名校
解题方法
4 . 硫酸铈铵[(NH4)4Ce(SO4)4]是分析化学常用的滴定剂.以氟碳铈矿(含CeFCO3、BaF2、SiO2等)为原料制备硫酸铈铵的工艺流程如图所示。
已知部分信息如下:
①Ce3+在空气中易被氧化为Ce4+;
②“沉铈”时发生的反应之一:Ce2(SO4)3+Na2SO4+6H2O=Ce2(SO4)3•Na2SO4•6H2O↓。
回答下列问题:
(1)CeFCO3中电负性最大的是_______ (填元素符号)。
(2)“焙烧”中常采用高压空气、逆流操作(空气从焙烧炉下部通入,矿粉从中上部加入),这样操作的目的是_________ 。
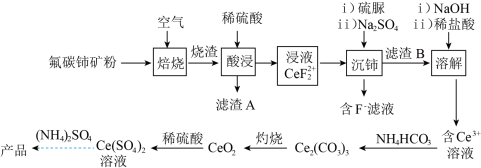
(3)“酸浸”中.铈浸出率与温度的关系如图1所示,铈浸出率与硫酸浓度的关系如图2所示。工业生产应选择的适宜条件是________ 。
(4)“沉铈”时,硫脲作_______ (填“还原剂”或“氧化剂”)。
(5)“溶解”时,为防止Ce3+被氧化。可以加入________ (填标号)。
a.KMnO4 b.NaClO C.CH3CHO
(6)请写出含Ce3+溶液与NH4HCO3反应的离子方程式_______ ,“灼烧”过程中涉及到的化学方程式为_______ 。
(7)在有机合成中,硫酸铈铵常作合成丙酸异戈酯的催化剂、其他条件相同,酯产率与催化剂质量的关系如图3所示。
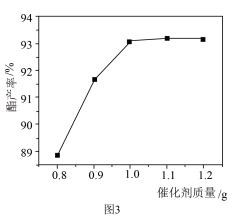
工业生产中.选择的最佳催化剂质量为_________ 。
(8)测定产品纯度。称取wg产品溶于水。配制成250mL溶液,准确量取25.00mL配制的溶液于锥形瓶中。加入VmL0.10mol•L-1Na2Fe(SO4)2溶液,恰好完全反应。该产品纯度为________ %。(杂质不参与反应.滴定反应为Fe2++Ce4+=Ce3++Fe3+)

已知部分信息如下:
①Ce3+在空气中易被氧化为Ce4+;
②“沉铈”时发生的反应之一:Ce2(SO4)3+Na2SO4+6H2O=Ce2(SO4)3•Na2SO4•6H2O↓。
回答下列问题:
(1)CeFCO3中电负性最大的是
(2)“焙烧”中常采用高压空气、逆流操作(空气从焙烧炉下部通入,矿粉从中上部加入),这样操作的目的是
(3)“酸浸”中.铈浸出率与温度的关系如图1所示,铈浸出率与硫酸浓度的关系如图2所示。工业生产应选择的适宜条件是

(4)“沉铈”时,硫脲作
(5)“溶解”时,为防止Ce3+被氧化。可以加入
a.KMnO4 b.NaClO C.CH3CHO
(6)请写出含Ce3+溶液与NH4HCO3反应的离子方程式
(7)在有机合成中,硫酸铈铵常作合成丙酸异戈酯的催化剂、其他条件相同,酯产率与催化剂质量的关系如图3所示。

工业生产中.选择的最佳催化剂质量为
(8)测定产品纯度。称取wg产品溶于水。配制成250mL溶液,准确量取25.00mL配制的溶液于锥形瓶中。加入VmL0.10mol•L-1Na2Fe(SO4)2溶液,恰好完全反应。该产品纯度为
您最近一年使用:0次
名校
5 . 三氯化铬(CrCl3)为紫色单斜晶体,熔点为83℃,易潮解,易升华,能溶于水但不易水解,高温下能被氧气氧化,工业上主要用作媒染剂和催化剂。
(1)某化学小组用Cr2O3和CCl4在高温下制备无水三氯化铬,部分实验装置如图所示,其中锥形瓶内装有CCl4,其沸点为76.8℃。
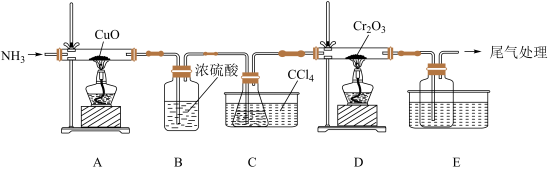
实验前先加热装置A,产生气体的化学方程式:___________ ,实验过程中需持续产生该气体,该气体的作用为___________ 。
(2)三价铬离子能形成多种配位化合物,配合物[Cr(NH3)3(H2O)2Cl]2+中元素电负性由大到小的顺序___________ 。
(3)装置D中还会生成光气(COCl2),D中反应的化学方程式为___________ 。
(4)该实验装置有设计不合理的地方,请写出改进方法:___________ (写一点即可)
(5)为进一步探究CrCl3的性质,某同学取试管若干支,分别加入10滴0.1 mol∙L−1 CrCl3溶液,并用4滴2 mol∙L−1 H2SO4酸化,再分别加入不同滴数的0.1 mol∙L−1KMnO4溶液,并在不同的温度下进行实验,反应现象记录于表中。
①浓度对反应的影响
CrCl3与KMnO4在常温下反应,观察不到Cr2O 离子的橙色,甲同学认为其中一个原因是Cr2O
离子的橙色,甲同学认为其中一个原因是Cr2O 离子的橙色被MnO
离子的橙色被MnO 离子的紫红色掩盖,另一种可能的原因是
离子的紫红色掩盖,另一种可能的原因是___________ ,所以必须将反应液加热至沸腾 后,才能观察到反应液由紫红色逐渐变为橙黄色的实验现象。
后,才能观察到反应液由紫红色逐渐变为橙黄色的实验现象。
②CrCl3与KMnO4的用量对反应的影响
对表中数据进行分析,在上述反应条件下,欲将Cr3+氧化为Cr2O ,CrCl3与KMnO4最佳用量比为
,CrCl3与KMnO4最佳用量比为___________ 。这与由反应10Cr3+ + 6MnO + 11H2O
+ 11H2O Cr2O
Cr2O + 6Mn2+ + 22H+ 所推断得到的用量比不符,你推测的原因是
+ 6Mn2+ + 22H+ 所推断得到的用量比不符,你推测的原因是___________ 。
(1)某化学小组用Cr2O3和CCl4在高温下制备无水三氯化铬,部分实验装置如图所示,其中锥形瓶内装有CCl4,其沸点为76.8℃。

实验前先加热装置A,产生气体的化学方程式:
(2)三价铬离子能形成多种配位化合物,配合物[Cr(NH3)3(H2O)2Cl]2+中元素电负性由大到小的顺序
(3)装置D中还会生成光气(COCl2),D中反应的化学方程式为
(4)该实验装置有设计不合理的地方,请写出改进方法:
(5)为进一步探究CrCl3的性质,某同学取试管若干支,分别加入10滴0.1 mol∙L−1 CrCl3溶液,并用4滴2 mol∙L−1 H2SO4酸化,再分别加入不同滴数的0.1 mol∙L−1KMnO4溶液,并在不同的温度下进行实验,反应现象记录于表中。
| KMnO4的用量 (滴数) | 在不同温度下的反应现象 | |
| 25℃ | 90~100℃ | |
| 1 | 紫红色 | 蓝绿色溶液 |
| 2~9 | 紫红色 | 黄绿色溶液,且随KMnO4滴数增加,黄色成分增多 |
| 10 | 紫红色 | 澄清的橙黄色溶液 |
| 11~23 | 紫红色 | 橙黄色溶液,有棕褐色沉淀,且随KMnO4滴数增加,沉淀增多 |
| 24~25 | 紫红色 | 紫红色溶液,有较多的棕褐色沉淀 |
CrCl3与KMnO4在常温下反应,观察不到Cr2O
 离子的橙色,甲同学认为其中一个原因是Cr2O
离子的橙色,甲同学认为其中一个原因是Cr2O 离子的橙色被MnO
离子的橙色被MnO 离子的紫红色掩盖,另一种可能的原因是
离子的紫红色掩盖,另一种可能的原因是 后,才能观察到反应液由紫红色逐渐变为橙黄色的实验现象。
后,才能观察到反应液由紫红色逐渐变为橙黄色的实验现象。②CrCl3与KMnO4的用量对反应的影响
对表中数据进行分析,在上述反应条件下,欲将Cr3+氧化为Cr2O
 ,CrCl3与KMnO4最佳用量比为
,CrCl3与KMnO4最佳用量比为 + 11H2O
+ 11H2O Cr2O
Cr2O + 6Mn2+ + 22H+ 所推断得到的用量比不符,你推测的原因是
+ 6Mn2+ + 22H+ 所推断得到的用量比不符,你推测的原因是
您最近一年使用:0次
解题方法
6 . 钛及其化合物在生产、生活中有着广泛的用途。回答下列问题:
(1)Ti(BH4)3是一种储氢材料。BH 中B原子的杂化轨道类型为
中B原子的杂化轨道类型为___ ;Ti、B、H元素的电负性由大到小排列顺序为_____ 。
(2)已知Ti3+易形成多种配合物,[TiCl(H2O)5]Cl2·H2O是其中的一种。
①1mol该配合物中含有_______ molσ键。
②Ti3+具有较强还原性的原因是___________ 。
(3)研究表明,TiO2通过氮掺杂反应可生成TiO2-xNy,能使TiO2对可见光具有活性,反应如图所示。
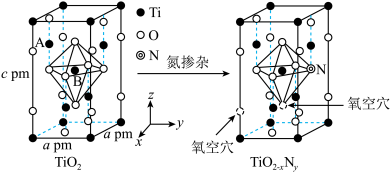
①上图TiO2晶胞中钛原子占据___________ 个氧原子围成的八面体空隙。
②已知所有的Ti-O键键长为rpm,B点原子的分数坐标为( ,
, ,
, ),则A点原子的分数坐标为(
),则A点原子的分数坐标为( ,0,
,0,___________ )。
③TiO2-xNy晶体中x=___________ 。
(1)Ti(BH4)3是一种储氢材料。BH
 中B原子的杂化轨道类型为
中B原子的杂化轨道类型为(2)已知Ti3+易形成多种配合物,[TiCl(H2O)5]Cl2·H2O是其中的一种。
①1mol该配合物中含有
②Ti3+具有较强还原性的原因是
(3)研究表明,TiO2通过氮掺杂反应可生成TiO2-xNy,能使TiO2对可见光具有活性,反应如图所示。

①上图TiO2晶胞中钛原子占据
②已知所有的Ti-O键键长为rpm,B点原子的分数坐标为(
 ,
, ,
, ),则A点原子的分数坐标为(
),则A点原子的分数坐标为( ,0,
,0,③TiO2-xNy晶体中x=
您最近一年使用:0次
名校
解题方法
7 . 化学物质在材料领域有着广泛用途:黄血盐 常用作颜料、染料,
常用作颜料、染料, 属于超导材料。
属于超导材料。
(1)上述涉及的元素中属于d区元素的有_______ 。电负性最大的元素的价层电子轨道表示式为_______ 。
(2)金属的熔点:K小于Fe,理由是_______ 。
(3)可溶性氰化物(如KCN)有剧毒,但黄血盐 的毒性极低,请从结构角度解释黄血盐毒性极低的原因是
的毒性极低,请从结构角度解释黄血盐毒性极低的原因是_______ 。
(4) 晶体的晶胞结构如图所示。与S原子距离最近且等距离的Ni原子数目为
晶体的晶胞结构如图所示。与S原子距离最近且等距离的Ni原子数目为_______ ,一个晶胞的质量为_______ g。

 常用作颜料、染料,
常用作颜料、染料, 属于超导材料。
属于超导材料。(1)上述涉及的元素中属于d区元素的有
(2)金属的熔点:K小于Fe,理由是
(3)可溶性氰化物(如KCN)有剧毒,但黄血盐
 的毒性极低,请从结构角度解释黄血盐毒性极低的原因是
的毒性极低,请从结构角度解释黄血盐毒性极低的原因是(4)
 晶体的晶胞结构如图所示。与S原子距离最近且等距离的Ni原子数目为
晶体的晶胞结构如图所示。与S原子距离最近且等距离的Ni原子数目为
您最近一年使用:0次
名校
解题方法
8 . 钴及其化合物被广泛应用于光电材料领域。一种钴的化合物能高效催化 还原为
还原为 ,其结构如图所示。
,其结构如图所示。
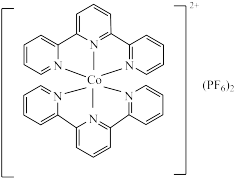
回答下列问题:
(1)基态Co原子的价电子排布式为___________ 。
(2)该物质所含非金属元素中杂化方式为 的有
的有___________ ;其中N、F和P的电负性大小顺序为___________ 。
(3) 的空间结构为
的空间结构为___________ , 与有机基团形成的离子液体常作电解质,其优点是
与有机基团形成的离子液体常作电解质,其优点是___________ 。
(4)该钴的化合物晶体中存在的相互作用力有___________ (填字母)。
a.离子键 b.共价键 c.金属键 d.氢键
(5)一种钴的氧化物在纳米储能领域被广泛研究,其晶胞结构如图所示(白球为Co,黑球为O):
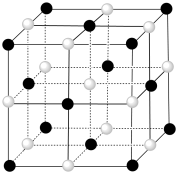
①Co的配位数为___________ 。
②已知晶胞参数为 ,则该晶体的密度为
,则该晶体的密度为___________  。
。
 还原为
还原为 ,其结构如图所示。
,其结构如图所示。
回答下列问题:
(1)基态Co原子的价电子排布式为
(2)该物质所含非金属元素中杂化方式为
 的有
的有(3)
 的空间结构为
的空间结构为 与有机基团形成的离子液体常作电解质,其优点是
与有机基团形成的离子液体常作电解质,其优点是(4)该钴的化合物晶体中存在的相互作用力有
a.离子键 b.共价键 c.金属键 d.氢键
(5)一种钴的氧化物在纳米储能领域被广泛研究,其晶胞结构如图所示(白球为Co,黑球为O):

①Co的配位数为
②已知晶胞参数为
 ,则该晶体的密度为
,则该晶体的密度为 。
。
您最近一年使用:0次
名校
9 . 以红土镍矿(主要成分是 ,含
,含 (等)为原料制备硝酸镍的流程如图所示:
(等)为原料制备硝酸镍的流程如图所示:

注: 为
为 和
和 的混合气体。回答下列问题:
的混合气体。回答下列问题:
(1)基态镍原子价电子排布式为_______ 。
(2)“除铁铝”阶段需要先用 溶液将
溶液将 氧化为
氧化为 。
。 属于
属于_______ (“极性”或“非极性”)分子。
(3)“除镁钙”阶段为加入 除尽
除尽 ,除
,除 后的滤液中
后的滤液中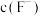 至少应为
至少应为_______  [当溶液中某离子浓度小于
[当溶液中某离子浓度小于 时,可认为该离子沉淀完全。已知该实验条件下
时,可认为该离子沉淀完全。已知该实验条件下 ,
, ]。
]。
(4)“净化液电解”阶段,析镍过程中存在竞争反应,该竞争反应的电极反应式为_______ 。
(5)工业制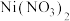 成品时,先用硝酸将
成品时,先用硝酸将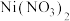 溶液酸化至
溶液酸化至 ,再经减压蒸发浓缩,然后冷却结晶、离心分离。其中“减压蒸发”的目的是
,再经减压蒸发浓缩,然后冷却结晶、离心分离。其中“减压蒸发”的目的是_______ (任答两点)。
(6)工业上用 溶液吸收
溶液吸收 制备硝酸钠,其流程如图所示:
制备硝酸钠,其流程如图所示:
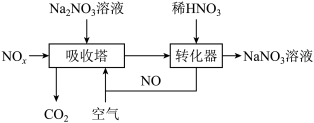
①吸收塔得到 、
、 混合溶液。键角:
混合溶液。键角:
_______  (填“>”、“=”或“<”),
(填“>”、“=”或“<”), 、N、O三种元素中电负性最大的是
、N、O三种元素中电负性最大的是_______ (填元素符号)。
②写出转化器中发生反应的化学方程式:_______ 。
 ,含
,含 (等)为原料制备硝酸镍的流程如图所示:
(等)为原料制备硝酸镍的流程如图所示:
注:
 为
为 和
和 的混合气体。回答下列问题:
的混合气体。回答下列问题:(1)基态镍原子价电子排布式为
(2)“除铁铝”阶段需要先用
 溶液将
溶液将 氧化为
氧化为 。
。 属于
属于(3)“除镁钙”阶段为加入
 除尽
除尽 ,除
,除 后的滤液中
后的滤液中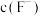 至少应为
至少应为 [当溶液中某离子浓度小于
[当溶液中某离子浓度小于 时,可认为该离子沉淀完全。已知该实验条件下
时,可认为该离子沉淀完全。已知该实验条件下 ,
, ]。
]。(4)“净化液电解”阶段,析镍过程中存在竞争反应,该竞争反应的电极反应式为
(5)工业制
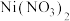 成品时,先用硝酸将
成品时,先用硝酸将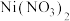 溶液酸化至
溶液酸化至 ,再经减压蒸发浓缩,然后冷却结晶、离心分离。其中“减压蒸发”的目的是
,再经减压蒸发浓缩,然后冷却结晶、离心分离。其中“减压蒸发”的目的是(6)工业上用
 溶液吸收
溶液吸收 制备硝酸钠,其流程如图所示:
制备硝酸钠,其流程如图所示:
①吸收塔得到
 、
、 混合溶液。键角:
混合溶液。键角:
 (填“>”、“=”或“<”),
(填“>”、“=”或“<”), 、N、O三种元素中电负性最大的是
、N、O三种元素中电负性最大的是②写出转化器中发生反应的化学方程式:
您最近一年使用:0次
2023-04-27更新
|
416次组卷
|
3卷引用:福建省厦门第一中学2023届高三下学期模拟考试化学试题
解题方法
10 . 点击化学(click chemistry)是一种能够让分子的构建模块快速、高效地结合在一起的化学反应。科学工作者可以利用基础模块搭建出变化无穷的造型,就如同玩乐高玩具一般。叠氨化物和块经合成抗真菌药物三唑是点击化学的重要应用,反应示例如下:
(1) 的核外电子排布式为
的核外电子排布式为_______ 。
(2)C、N、Cu的电负性由大到小的顺序为_______ 。
(3)分子乙中存在5中心6电子的大 键,其中,提供两个电子形成大
键,其中,提供两个电子形成大 键(
键(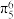 )的原子是
)的原子是_______ (填对应原子的序号)。
(4)分子中碳碳三键的活泼性:甲_______ 丙(填“>”“=”“<”),理由是_______ (从分子的结构角度分析)。
(5)丁形成的晶体中不存在的微粒间作用力有_______ 。
A.离子键 B.极性键 C.非极性键 D.氢键 E.范德华力
(6)CuCl的晶胞中, 的位置如图所示,
的位置如图所示, 填充于
填充于 构成的四面体空隙中。
构成的四面体空隙中。 的配位数为
的配位数为_______ 。
②由 构成的八面体空隙与有
构成的八面体空隙与有 填充的
填充的 构成的四面体空隙的数目之比为
构成的四面体空隙的数目之比为_______ 。
 +CH3CH2N3
+CH3CH2N3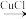

 +CH3CH2N3→
+CH3CH2N3→
(1)
 的核外电子排布式为
的核外电子排布式为(2)C、N、Cu的电负性由大到小的顺序为
(3)分子乙中存在5中心6电子的大
 键,其中,提供两个电子形成大
键,其中,提供两个电子形成大 键(
键(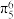 )的原子是
)的原子是(4)分子中碳碳三键的活泼性:甲
(5)丁形成的晶体中不存在的微粒间作用力有
A.离子键 B.极性键 C.非极性键 D.氢键 E.范德华力
(6)CuCl的晶胞中,
 的位置如图所示,
的位置如图所示, 填充于
填充于 构成的四面体空隙中。
构成的四面体空隙中。
 的配位数为
的配位数为②由
 构成的八面体空隙与有
构成的八面体空隙与有 填充的
填充的 构成的四面体空隙的数目之比为
构成的四面体空隙的数目之比为
您最近一年使用:0次



