名校
解题方法
1 . A、B、C、D为原子序数依次增大的四种短周期元素,A2-和B+具有相同的电子层结构,C、D为同周期元素,C元素原子核外电子总数是最外层电子数的3倍;D元素同周期中原子半径最小的元素。回答下列问题:
(1)四种元素中电负性最大的是_______ (填元素符号),其中C原子的核外电子排布式为_______ 。
(2)A的两种单质互为同素异形体,其中沸点高的是_______ (填分子式),原因是_______ ;A和B的氢化物所属的晶体类型分别为_______ 和_______ 。
(3)C和D可按原子个数比为1∶3形成化合物E,E的空间结构为_______ ,中心原子的杂化轨道类型为_______ 。
(4)化合物D2A的空间结构为_______ ,中心原子的价层电子对数为_______ ;
(5)面心立方ZnS晶胞与金刚石的晶胞结构类似,阴、阳离子各占晶胞所含粒子数的一半。
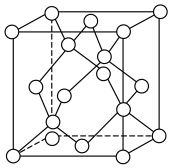
若该ZnS晶胞的晶胞参数为a pm,阿伏加德罗常数的值为NA,则晶体的密度为_______ g·cm-3。
(1)四种元素中电负性最大的是
(2)A的两种单质互为同素异形体,其中沸点高的是
(3)C和D可按原子个数比为1∶3形成化合物E,E的空间结构为
(4)化合物D2A的空间结构为
(5)面心立方ZnS晶胞与金刚石的晶胞结构类似,阴、阳离子各占晶胞所含粒子数的一半。

若该ZnS晶胞的晶胞参数为a pm,阿伏加德罗常数的值为NA,则晶体的密度为
您最近一年使用:0次
名校
解题方法
2 . 铁及其化合物在生产、生活中有重要的应用。回答下列问题:
(1)基态Fe原子的价电子排布图为________ ,Fe2+核外电子有_________ 种空间运动状态。
(2)血红蛋白(Hb)是血液中运输氧及二氧化碳的蛋白质,由球蛋白与血红素结合而成。血红素是由中心Fe2+与配体卟啉衍生物结合成的大环配位化合物,其结构如图所示。

①血红素中Fe2+的配位数为___________ ,碳原子的杂化方式有___________ 种。
②血红素中4种非金属元素的电负性由小到大的顺序为__________ 。
(3)FeCl3是常用的净水剂,FeCl3的熔点(306℃)显著低于FeF3的熔点(1000℃),其原因是___________ 。
(4)磷青铜是一种具有高耐腐蚀性、耐磨损性的合金材料,广泛用于机械零件制造。磷青铜的晶体结构如下图所示。
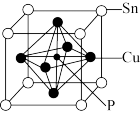
①该晶体的化学式为___________ 。
②若该晶胞的边长为apm,阿伏伽德罗常数为NA,则该晶体的密度为________ g/cm3(列出计算式)。
(1)基态Fe原子的价电子排布图为
(2)血红蛋白(Hb)是血液中运输氧及二氧化碳的蛋白质,由球蛋白与血红素结合而成。血红素是由中心Fe2+与配体卟啉衍生物结合成的大环配位化合物,其结构如图所示。

①血红素中Fe2+的配位数为
②血红素中4种非金属元素的电负性由小到大的顺序为
(3)FeCl3是常用的净水剂,FeCl3的熔点(306℃)显著低于FeF3的熔点(1000℃),其原因是
(4)磷青铜是一种具有高耐腐蚀性、耐磨损性的合金材料,广泛用于机械零件制造。磷青铜的晶体结构如下图所示。

①该晶体的化学式为
②若该晶胞的边长为apm,阿伏伽德罗常数为NA,则该晶体的密度为
您最近一年使用:0次
2023-08-01更新
|
311次组卷
|
2卷引用:广东省广州市执信中学2023-2024学年高三上学期开学考试化学试题
解题方法
3 . “中国紫”——硅酸铜钡( ),其合成原料为
),其合成原料为 、孔雀石[
、孔雀石[ ]和砂子(
]和砂子( )。回答下列问题:
)。回答下列问题:
(1)基态Ba原子的价电子排布式为_______ 。
(2) 常用作光导纤维,在生产和生活中有广泛的用途。
常用作光导纤维,在生产和生活中有广泛的用途。
① 属于
属于_______ 晶体,在 晶体中,硅原子的杂化类型为
晶体中,硅原子的杂化类型为_______ , 的空间构型为
的空间构型为_______ 。
②1mol 晶体中,Si-O键的数目为
晶体中,Si-O键的数目为_______ 。
(3) 不溶于水,但可溶于浓氨水,反应的化学方程式为
不溶于水,但可溶于浓氨水,反应的化学方程式为
 。
。
①氨水中存在的化学键有_______ (填标号)。
A.极性键 B.非极性键 C.氢键 D.σ键 E.π键
② 中配体是
中配体是_______ ,所含元素中电负性最小的非金属元素是_______ (填元素符号)。
(4) 的熔点比
的熔点比 的
的_______ (填“高”或“低”),原因是_______ 。
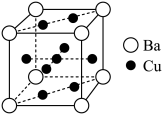
(5)Cu和Ba形成的某种合金的晶胞结构如图所示,设 为阿伏加德罗常数的值,晶胞参数为a nm,则该晶体的密度
为阿伏加德罗常数的值,晶胞参数为a nm,则该晶体的密度
_______ (列出计算式) 。
。
 ),其合成原料为
),其合成原料为 、孔雀石[
、孔雀石[ ]和砂子(
]和砂子( )。回答下列问题:
)。回答下列问题:(1)基态Ba原子的价电子排布式为
(2)
 常用作光导纤维,在生产和生活中有广泛的用途。
常用作光导纤维,在生产和生活中有广泛的用途。①
 属于
属于 晶体中,硅原子的杂化类型为
晶体中,硅原子的杂化类型为 的空间构型为
的空间构型为②1mol
 晶体中,Si-O键的数目为
晶体中,Si-O键的数目为(3)
 不溶于水,但可溶于浓氨水,反应的化学方程式为
不溶于水,但可溶于浓氨水,反应的化学方程式为
 。
。①氨水中存在的化学键有
A.极性键 B.非极性键 C.氢键 D.σ键 E.π键
②
 中配体是
中配体是(4)
 的熔点比
的熔点比 的
的(5)Cu和Ba形成的某种合金的晶胞结构如图所示,设
 为阿伏加德罗常数的值,晶胞参数为a nm,则该晶体的密度
为阿伏加德罗常数的值,晶胞参数为a nm,则该晶体的密度
 。
。
您最近一年使用:0次
解题方法
4 . 离子液体被认为是21世纪理想的绿色溶剂,是指室温或者接近室温时呈液态,而本身由阴、阳离子构成的化合物。氯代1-丁基-3-甲基咪唑离子液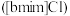 可以与
可以与 混合形成离子液体;
混合形成离子液体; 也可以转化成其他离子液体,下图是
也可以转化成其他离子液体,下图是 与
与 离子交换反应合成离子液体
离子交换反应合成离子液体 的流程:
的流程:

(1)请画出基态Ga原子的价电子排布图_____ ;同周期元素中基态原子未成对电子数与硼(B)原子相同的有_____ (填元素符号)。
(2)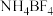 中N原子的杂化方式为
中N原子的杂化方式为_____ ,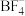 的空间构型为
的空间构型为_____ , 中几种元素电负性由大到小的顺序为
中几种元素电负性由大到小的顺序为_____ 。
(3)已知分子中的大 键可以用
键可以用 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表大
键的原子数,n代表大 键中的电子数,则
键中的电子数,则 中大
中大 键可以表示为
键可以表示为_____ 。
(4) 熔点为
熔点为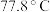 ,则
,则 的晶体类型为
的晶体类型为_____ , 和
和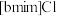 混合形成离子液体的过程中会存在以下转化:
混合形成离子液体的过程中会存在以下转化: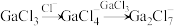 ,请画出
,请画出 的结构式
的结构式_____ 。
(5)某种 的晶胞结构如图所示,O2−以六方最密方式堆积,
的晶胞结构如图所示,O2−以六方最密方式堆积, 在其八面体空隙中(注:未全部标出,如:
在其八面体空隙中(注:未全部标出,如: 在1、2、3、4、5、6构成的八面体体心)。
在1、2、3、4、5、6构成的八面体体心)。
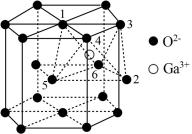
①该晶胞中O2−的配位数为_____ 。
②已知氧离子半径为acm,晶胞的高为bcm,NA代表阿伏加德罗常数的值,该晶体的密度为_____ g·cm−3(用含 和NA的代数式表示)。
和NA的代数式表示)。
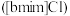 可以与
可以与 混合形成离子液体;
混合形成离子液体; 也可以转化成其他离子液体,下图是
也可以转化成其他离子液体,下图是 与
与 离子交换反应合成离子液体
离子交换反应合成离子液体 的流程:
的流程:
(1)请画出基态Ga原子的价电子排布图
(2)
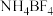 中N原子的杂化方式为
中N原子的杂化方式为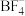 的空间构型为
的空间构型为 中几种元素电负性由大到小的顺序为
中几种元素电负性由大到小的顺序为(3)已知分子中的大
 键可以用
键可以用 表示,其中m代表参与形成大
表示,其中m代表参与形成大 键的原子数,n代表大
键的原子数,n代表大 键中的电子数,则
键中的电子数,则 中大
中大 键可以表示为
键可以表示为(4)
 熔点为
熔点为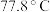 ,则
,则 的晶体类型为
的晶体类型为 和
和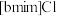 混合形成离子液体的过程中会存在以下转化:
混合形成离子液体的过程中会存在以下转化: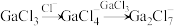 ,请画出
,请画出 的结构式
的结构式(5)某种
 的晶胞结构如图所示,O2−以六方最密方式堆积,
的晶胞结构如图所示,O2−以六方最密方式堆积, 在其八面体空隙中(注:未全部标出,如:
在其八面体空隙中(注:未全部标出,如: 在1、2、3、4、5、6构成的八面体体心)。
在1、2、3、4、5、6构成的八面体体心)。
①该晶胞中O2−的配位数为
②已知氧离子半径为acm,晶胞的高为bcm,NA代表阿伏加德罗常数的值,该晶体的密度为
 和NA的代数式表示)。
和NA的代数式表示)。
您最近一年使用:0次
解题方法
5 . 2021年诺贝尔化学奖授予B.List与D.MacMillan两位科学家在“不对称有机催化”方面做出的杰出贡献。被誉为“第三类催化剂”的有机催化剂的特点是有一个由碳原子组成的稳定架构,搭配氧、氮、硫、磷等元素。化合物Ⅰ与Ⅱ均是重要的有机催化剂。
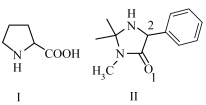
(1)基态H、C、N、O原子中,单电子数最多的是_______ (填元素符号,下同),电负性最大的是_______ 。
(2)化合物Ⅰ中碳原子采用的杂化方式为_______ ,化合物Ⅰ水溶性特别好,可能原因是________ 。
(3)关于化合物Ⅱ,以下说法正确的是_______ 。
A.在Ⅱ中所有C原子均形成极性共价键与非极性共价键
B.在Ⅱ中含有的五元环结构是正方形
C.1号O原子可与2号H原子产生分子内氢键,降低Ⅱ的沸点
D.Ⅱ属于极性分子
E.C-C键长小于C-N键
(4)科学家最早接触的“第一类催化剂”是过渡金属,比如铁、锰、镍等氧化物。
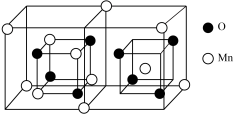
①已知锰的氧化物有多种,且科研工作者常使用MnxOy来表示各种锰氧化物。以下为某种锰的氧化物样品的晶胞结构,其化学式为_______ 。
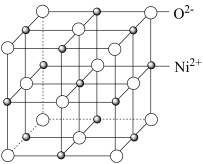
②纯粹的NiO晶体具有NaCl型晶胞结构,若将顶点O2-平移至棱心,则体心Ni2+的位置为_______ (填“体心”“棱心”“面心”“顶点”)。已知晶胞参数为a=425.43pm,晶胞密度ρ=6.47g•cm-3,则阿伏伽德罗常数NA=_______ (列出计算式)。

(1)基态H、C、N、O原子中,单电子数最多的是
(2)化合物Ⅰ中碳原子采用的杂化方式为
(3)关于化合物Ⅱ,以下说法正确的是
A.在Ⅱ中所有C原子均形成极性共价键与非极性共价键
B.在Ⅱ中含有的五元环结构是正方形
C.1号O原子可与2号H原子产生分子内氢键,降低Ⅱ的沸点
D.Ⅱ属于极性分子
E.C-C键长小于C-N键
(4)科学家最早接触的“第一类催化剂”是过渡金属,比如铁、锰、镍等氧化物。
①已知锰的氧化物有多种,且科研工作者常使用MnxOy来表示各种锰氧化物。以下为某种锰的氧化物样品的晶胞结构,其化学式为

②纯粹的NiO晶体具有NaCl型晶胞结构,若将顶点O2-平移至棱心,则体心Ni2+的位置为

您最近一年使用:0次
名校
6 . 以红土镍矿(主要成分是 ,含
,含 (等)为原料制备硝酸镍的流程如图所示:
(等)为原料制备硝酸镍的流程如图所示:

注: 为
为 和
和 的混合气体。回答下列问题:
的混合气体。回答下列问题:
(1)基态镍原子价电子排布式为_______ 。
(2)“除铁铝”阶段需要先用 溶液将
溶液将 氧化为
氧化为 。
。 属于
属于_______ (“极性”或“非极性”)分子。
(3)“除镁钙”阶段为加入 除尽
除尽 ,除
,除 后的滤液中
后的滤液中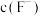 至少应为
至少应为_______  [当溶液中某离子浓度小于
[当溶液中某离子浓度小于 时,可认为该离子沉淀完全。已知该实验条件下
时,可认为该离子沉淀完全。已知该实验条件下 ,
, ]。
]。
(4)“净化液电解”阶段,析镍过程中存在竞争反应,该竞争反应的电极反应式为_______ 。
(5)工业制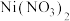 成品时,先用硝酸将
成品时,先用硝酸将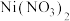 溶液酸化至
溶液酸化至 ,再经减压蒸发浓缩,然后冷却结晶、离心分离。其中“减压蒸发”的目的是
,再经减压蒸发浓缩,然后冷却结晶、离心分离。其中“减压蒸发”的目的是_______ (任答两点)。
(6)工业上用 溶液吸收
溶液吸收 制备硝酸钠,其流程如图所示:
制备硝酸钠,其流程如图所示:
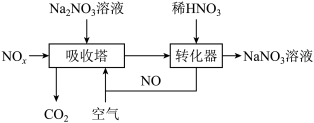
①吸收塔得到 、
、 混合溶液。键角:
混合溶液。键角:
_______  (填“>”、“=”或“<”),
(填“>”、“=”或“<”), 、N、O三种元素中电负性最大的是
、N、O三种元素中电负性最大的是_______ (填元素符号)。
②写出转化器中发生反应的化学方程式:_______ 。
 ,含
,含 (等)为原料制备硝酸镍的流程如图所示:
(等)为原料制备硝酸镍的流程如图所示:
注:
 为
为 和
和 的混合气体。回答下列问题:
的混合气体。回答下列问题:(1)基态镍原子价电子排布式为
(2)“除铁铝”阶段需要先用
 溶液将
溶液将 氧化为
氧化为 。
。 属于
属于(3)“除镁钙”阶段为加入
 除尽
除尽 ,除
,除 后的滤液中
后的滤液中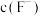 至少应为
至少应为 [当溶液中某离子浓度小于
[当溶液中某离子浓度小于 时,可认为该离子沉淀完全。已知该实验条件下
时,可认为该离子沉淀完全。已知该实验条件下 ,
, ]。
]。(4)“净化液电解”阶段,析镍过程中存在竞争反应,该竞争反应的电极反应式为
(5)工业制
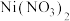 成品时,先用硝酸将
成品时,先用硝酸将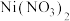 溶液酸化至
溶液酸化至 ,再经减压蒸发浓缩,然后冷却结晶、离心分离。其中“减压蒸发”的目的是
,再经减压蒸发浓缩,然后冷却结晶、离心分离。其中“减压蒸发”的目的是(6)工业上用
 溶液吸收
溶液吸收 制备硝酸钠,其流程如图所示:
制备硝酸钠,其流程如图所示:
①吸收塔得到
 、
、 混合溶液。键角:
混合溶液。键角:
 (填“>”、“=”或“<”),
(填“>”、“=”或“<”), 、N、O三种元素中电负性最大的是
、N、O三种元素中电负性最大的是②写出转化器中发生反应的化学方程式:
您最近一年使用:0次
2023-04-27更新
|
415次组卷
|
3卷引用:广东省部分学校2023届高三下学期4月大联考化学试题
名校
7 . 以A和芳香烃E为原料制备除草剂茚草酮中间体(Ⅰ)的合成路线如下:
(1)A中所含官能团的名称为__________ 。
(2)B→C的反应类型为__________ 。
(3)D中碳原子的杂化轨道类型有__________ ;其中,电负性最大的元素为__________ 。
(4)写出F→G的化学方程式__________ 。
(5)B的同分异构体中,满足下列条件的结构有______ 种;其中,核磁共振氢谱有四组峰,且峰面积之比为6∶2∶2∶1的结构简式为__________ 。
条件:①含有苯环;
②与 溶液发生显色反应;
溶液发生显色反应;
③含有2个甲基,且连在同一个碳原子上。
(6)利用原子示踪技术追踪G→H的反应过程:
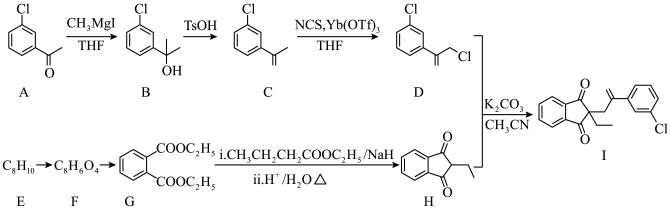
(1)A中所含官能团的名称为
(2)B→C的反应类型为
(3)D中碳原子的杂化轨道类型有
(4)写出F→G的化学方程式
(5)B的同分异构体中,满足下列条件的结构有
条件:①含有苯环;
②与
 溶液发生显色反应;
溶液发生显色反应;③含有2个甲基,且连在同一个碳原子上。
(6)利用原子示踪技术追踪G→H的反应过程:
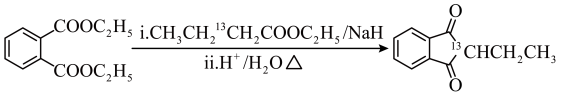
根据上述信息,写出以乙醇和 为原料合成
为原料合成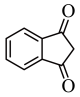 的路线(无机试剂任选)
的路线(无机试剂任选)
您最近一年使用:0次
2023-02-19更新
|
2285次组卷
|
9卷引用:广东省深圳市2022-2023学年高三第一次调研考试化学试题
广东省深圳市2022-2023学年高三第一次调研考试化学试题(已下线)广东省深圳市2022-2023学年高三第一次调研考试变式题(有机综合题)(已下线)专题21 有机推断题(已下线)广东省广州市天河区2023届高三二模化学试题变式题(有机推断题)(已下线)化学-2023年高考押题预测卷02(广东卷)(含考试版、全解全析、参考答案、答题卡)重庆市南开中学校2023届高三模拟考试化学试题湖南师范大学附属中学2024届高三上学期月考(二) 化学试题(已下线)山东省名校联盟2024届高三下学期5月模拟考试化学试题湖南师范大学附属中学2023-2024学年高三上学期月考化学试卷(二)
22-23高三上·新疆·期末
解题方法
8 . 腈类化合物是一类含氰基(-C≡N)的重要有机化合物,可以用作农药、香料、金属缓蚀剂或液晶材料等,氨氧化法是丙烯腈的重要生产方法,反应原理如下:
CH2=CH-CH3(丙烯)+NH3+O2 CH2=CH-CN(丙烯腈)+H2O(未配平)
CH2=CH-CN(丙烯腈)+H2O(未配平)
(1)丙烯分子中碳原子的杂化方式为_____ ,丙烯腈分子中σ键与π键的数目比为_____ 。
(2)该反应原理中的第二周期各元素的第一电离能由大到小的顺序为_____ ,原因是_____ 。
(3)键角:NH3_____ (填“>”、“<”或“=”)H2O,原因是_____ 。
(4)丙烯腈在不同条件下可以转化为丙酸(CH3CH2COOH)和CH3CHClCOOH,试比较二者酸性的强弱:CH3CH2COOH_____ (填“>”、“<”或“=”)CH3CHClCOOH。
(5)一种金属钼(Mo)的晶胞为体心立方堆积,如图1所示。

①以晶胞参数为单位长度建立如图2所示坐标系,若图1中原子1的坐标为(0,0,0),则图1中原子2的坐标为_____ 。
②若晶胞参数为apm,则图1中原子1和原子2的连线长度为_____ pm,金属钼的密度为_____ g•cm-3。
CH2=CH-CH3(丙烯)+NH3+O2
 CH2=CH-CN(丙烯腈)+H2O(未配平)
CH2=CH-CN(丙烯腈)+H2O(未配平)(1)丙烯分子中碳原子的杂化方式为
(2)该反应原理中的第二周期各元素的第一电离能由大到小的顺序为
(3)键角:NH3
(4)丙烯腈在不同条件下可以转化为丙酸(CH3CH2COOH)和CH3CHClCOOH,试比较二者酸性的强弱:CH3CH2COOH
(5)一种金属钼(Mo)的晶胞为体心立方堆积,如图1所示。

①以晶胞参数为单位长度建立如图2所示坐标系,若图1中原子1的坐标为(0,0,0),则图1中原子2的坐标为
②若晶胞参数为apm,则图1中原子1和原子2的连线长度为
您最近一年使用:0次
2023-01-17更新
|
160次组卷
|
3卷引用:广东省广州市2022届高三一模考试(结构与性质)
(已下线)广东省广州市2022届高三一模考试(结构与性质)新疆维吾尔自治区部分名校2022-2023学年高三上学期期末大联考化学试题海南省万宁市全市2022-2023学年高三下学期2月统考B卷化学试题
解题方法
9 . Al及其化合物在生产生活中有广泛应用。
回答下列问题:
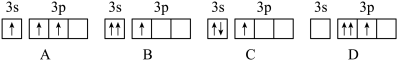
(1)运-20的外壳使用了铝合金:Mg-Al-Mn,下列选项中能表示基态Al原子价层电子排布图的是______ 。(填选项字母);第一电离能:铝______ (填“大于”“等于”或“小于”)镁。
(2)三乙基铝是一种金属有机物,可做火箭燃料,其结构简式为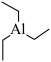 。
。
①三乙基铝熔点为-52.5℃,其晶体类型为______ 。
②三乙基铝中Al的VSEPR模型为______ ,C原子的杂化方式为______ 。
③三乙基铝中所含元素的电负性从大到小的顺序为______ (用元素符号表示)。
(3)工业上冶炼铝时需加入助熔剂冰晶石(Na3AlF6),[AlF6]3-中的中心原子的配位数为______ 。
(4)AlP晶胞结构与Si的类似,如图所示:
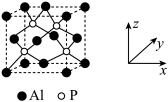
①磷化铝晶胞沿着x轴的投影图为______ (填选项字母)。
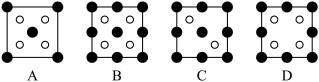
②若磷化铝的晶胞边长为a pm,NA表示阿伏加德罗常数的值,则AlP晶体密度为______ g/cm3(用含NA、a的最简代数式表示)。
回答下列问题:
(1)运-20的外壳使用了铝合金:Mg-Al-Mn,下列选项中能表示基态Al原子价层电子排布图的是

(2)三乙基铝是一种金属有机物,可做火箭燃料,其结构简式为
 。
。①三乙基铝熔点为-52.5℃,其晶体类型为
②三乙基铝中Al的VSEPR模型为
③三乙基铝中所含元素的电负性从大到小的顺序为
(3)工业上冶炼铝时需加入助熔剂冰晶石(Na3AlF6),[AlF6]3-中的中心原子的配位数为
(4)AlP晶胞结构与Si的类似,如图所示:

①磷化铝晶胞沿着x轴的投影图为

②若磷化铝的晶胞边长为a pm,NA表示阿伏加德罗常数的值,则AlP晶体密度为
您最近一年使用:0次
2022-12-24更新
|
145次组卷
|
2卷引用:广东省部分学校2022-2023学年高三上学期12月大联考化学试题
名校
解题方法
10 . 二甲基亚砜(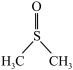 )是一种重要的非质子极性溶剂。铬和锰等过渡金属卤化物在二甲基亚砜中有一定溶解度,故可以应用在有机电化学中。回答下列问题:
)是一种重要的非质子极性溶剂。铬和锰等过渡金属卤化物在二甲基亚砜中有一定溶解度,故可以应用在有机电化学中。回答下列问题:
(1)铬和锰基态原子核外未成对电子数之比为_______ 。
(2)已知:二甲基亚砜能够与水和丙酮(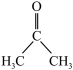 )分别以任意比互溶。
)分别以任意比互溶。
①二甲基亚砜分子中硫原子的杂化类型为_______ 。
②丙酮分子中各原子电负性由大到小的顺序为_______ 。
③二甲基亚砜易溶于水,原因可能为_______ 。
(3)CrCl3·6H2O的结构有三种,且铬的配位数均为6,等物质的量的三种物质电离出的氯离子数目之比为3:2:1,对应的颜色分别为紫色、浅绿色和蓝绿色,其中浅绿色的结构中配离子的化学式为_______ 。
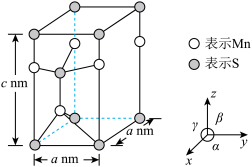
(4)已知硫化锰(MnS)晶胞如图所示,该晶胞参数α=120°,β=γ=90°。
①该晶体中,锰原子周围的硫原子数目为_______ 。
②空间利用率指的是构成晶体的原子、离子或分子在整个晶体空间中所占有的体积百分比。已知锰和硫的原子半径分别r1 nm和r2 nm,该晶体中原子的空间利用率为_______ (列出计算式即可)。
 )是一种重要的非质子极性溶剂。铬和锰等过渡金属卤化物在二甲基亚砜中有一定溶解度,故可以应用在有机电化学中。回答下列问题:
)是一种重要的非质子极性溶剂。铬和锰等过渡金属卤化物在二甲基亚砜中有一定溶解度,故可以应用在有机电化学中。回答下列问题:(1)铬和锰基态原子核外未成对电子数之比为
(2)已知:二甲基亚砜能够与水和丙酮(
 )分别以任意比互溶。
)分别以任意比互溶。①二甲基亚砜分子中硫原子的杂化类型为
②丙酮分子中各原子电负性由大到小的顺序为
③二甲基亚砜易溶于水,原因可能为
(3)CrCl3·6H2O的结构有三种,且铬的配位数均为6,等物质的量的三种物质电离出的氯离子数目之比为3:2:1,对应的颜色分别为紫色、浅绿色和蓝绿色,其中浅绿色的结构中配离子的化学式为
(4)已知硫化锰(MnS)晶胞如图所示,该晶胞参数α=120°,β=γ=90°。
①该晶体中,锰原子周围的硫原子数目为
②空间利用率指的是构成晶体的原子、离子或分子在整个晶体空间中所占有的体积百分比。已知锰和硫的原子半径分别r1 nm和r2 nm,该晶体中原子的空间利用率为

您最近一年使用:0次
2022-10-21更新
|
271次组卷
|
2卷引用:广东省广东实验中学2022-2023学年高三上学期第一次阶段考试化学试题



