1 . 磷酸亚铁锂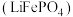 可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,广泛应用于新能源汽车,可采用
可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,广泛应用于新能源汽车,可采用 、
、 、
、 和苯胺等作为原料制备。回答下列问题:
和苯胺等作为原料制备。回答下列问题:
(1)基态Fe原子的价电子排布式为___________ ,基态P原子中未成对电子数为___________ ,N、O和P电负性由大到小的顺序是___________ 。
(2)下列Li原子轨道表示式表示的状态中,能量最高的是_______ (填标号)。
A. B.
B.
C. D.
D.
Li的第一电离能小于相邻元素Be的第一电离能,原因是_______ 。
(3)苯胺( )的晶体类型是
)的晶体类型是___________ , 苯胺中含有的
苯胺中含有的 键数目为
键数目为___________ 。苯胺与甲苯( )的相对分子质量相近,但苯胺的熔点沸点(184.4℃)高于甲苯的沸点(110.6℃),原因是
)的相对分子质量相近,但苯胺的熔点沸点(184.4℃)高于甲苯的沸点(110.6℃),原因是_______ 。
(4)钴酸锂( )的一种晶胞如图所示(仅标出Li,Co与O未标出),晶胞中含有
)的一种晶胞如图所示(仅标出Li,Co与O未标出),晶胞中含有 的个数为
的个数为___________ 。晶胞边长为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,该钴酸锂晶体的密度可表示为
,该钴酸锂晶体的密度可表示为___________  (用含有
(用含有 的代数式表示)。
的代数式表示)。

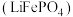 可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,广泛应用于新能源汽车,可采用
可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,广泛应用于新能源汽车,可采用 、
、 、
、 和苯胺等作为原料制备。回答下列问题:
和苯胺等作为原料制备。回答下列问题:(1)基态Fe原子的价电子排布式为
(2)下列Li原子轨道表示式表示的状态中,能量最高的是
A.
 B.
B.
C.
 D.
D.
Li的第一电离能小于相邻元素Be的第一电离能,原因是
(3)苯胺(
 )的晶体类型是
)的晶体类型是 苯胺中含有的
苯胺中含有的 键数目为
键数目为 )的相对分子质量相近,但苯胺的熔点沸点(184.4℃)高于甲苯的沸点(110.6℃),原因是
)的相对分子质量相近,但苯胺的熔点沸点(184.4℃)高于甲苯的沸点(110.6℃),原因是(4)钴酸锂(
 )的一种晶胞如图所示(仅标出Li,Co与O未标出),晶胞中含有
)的一种晶胞如图所示(仅标出Li,Co与O未标出),晶胞中含有 的个数为
的个数为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,该钴酸锂晶体的密度可表示为
,该钴酸锂晶体的密度可表示为 (用含有
(用含有 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
2 . 尿素[CO(NH2)2]是一种重要的化工产品和常用氮肥。回答下列问题:
(1)尿素中C、N、O三种元素的电负性由小到大的顺序是___________ (用元素符号表示)。
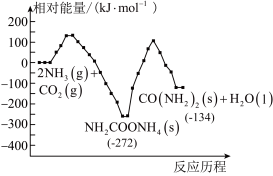
(2)工业上,用CO2和NH3制备尿素,总反应分两个基元反应(反应历程与相对能量关系如图):
①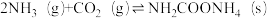
②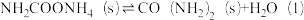
写出总反应的热化学方程式:___________ 。该历程中决速步骤的反应是___________ (填“①”或“②”)。
(3)工业上常用ZnO/NaY作催化剂,用1,2-丙二醇和尿素合成碳酸丙烯酯(PC),原理如下:
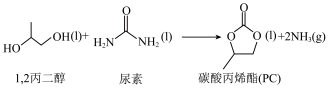 △H=+52kJ·mol-1
△H=+52kJ·mol-1
已知:碳酸丙烯酯(PC)沸点为238.14℃;1,2-丙二醇的沸点为162℃,尿素在160℃以上会分解。
在烧瓶中加入物质的量之比为2:1的1,2-丙二醇和尿素,加入催化剂ZnO/NaY充分反应,测定不同温度下PC的平衡收率变化如图所示。(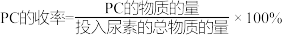 )
)
①160℃以上,PC的收率下降的主要原因可能是___________ 。
②150℃时,1,2-丙二醇的平衡转化率为___________ ;以液相中各物质的量分数代替浓度表示平衡常数Kx=___________ (列出计算式即可)。
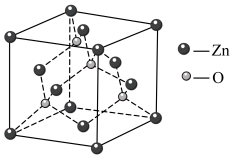
③催化剂中的ZnO有晶体形式,其晶胞如下图,则锌的配位数为___________ ;已知晶胞参数为acm,该晶体的密度为___________ g·cm-3(写出计算式,阿佛加德罗常数的值为NA)。
(1)尿素中C、N、O三种元素的电负性由小到大的顺序是
(2)工业上,用CO2和NH3制备尿素,总反应分两个基元反应(反应历程与相对能量关系如图):

①
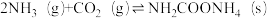
②
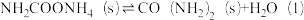
写出总反应的热化学方程式:
(3)工业上常用ZnO/NaY作催化剂,用1,2-丙二醇和尿素合成碳酸丙烯酯(PC),原理如下:
 △H=+52kJ·mol-1
△H=+52kJ·mol-1已知:碳酸丙烯酯(PC)沸点为238.14℃;1,2-丙二醇的沸点为162℃,尿素在160℃以上会分解。
在烧瓶中加入物质的量之比为2:1的1,2-丙二醇和尿素,加入催化剂ZnO/NaY充分反应,测定不同温度下PC的平衡收率变化如图所示。(
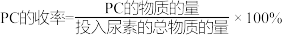 )
)
①160℃以上,PC的收率下降的主要原因可能是
②150℃时,1,2-丙二醇的平衡转化率为
③催化剂中的ZnO有晶体形式,其晶胞如下图,则锌的配位数为

您最近一年使用:0次
3 . 镍铜合金是由60%镍、33%铜、7%铁三种金属组成的合金材料。镍铜合金有较好的室温力学性能和高温强度,耐蚀性强,耐磨性好,可作为航空发动机的结构材料。回答下列问题:
(1)基态Cu2+的价电子排布式为___________ 。
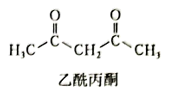
(2)乙酰丙酮(结构如下图)中碳原子的杂化类型为___________ ,乙酰丙酮中σ键与π键数目之比为___________ 。乙酰丙酮中三种元素C、H、O的电负性大小关系:___________ 。
(3)Cu与Fe的第二电离能分别为I2(Cu)=1958 kJ·mol-1 ,I2(Fe)=1561 kJ·mol-1,I2 (Cu)大于I2 (Fe)的主要原因是___________ 。
(4)已知Cu2O的立方晶胞结构如下图所示。
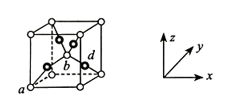
①已知a、b的坐标参数依次为(0,0,0)、( ,
, ,
, ),则d的坐标参数为
),则d的坐标参数为___________ 。
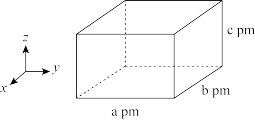
②晶胞边长为c pm,该晶体的密度为___________ g·cm-3.(列出计算式,设NA为阿伏加德罗常数的数值)
(1)基态Cu2+的价电子排布式为
(2)乙酰丙酮(结构如下图)中碳原子的杂化类型为

(3)Cu与Fe的第二电离能分别为I2(Cu)=1958 kJ·mol-1 ,I2(Fe)=1561 kJ·mol-1,I2 (Cu)大于I2 (Fe)的主要原因是
(4)已知Cu2O的立方晶胞结构如下图所示。

①已知a、b的坐标参数依次为(0,0,0)、(
 ,
, ,
, ),则d的坐标参数为
),则d的坐标参数为②晶胞边长为c pm,该晶体的密度为
您最近一年使用:0次
解题方法
4 . 中科院大连化物所化学研究团队在化学链合成NH3研究方面取得新进展,该研究中涉及的物质有Ni-BaH2/Al2O3、Fe-K2O-Al2O3、Cs-Ru/MgO等,相关研究成果发表于《自然》上。请回答下列问题:
(1)[Fe(CN)6]3-离子中σ键和π键的数目之比为_____ ,Ni的价电子排布式_____ 。
(2)元素的第一电离能:Mg_____ Al(填“>”或“<”)。H、B、N、O的电负性由大到小的顺序为_____ 。
(3)已知MgO的熔点为2852℃,CaO的熔点为2614℃,二者的晶体类型为_____ ,NaBH4阴离子的空间构型是_____ 。
(4)铝离子电池能量密度高、成本低且安全性高,是有前景的下一代储能电池。铝离子电池一般采用离子液体作为电解质,一种电解质离子的结构如图:

传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是_____ ,该电解质阳离子结构中环上所有原子共面,其中氮原子的杂化方式为_____ 。
(5)镍的某种氧化物常用作催化剂,其晶胞结构如图所示。其中镍离子形成面心立方结构,氧离子填充在镍离子构成的八面体空隙中,填充率为100%。

①从该晶胞中能分割出来的结构图有_____ (填标号)。
a. b.
b. c.
c. d.
d.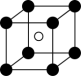 e.
e.
②已知该晶体密度为ρg•cm-3,NA为阿伏伽德罗常数的值。该晶胞中镍离子周围与其等距离的镍离子距离为_____ pm(用含ρ和NA的代数式表示)。
(1)[Fe(CN)6]3-离子中σ键和π键的数目之比为
(2)元素的第一电离能:Mg
(3)已知MgO的熔点为2852℃,CaO的熔点为2614℃,二者的晶体类型为
(4)铝离子电池能量密度高、成本低且安全性高,是有前景的下一代储能电池。铝离子电池一般采用离子液体作为电解质,一种电解质离子的结构如图:

传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是
(5)镍的某种氧化物常用作催化剂,其晶胞结构如图所示。其中镍离子形成面心立方结构,氧离子填充在镍离子构成的八面体空隙中,填充率为100%。

①从该晶胞中能分割出来的结构图有
a.
 b.
b. c.
c. d.
d. e.
e.
②已知该晶体密度为ρg•cm-3,NA为阿伏伽德罗常数的值。该晶胞中镍离子周围与其等距离的镍离子距离为
您最近一年使用:0次
5 . 软包电池(水系 )具有优异的稳定性,良好的容量保持率,且成本较低,大规模储能的应用前景广泛。
)具有优异的稳定性,良好的容量保持率,且成本较低,大规模储能的应用前景广泛。
回答下列问题:
(1)基态 原子核外电子排布式为
原子核外电子排布式为_______ ;原子中运动的电子有两种相反的自旋状态,若一种自旋状态用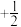 表示,则与之相反的用
表示,则与之相反的用 表示,称为电子的自旋磁量子数。对于基态
表示,称为电子的自旋磁量子数。对于基态 原子,其核外电子自旋磁量子数的代数和为
原子,其核外电子自旋磁量子数的代数和为_______ 。
(2)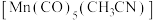 是锰的一种配合物。配体
是锰的一种配合物。配体 与中心原子形成配位键时,提供孤对电子的原子是
与中心原子形成配位键时,提供孤对电子的原子是_______ (填元素符号),其能量最高的电子所在的能级符号为_______ ,配合物中心原子的配位数是_______ 。
(3) 软包电池的关键组件
软包电池的关键组件 结构如图所示。
结构如图所示。

①其中S原子的杂化轨道类型为_______ 。
② 中存在的作用力为
中存在的作用力为_______ (填标号)。
A.金属键 B. 键 C.
键 C. 键 D.氢键
键 D.氢键
③ 中第二周期非金属元素的第一电离能由大到小的顺序为
中第二周期非金属元素的第一电离能由大到小的顺序为_______ ,原因是_______ 。
(4) 掺杂的氮化钛晶胞结构如图所示。距离
掺杂的氮化钛晶胞结构如图所示。距离 最近的
最近的 有
有_______ 个,已知阿伏加德罗常数的值为 ,若晶体的密度为
,若晶体的密度为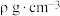 ,该晶胞的边长为
,该晶胞的边长为_______ cm(列出算式)。

 )具有优异的稳定性,良好的容量保持率,且成本较低,大规模储能的应用前景广泛。
)具有优异的稳定性,良好的容量保持率,且成本较低,大规模储能的应用前景广泛。回答下列问题:
(1)基态
 原子核外电子排布式为
原子核外电子排布式为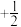 表示,则与之相反的用
表示,则与之相反的用 表示,称为电子的自旋磁量子数。对于基态
表示,称为电子的自旋磁量子数。对于基态 原子,其核外电子自旋磁量子数的代数和为
原子,其核外电子自旋磁量子数的代数和为(2)
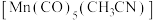 是锰的一种配合物。配体
是锰的一种配合物。配体 与中心原子形成配位键时,提供孤对电子的原子是
与中心原子形成配位键时,提供孤对电子的原子是(3)
 软包电池的关键组件
软包电池的关键组件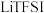 结构如图所示。
结构如图所示。
①其中S原子的杂化轨道类型为
②
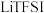 中存在的作用力为
中存在的作用力为A.金属键 B.
 键 C.
键 C. 键 D.氢键
键 D.氢键③
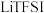 中第二周期非金属元素的第一电离能由大到小的顺序为
中第二周期非金属元素的第一电离能由大到小的顺序为(4)
 掺杂的氮化钛晶胞结构如图所示。距离
掺杂的氮化钛晶胞结构如图所示。距离 最近的
最近的 有
有 ,若晶体的密度为
,若晶体的密度为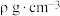 ,该晶胞的边长为
,该晶胞的边长为
您最近一年使用:0次
2022-10-21更新
|
776次组卷
|
3卷引用:广西南宁市2022-2023学年高三上学期摸底测试化学试题
6 . 我国“嫦娥”五号首次实现地外天体采样返回,这是我国航天事业的又一突破。带回的月壤中含有H、N、O、Al、S、Cd、Zn、Ti、Cu、Au、Cr等多种元素。请完成下列问题:
(1)N、O、Al、S四种元素第一电离能从大到小的顺序为_______ 。
(2)Cu、Au是同一副族的元素,Au的原子序数更大,它们属于_______ 区元素,基态Au原子的价电子排布式为_______ 。
(3)SO2分子的空间构型为_______ ,请写出一种与SO2互为等电子体的单质_______ (填化学式)。
(4)某晶体的晶胞结构如图所示,该晶体的化学式为_______ 。如果将Se原子看做密堆积,则其堆积模型为_______ 。
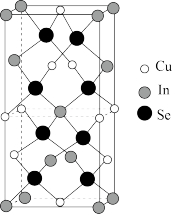
(1)N、O、Al、S四种元素第一电离能从大到小的顺序为
(2)Cu、Au是同一副族的元素,Au的原子序数更大,它们属于
(3)SO2分子的空间构型为
(4)某晶体的晶胞结构如图所示,该晶体的化学式为

您最近一年使用:0次
7 . Cu、Mn等金属单质及其化合物应用十分广泛。回答下列问题:
(1)基态Cu的价层电子排布式为___________ 。基态Mn原子核外未成对电子数为___________ 。
(2)Cu可以形成一种离子化合物 ,
, 中氧原子的杂化类型为
中氧原子的杂化类型为___________ ;配体中的配位原子是___________ ;配体中非金属元素的电负性由大到小的顺序为___________ 。
(3)硝酸锰是工业制备中常用的催化剂, 的
的 空间构型为
空间构型为___________ ;O的第一电离能小于N的第一电离能,原因为___________ 。
(4)锰的一种晶型结构为体心立方堆积(如图),晶胞参数为891.25pm。锰原子半径为___________ pm;已知阿伏加德罗常数的值为 ,该晶体的密度为
,该晶体的密度为___________  。(列出计算式)
。(列出计算式)

(1)基态Cu的价层电子排布式为
(2)Cu可以形成一种离子化合物
 ,
, 中氧原子的杂化类型为
中氧原子的杂化类型为(3)硝酸锰是工业制备中常用的催化剂,
 的
的 空间构型为
空间构型为(4)锰的一种晶型结构为体心立方堆积(如图),晶胞参数为891.25pm。锰原子半径为
 ,该晶体的密度为
,该晶体的密度为 。(列出计算式)
。(列出计算式)
您最近一年使用:0次
名校
解题方法
8 . 离子液体是在室温附近温度下呈液态的盐类物质,一般由有机阳离子和无机阴离子组成。直到1992年,威尔克斯(J.Wilkes)以无色液体N-甲基咪唑为原料,合成了稳定性强、抗水解的[ EMIM]BF4离子液体后,对离子液体的研究才真正广泛开展起来,[EMIM]BF4离子液体合成路线如下。
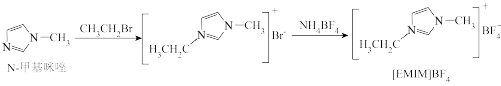
(1)已知:电负性B<H。组成[ EMIM]BF4的元素,电负性由小到大的顺序是_______ 。
(2)离子液体[ EMIM]BF4阴离子的空间构型为_______ ,基态F原子的核外电子空间运动状态有_______ 种。
(3)离子液体在室温下为液体的主要原因是_______ 。
(4)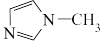 中,N原子和C原子全部位于同-平面,其中的大π键符号为
中,N原子和C原子全部位于同-平面,其中的大π键符号为_______ ,分子中的大π键可用符号π 表示,m表示形成大π键的原子数,n表示形成大π键的电子数,例如苯中的大π键可以表示为π
表示,m表示形成大π键的原子数,n表示形成大π键的电子数,例如苯中的大π键可以表示为π 。
。
(5)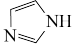 是
是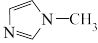 的同系物,室温为白色固体,为平面型分子。熔点比较:
的同系物,室温为白色固体,为平面型分子。熔点比较: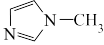
_______ 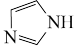 (填>、<或=) ,原因是
(填>、<或=) ,原因是_______ 。
(6)下列说法正确的是_______( 填字母)
(7)[ EMIM]BF4晶胞结构如图所示,晶胞参数为a pm,b pm,c pm以及90°,90° ,90°。已知其晶胞中有8个N原子,以M表示[ EMIM]BF4的相对分子质量,NA表示阿伏加德罗常数的值,晶体的密度为_______ g/cm-3。

(1)已知:电负性B<H。组成[ EMIM]BF4的元素,电负性由小到大的顺序是
(2)离子液体[ EMIM]BF4阴离子的空间构型为
(3)离子液体在室温下为液体的主要原因是
(4)
 中,N原子和C原子全部位于同-平面,其中的大π键符号为
中,N原子和C原子全部位于同-平面,其中的大π键符号为 表示,m表示形成大π键的原子数,n表示形成大π键的电子数,例如苯中的大π键可以表示为π
表示,m表示形成大π键的原子数,n表示形成大π键的电子数,例如苯中的大π键可以表示为π 。
。(5)
 是
是 的同系物,室温为白色固体,为平面型分子。熔点比较:
的同系物,室温为白色固体,为平面型分子。熔点比较:
 (填>、<或=) ,原因是
(填>、<或=) ,原因是(6)下列说法正确的是_______( 填字母)
A.1mol 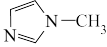 有12molσ键 有12molσ键 |
| B.[EMIM]BF4的的合成路线中所有反应物C原子的杂化形式保持不变,且均为sp3杂化 |
| C.[EMIM] BF4的合成路线中所有反应物N原子的杂化形式保持不变 |
| D.[EMIM] BF4晶体中存在共价键、离子键、范德华力和氢键等相互作用力 |

您最近一年使用:0次
2022-07-01更新
|
169次组卷
|
2卷引用:广西四市玉林市普通高中2022届高三下学期4月教学质量监测考试理科综合化学试题
名校
解题方法
9 . 过氧乙酸又名过醋酸(C2H4O3),是重要化工原料。也是一种绿色生态杀菌剂,其制法为CH3COOH+H2O2=CH3COOOH+H2O。
(1)某同学写出了碳原子的4种不同状态的电子排布图____ 。
A.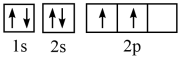 B.
B.
C.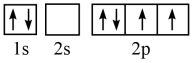 D.
D.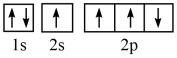
其中能量最低的是____ (填标号),电子由状态C到状态B所得到的光谱为____ 光谱(填“原子发射”或“原子吸收”)。
(2)过氧乙酸分子中C原子的杂化方式有____ 。
(3)乙酸比乙醇易电离出H+的原因____ 。
(4)乙酸和硝酸分子中所包含元素电负性由大到小的顺序是____ (用元素符号表示)。
(5)造纸中,用NaBH4与纸浆中的过氧乙酸以及过渡金属离子反应以提高漂白效率。硼氢化钠、硼氢化铝被认为是有机化学上的“万能还原剂”。
①两种硼氢化物的熔点如表所示:
解释表中两种物质熔点差异的原因____ 。
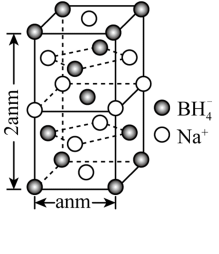
②硼氢化钠晶胞结构如图所示,该晶体中Na+的配位数为____ 。已知:硼氢化钠晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值,则a=___ nm(用含ρ、NA的最简式子表示)
(1)某同学写出了碳原子的4种不同状态的电子排布图
A.
 B.
B.
C.
 D.
D.
其中能量最低的是
(2)过氧乙酸分子中C原子的杂化方式有
(3)乙酸比乙醇易电离出H+的原因
(4)乙酸和硝酸分子中所包含元素电负性由大到小的顺序是
(5)造纸中,用NaBH4与纸浆中的过氧乙酸以及过渡金属离子反应以提高漂白效率。硼氢化钠、硼氢化铝被认为是有机化学上的“万能还原剂”。
①两种硼氢化物的熔点如表所示:
| 硼氢化物 | NaBH4 | Al(BH4)3 |
| 熔点/℃ | 400 | -64.5 |
②硼氢化钠晶胞结构如图所示,该晶体中Na+的配位数为

您最近一年使用:0次
2022-06-29更新
|
608次组卷
|
4卷引用:广西河池高级中学2022届高三下学期4月考试理科综合化学试题
广西河池高级中学2022届高三下学期4月考试理科综合化学试题(已下线)2022年海南省高考真题变式题15-19宁夏六盘山高级中学2023-2024学年高三一模考试化学试题天津市第四十五中学2023-2024学年高三12月月考化学试题
解题方法
10 . 我国科学家研究发现AgGrS2在室温下具有超离子行为(原子可在晶体中自由移动)。回答下列问题:
(1)基态铬原子的核外电子排布式为___________ , 基态硫原子核外有___________ 种不同运动状态的电子。
(2)与硫元素同族的几种元素中,电负性最大的是___________ ( 填元素符号)。常见含硫的微粒有SO2、SO3、 、
、 、 H2S等,
、 H2S等, 的空间构型为
的空间构型为___________ ; 请写出与H2S互为等电子体的一种微粒的化学式___________ ;SO2、SO3杂化轨道类型相同,但键角SO3大于SO2,原因是___________ 。
(3)Ag+与氨水形成的二氨合银配离子[Ag(NH3)2]+的空间构型是直线型,则其中心原子的杂化类型是_____ ,该配离子中的配位原子是___________ (填元素符号),lmol该配离子中含有的σ键的数目为________ 。
(4)复合材料氧铬酸钙的立方晶胞如图所示。
已知A、B的原子分数坐标分别为(0,0,0)、(1,1,0),则C的原子分数坐标为___________ ,该物质的化学式为___________ ,已 知钙和氧的最近距离为a pm。晶体的密度ρ g·cm-3,则阿伏加德罗常数NA=___________ mol-1( 用含a和ρ的式子表示,列出计算式即可)。
(1)基态铬原子的核外电子排布式为
(2)与硫元素同族的几种元素中,电负性最大的是
 、
、 、 H2S等,
、 H2S等, 的空间构型为
的空间构型为(3)Ag+与氨水形成的二氨合银配离子[Ag(NH3)2]+的空间构型是直线型,则其中心原子的杂化类型是
(4)复合材料氧铬酸钙的立方晶胞如图所示。

已知A、B的原子分数坐标分别为(0,0,0)、(1,1,0),则C的原子分数坐标为
您最近一年使用:0次
2022-05-30更新
|
1287次组卷
|
2卷引用:广西桂林、崇左、贺州、河池、来宾市2022届高三下学期4月联合模拟考试理科综合化学试题



