四川省成都市第七中学2023届高三下学期热身考试理科综合化学试题
四川
高三
模拟预测
2023-07-17
1173次
整体难度:
适中
考查范围:
认识化学科学、常见无机物及其应用、化学与STSE、有机化学基础、化学实验基础、物质结构与性质、化学反应原理
四川省成都市第七中学2023届高三下学期热身考试理科综合化学试题
四川
高三
模拟预测
2023-07-17
1173次
整体难度:
适中
考查范围:
认识化学科学、常见无机物及其应用、化学与STSE、有机化学基础、化学实验基础、物质结构与性质、化学反应原理
一、单选题 添加题型下试题
单选题
|
较易(0.85)
名校
解题方法
1. 2022年,在卡塔尔举办的世界杯备受全世界瞩目。下列说法错误的是
| A.开幕式的绚丽烟花利用的“焰色试验”是物理变化 |
| B.运动员需要补充的NaCl溶液是电解质 |
| C.制作奖杯的材料之一18K 金是合金 |
| D.足球赛服材料聚酯纤维属于有机高分子材料 |
您最近一年使用:0次
2023-03-18更新
|
1568次组卷
|
10卷引用:云南省昆明市2023届高三三诊一模理科综合化学试题
云南省昆明市2023届高三三诊一模理科综合化学试题(已下线)专题01 化学与STSE9.3.2合金及其应用(课中)-2019苏教版必修2课前课中课后四川省成都市第七中学2023届高三下学期热身考试理科综合化学试题云南省昆明师范专科学校附属中学2022-2023学年高二下学期6月月考化学试题2024届云南省大理白族自治州民族中学、怒江傈僳族自治州民族中学高三上学期联合模考理综试题福建省厦门市翔安第一中学2023-2024学年高一上学期期末化学模拟试卷(已下线)热点01 化学与STSE、化学与传统文化内蒙古呼和浩特市回民中学2023-2024学年高三上学期期中检测理综试卷2024届四川省成都市第七中学(林荫校区)高三下学期三诊热身考试理综试题(5月6日)-高中化学
单选题
|
适中(0.65)
名校
解题方法
2. NA为阿伏加德罗常数的值。下列叙述正确的是
| A.常温常压下,78g苯中含有的碳碳双键数目为3NA |
| B.20g重水(D2O)中含有的质子数和中子数均为10NA |
| C.200g质量分数为23%的乙醇水溶液中含有的氢原子数为6NA |
| D.标准状况下,22.4LCl2与足量的铁反应,转移的电子数为3NA |
您最近一年使用:0次
2023-06-10更新
|
502次组卷
|
3卷引用:四川省成都市第七中学2023届高三下学期热身考试理科综合化学试题
单选题
|
适中(0.65)
名校
3. 实验室可利用苯和液溴在铁粉的催化作用下制取溴苯,其制备及提纯过程为:制备→水洗并分液→碱洗并分液→水洗并分液分离,部分装置如图所示。下列说法正确的是

| A.制备装置a中长导管可加快产物的挥发 |
| B.装置b用于制备过程中吸收尾气 |
| C.分液时,有机层由装置c的上口倒出 |
| D.分离应选择装置d |
【知识点】 物质分离、提纯的常见物理方法 萃取和分液解读
您最近一年使用:0次
2022-05-16更新
|
1656次组卷
|
8卷引用:云南省昆明市2022届高三“三诊一模”模拟考试理科综合化学试题
云南省昆明市2022届高三“三诊一模”模拟考试理科综合化学试题(已下线)专题11化学实验基础-三年(2020~2022)高考真题汇编(全国卷)(已下线)专题11化学实验基础-五年(2018~2022)高考真题汇编(全国卷)四川省成都市第七中学2023届高三下学期热身考试理科综合化学试题新疆乌鲁木齐市高级中学2024届高三上学期第一次模拟考试化学试题(已下线)热点09 物质的分离、提纯、检验与鉴别(已下线)热点07 常见化学实验仪器与基本操作2024届四川省成都市第七中学(林荫校区)高三下学期三诊热身考试理综试题(5月6日)-高中化学
单选题
|
适中(0.65)
名校
4. 下列说法正确的是
| A.葡萄糖能使酸性高锰酸钾溶液褪色 |
B.CH2=CH2是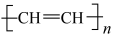 的单体 的单体 |
| C.用光照射甲烷和氯气的混合物发生取代反应,生成4种产物 |
| D.氟利昂-12分子式为CF2Cl2,有两种同分异构体 |
您最近一年使用:0次
2023-06-10更新
|
464次组卷
|
3卷引用:四川省成都市第七中学2023届高三下学期热身考试理科综合化学试题
单选题
|
适中(0.65)
名校
5. X、Y、Z、M、W是五种短周期主族元素,其原子半径与原子序数的关系如图甲所示,X、Y、Z、M形成的化合物如图乙所示,Z与W同主族。下列说法错误的是

| A.简单氢化物的熔沸点:Z>W |
| B.简单离子的半径:W>Z>M |
| C.X2Z2和M2Z2中的化学键类型完全相同 |
| D.最高价氧化物对应水化物的酸性:W>Y |
您最近一年使用:0次
2022-05-16更新
|
1547次组卷
|
4卷引用:云南省昆明市2022届高三“三诊一模”模拟考试理科综合化学试题
单选题
|
较难(0.4)
名校
解题方法
6. 四甲基氢氧化铵[(CH3)4NOH]常用作光刻显影剂。以四甲基碳酸氢铵[(CH3)4NHCO3]水溶液为原料,电解制备(CH3)4NOH的装置如图所示。下列说法不正确的是
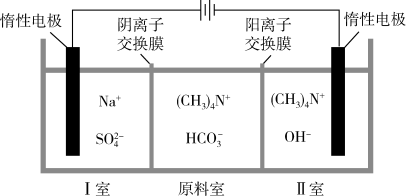
| A.工作时原料室(CH3)4N+向II室迁移 |
| B.Ⅰ室可得到H2和CO2 |
| C.当外电路中有1mol电子通过时,理论上能生成lmol(CH3)4NOH |
D.电解总反应:4(CH3)4NHCO3+2H2O 4(CH3)4NOH+2H2↑+O2↑+4CO2↑ 4(CH3)4NOH+2H2↑+O2↑+4CO2↑ |
【知识点】 电解原理的理解及判断解读 电解池有关计算解读
您最近一年使用:0次
2022-04-22更新
|
2474次组卷
|
12卷引用:广东省广州市2022届高三下学期二模综合测试化学试题
广东省广州市2022届高三下学期二模综合测试化学试题(已下线)化学-2022年高考押题预测卷03(江苏卷)(已下线)化学-2022年高考押题预测卷02(天津卷)广东省广州市广东华侨中学2021-2022学年高一下学期期中考试化学试题(已下线)押广东卷化学第16题 电解池-备战2022年高考化学临考题号押题(广东卷)(已下线)专题10 电解池-备战2023年高考化学母题题源解密(广东卷)湖北省襄阳市第五中学2022届高三适应性考试(一)化学试题黑龙江省鹤岗市第一中学2022-2023学年高三上学期10月月考化学试题四川省成都市第七中学2023届高三下学期热身考试理科综合化学试题(已下线)2023年广东卷高考真题变式题(选择题11-16)2024届四川省成都市第七中学(林荫校区)高三下学期三诊热身考试理综试题(5月6日)-高中化学河南省漯河市高级中学2023-2024学年高三下学期5月月考化学试题
单选题
|
适中(0.65)
名校
7. 常温下,用0.100mol/L的AgNO3溶液滴定50.0mL0.0500mol/LKCl溶液,以K2CrO4为指示剂,测得溶液中pCl=-lgc(Cl-)、pAg=-lgc(Ag+)随加入AgNO3溶液的体积(VAgNO3)变化如图所示。已知:当溶液中离子浓度小于等于1.0×10-5mol/L,则该离子沉淀完全;Ksp(Ag2CrO4)=2.0×10-12。下列说法错误的是
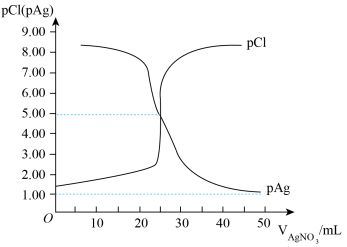
| A.常温下,Ksp(AgCl)的数量级为10-10 |
| B.滴定中指示剂的有效浓度应维持在2.0×10-2mol/L |
| C.该滴定需在强酸性条件下进行 |
| D.饱和AgCl溶液与饱和Ag2CrO4溶液相比,后者的c(Ag+)大 |
您最近一年使用:0次
2023-06-10更新
|
540次组卷
|
4卷引用:四川省成都市第七中学2023届高三下学期热身考试理科综合化学试题
二、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
名校
解题方法
8. 氮化锂(Li3N)是重要的储氢材料,遇水剧烈反应。某研究小组设计实验制备氮化锂并测定其纯度。
I.制备氮化锂_______ (填标号) 。_______ ,盛装的药品是_______ 。
II.测定Li3N产品纯度_______ 。
(4)氮化锂与水反应的化学方程式为_______ , F中液体可以选择_______ (填 “水”“石蜡油”或“饱和食盐水”)。
(5)反应结束冷却至室温后,读数前应先_______ ,测得体积为VL(已折合成标准状况)。若杂质与水反应不产生气体,则Li3N的质量分数为_______ (只列出含m和V的计算式,不必计算化简)。
I.制备氮化锂


II.测定Li3N产品纯度

(4)氮化锂与水反应的化学方程式为
(5)反应结束冷却至室温后,读数前应先
您最近一年使用:0次
2021-05-31更新
|
1229次组卷
|
5卷引用:云南省昆明市2021届高三“三诊一模”模拟考试(三模)理科综合化学试题
云南省昆明市2021届高三“三诊一模”模拟考试(三模)理科综合化学试题(已下线)04 定量分析型综合实验 (解析)-备战2023年高考化学大题逐空突破系列(全国通用)(已下线)题型48 物质含量测定型综合实验四川省成都市第七中学2023届高三下学期热身考试理科综合化学试题2024届四川省成都市第七中学(林荫校区)高三下学期三诊热身考试理综试题(5月6日)-高中化学
解答题-工业流程题
|
适中(0.65)
名校
9. 钴在硬质高温合金、催化剂等高新技术领域有广泛应用。从某炼锌厂的废渣(含Zn、Co、Fe、ZnO、SiO2等)中回收钴的一种工艺流程如图:
回答下列问题:
(1)滤渣1是_______ “加热酸浸”时为确保安全,加热时应避免_______ 。
(2)操作1的名称是_______ ,从流程信息分析,在有机溶剂M中_______ (填“ZnSO4”或“CoSO4”)溶解度更大。操作2是蒸发浓缩、冷却结晶、_______ 。
(3)若无氧化步骤,对实验的影响是_______ 。试剂X可以为下列物质中的_______ 。
A.KOH B. Zn(OH)2 C. ZnO D. Na2CO3
(4)工业上也可利用次氯酸钠氧化Co2+生成Co(OH)3沉淀,实现钴回收。该反应的离子方程式是_______ ,若将次氯酸钠改为Na2S2O8(还原产物为 ),则氧化剂与还原剂的物质的量之比为
),则氧化剂与还原剂的物质的量之比为_______ 。
(5)常温下,已知Co(OH)3的溶度积常数为Ksp,则Co3+完全沉淀时[c(Co3+)<10-5mol·L-1中],溶液的pH至少为_______ (用含Ksp的式子表示)。

| 金属离子 | Co2+ | Fe2+ | Fe3+ | Zn2+ |
| 开始沉淀的pH | 7.15 | 6.3 | 1.5 | 6.2 |
| 沉淀完全的pH | 9.15 | 8.3 | 2.8 | 8.2 |
(1)滤渣1是
(2)操作1的名称是
(3)若无氧化步骤,对实验的影响是
A.KOH B. Zn(OH)2 C. ZnO D. Na2CO3
(4)工业上也可利用次氯酸钠氧化Co2+生成Co(OH)3沉淀,实现钴回收。该反应的离子方程式是
 ),则氧化剂与还原剂的物质的量之比为
),则氧化剂与还原剂的物质的量之比为(5)常温下,已知Co(OH)3的溶度积常数为Ksp,则Co3+完全沉淀时[c(Co3+)<10-5mol·L-1中],溶液的pH至少为
您最近一年使用:0次
2023-06-10更新
|
500次组卷
|
4卷引用:四川省成都市第七中学2023届高三下学期热身考试理科综合化学试题
解答题-原理综合题
|
适中(0.65)
名校
解题方法
10. 大气污染越来越成为人们关注的问题,烟气中的NOx必须脱除(即脱硝)后才能排放。臭氧是理想的烟气脱硝剂,其脱硝反应之一为:NO(g)+O3(g)  NO2(g)+O2(g) ∆H=−200.9 kJ∙mol−1
NO2(g)+O2(g) ∆H=−200.9 kJ∙mol−1
(1)若NO(g)+ O2(g) =NO2(g) ∆H= −58.2 kJ·mol-1,则反应3NO(g)+O3(g)=3NO2(g)的∆H=
O2(g) =NO2(g) ∆H= −58.2 kJ·mol-1,则反应3NO(g)+O3(g)=3NO2(g)的∆H=_______ kJ∙mol−1。
(2)对于反应NO(g)+O3(g) NO2(g)+O2(g),在不同温度下,分别向10L的恒容密闭容器中按1:1充入一定量的NO和O3发生反应,其中NO的物质的量随时间变化如图所示:
NO2(g)+O2(g),在不同温度下,分别向10L的恒容密闭容器中按1:1充入一定量的NO和O3发生反应,其中NO的物质的量随时间变化如图所示:_______ 。
②图中T1_______ T2(填“>”“<”或“=”)。
③温度为T1时,用NO表示t1~t2s内该反应的平均速率为_______ ,该反应的平衡常数K为_______ ,若NO的起始投入量为3a mol,则达到平衡时NO的残留量为_______ mol。
(3) NH3催化还原NO是重要的烟气脱硝技术,研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如图。脱硝过程的总反应的化学方程式为_______ 。
 NO2(g)+O2(g) ∆H=−200.9 kJ∙mol−1
NO2(g)+O2(g) ∆H=−200.9 kJ∙mol−1(1)若NO(g)+
 O2(g) =NO2(g) ∆H= −58.2 kJ·mol-1,则反应3NO(g)+O3(g)=3NO2(g)的∆H=
O2(g) =NO2(g) ∆H= −58.2 kJ·mol-1,则反应3NO(g)+O3(g)=3NO2(g)的∆H=(2)对于反应NO(g)+O3(g)
 NO2(g)+O2(g),在不同温度下,分别向10L的恒容密闭容器中按1:1充入一定量的NO和O3发生反应,其中NO的物质的量随时间变化如图所示:
NO2(g)+O2(g),在不同温度下,分别向10L的恒容密闭容器中按1:1充入一定量的NO和O3发生反应,其中NO的物质的量随时间变化如图所示:
②图中T1
③温度为T1时,用NO表示t1~t2s内该反应的平均速率为
(3) NH3催化还原NO是重要的烟气脱硝技术,研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如图。脱硝过程的总反应的化学方程式为

您最近一年使用:0次
2021-05-31更新
|
587次组卷
|
4卷引用:云南省昆明市2021届高三“三诊一模”模拟考试(三模)理科综合化学试题
解答题-结构与性质
|
较难(0.4)
名校
11. A、B、C、D、E、F均为周期表中前四周期的元素,且原子序数依次增大。请按要求回答下列问题。
(1)A与氢元素形成的两种化合物AH3、A2H4是弱碱,比较下表中两种化合物的熔沸点,解释其高低的主要原因_______ 。
(2)量子力学把电子在原子核外的一个空间运动状态称为一个_______ ,电子除空间运动状态外,还有一种运动状态叫做_______ 。B是地壳中含量最高的元素,B基态原子的电子空间运动状态有_______ 种。
(3)已知C和D为第三周期元素,其原子的第一至第四电离能如下表所示:
下列有关C、D的叙述正确的是_______ 。
a.离子半径C<D
b.电负性C<D
c.单质的熔点C>D
d.C、D的单质均能与氧化物发生置换
e.C的氧化物具有两性
f.C、D均能与氯元素构成离子晶体
(4)已知金属E原子核外的电子运动状态有22种,其外围电子轨道表示式为_______ ,E的晶胞是六方最密堆积结构(如图1),E原子的配位数为_______ ;若E的相对原子质量为M,E原子半径为rcm。该晶胞的空间利用率为_______ (用含r、h的代数式表达,可以不必化简)。_______ (填“是”或否”),该立方体是不是F3B4的晶胞_______ (填“是”或“否”)。
(1)A与氢元素形成的两种化合物AH3、A2H4是弱碱,比较下表中两种化合物的熔沸点,解释其高低的主要原因
| A2H4 | AH3 | |
| 熔点/°C | 2 | -77.8 |
| 沸点/°C | 113.5 | -33.5 |
(3)已知C和D为第三周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| C(或D) | 578 | 1817 | 2745 | 11578 |
| C(或D) | 738 | 1451 | 7733 | 10540 |
a.离子半径C<D
b.电负性C<D
c.单质的熔点C>D
d.C、D的单质均能与氧化物发生置换
e.C的氧化物具有两性
f.C、D均能与氯元素构成离子晶体
(4)已知金属E原子核外的电子运动状态有22种,其外围电子轨道表示式为


您最近一年使用:0次
2023-06-10更新
|
421次组卷
|
3卷引用:四川省成都市第七中学2023届高三下学期热身考试理科综合化学试题
试卷分析
整体难度:适中
考查范围:认识化学科学、常见无机物及其应用、化学与STSE、有机化学基础、化学实验基础、物质结构与性质、化学反应原理
试卷题型(共 11题)
题型
数量
单选题
7
解答题
4
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 非电解质、电解质物质类别判断 焰色试验 高分子材料 常见合金的组成 | |
| 2 | 0.65 | 根据n=m/M的相关计算 氧化还原反应与NA相关推算 物质结构基础与NA相关推算 苯分子结构的特点 | |
| 3 | 0.65 | 物质分离、提纯的常见物理方法 萃取和分液 | |
| 4 | 0.65 | 甲烷的取代反应 乙烯的加成反应 乙烯聚合反应的机理 葡萄糖与新制氢氧化铜溶液的反应实验 | |
| 5 | 0.65 | 元素周期律的应用 根据原子结构进行元素种类推断 “位构性”关系理解及应用 | |
| 6 | 0.4 | 电解原理的理解及判断 电解池有关计算 | |
| 7 | 0.65 | 溶度积规则及其应用 溶度积常数相关计算 | |
| 二、解答题 | |||
| 8 | 0.65 | 物质含量的测定 物质制备的探究 | 实验探究题 |
| 9 | 0.65 | 溶度积规则及其应用 溶度积常数相关计算 常见无机物的制备 | 工业流程题 |
| 10 | 0.65 | 盖斯定律及其有关计算 化学反应速率计算 化学平衡的有关计算 化学平衡常数的有关计算 | 原理综合题 |
| 11 | 0.4 | 电子排布式 元素性质与电负性的关系 氢键对物质性质的影响 晶胞的有关计算 | 结构与性质 |



