氨硼烷(NH3BH3)含氢量高、热稳定性好,是一种具有潜力的固体储氢材料。回答下列问题:
(1)H、B、N中,原子半径最大的是_______ 。根据对角线规则,B的一些化学性质与元素_______ 的相似。
(2)NH3BH3分子中,N—B化学键称为_______ 键,其电子对由_______ 提供。氨硼烷在催化剂作用下水解释放氢气:3NH3BH3+6H2O=3NH +B3O
+B3O +9H2。B3O
+9H2。B3O 的结构为
的结构为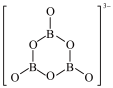 。在该反应中,B原子的杂化轨道类型由
。在该反应中,B原子的杂化轨道类型由_______ 变为_______ 。
(3)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是_______ 。
(4)研究发现,氨硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为a pm、b pm、c pm,α=β=γ=90°。氨硼烷的2×2×2超晶胞结构如图所示。
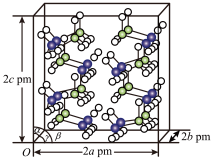
氨硼烷晶体的密度ρ=_______ g·cm-3(列出计算式,设NA为阿伏加德罗常数的值)。
(1)H、B、N中,原子半径最大的是
(2)NH3BH3分子中,N—B化学键称为
 +B3O
+B3O +9H2。B3O
+9H2。B3O 的结构为
的结构为 。在该反应中,B原子的杂化轨道类型由
。在该反应中,B原子的杂化轨道类型由(3)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是
(4)研究发现,氨硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为a pm、b pm、c pm,α=β=γ=90°。氨硼烷的2×2×2超晶胞结构如图所示。

氨硼烷晶体的密度ρ=
2023高三·全国·专题练习 查看更多[1]
(已下线)章末综合评价(五)
更新时间:2023/09/03 22:19:44
|
相似题推荐
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐1】A、B、C、D、E、F是原子序数依次增大的六种元素,A元素原子核外有6种不同运动状态的电子,C元素的基态原子2p轨道上只有一对成对电子,D元素的焰色反应呈黄色,E与C同主族,F是地壳中含量第二多的金属。
根据上述信息回答下列问题:
(1)A与E形成的原子个数比为 的化合物中心原子的杂化方式为
的化合物中心原子的杂化方式为________ ,该化合物的结构式为________ 。
(2)B的核外电子共有________ 种不同的空间运动状态,B的基态原子中能量最高的电子所在原子轨道呈________ 形。
(3)C元素原子的价电子轨道表示式为________ ,B、C、D的简单离子半径由大到小的顺序为________ (用具体的离子符号表示)。
(4)请写出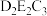 与E的最高价氧化物的水化物的稀溶液的化学反应方程式:
与E的最高价氧化物的水化物的稀溶液的化学反应方程式:________ 。
(5)一种F和A形成的间隙化合物的晶体结构如图1所示,其晶胞为长方体,结构如图2所示(晶胞中部分F原子未标出)。________ ;
②该晶体的化学式为________ (用具体的元素符号作答)。
根据上述信息回答下列问题:
(1)A与E形成的原子个数比为
 的化合物中心原子的杂化方式为
的化合物中心原子的杂化方式为(2)B的核外电子共有
(3)C元素原子的价电子轨道表示式为
(4)请写出
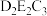 与E的最高价氧化物的水化物的稀溶液的化学反应方程式:
与E的最高价氧化物的水化物的稀溶液的化学反应方程式:(5)一种F和A形成的间隙化合物的晶体结构如图1所示,其晶胞为长方体,结构如图2所示(晶胞中部分F原子未标出)。
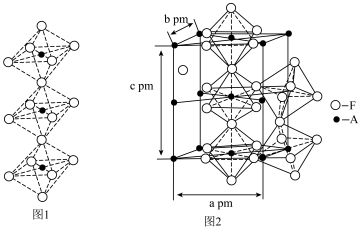
②该晶体的化学式为
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
解题方法
【推荐2】下表列出了①~⑨九种元素在周期表中的位置。

请按要求回答下列问题:
(1)元素⑦的离子结构示意图_______ 。①、④按原子个数比为1∶1组成的分子的电子式_______ ,②与⑧按原子个数比为1∶2组成的分子的结构式_______ 。
(2)④⑥⑨三种元素的离子半径由大到小的顺序是_______ (填化学符号),⑧和⑨两种元素的最高价氧化物对应的水化物中酸性较强的是_______ (填化学式)。
(3)⑤单质在④单质中燃烧,生成物中所含的化学键类型为_______ 。元素④、⑧的氢化物组成结构相似,二者在相同条件下沸点较高的是_______ (填化学式)。

请按要求回答下列问题:
(1)元素⑦的离子结构示意图
(2)④⑥⑨三种元素的离子半径由大到小的顺序是
(3)⑤单质在④单质中燃烧,生成物中所含的化学键类型为
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
名校
【推荐3】随原子序数递增,八种短周期元素(用字母 等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。
等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。
(1)f在周期表中的位置是_______ 。
(2) 、
、 两种元素的原子可构成一种碱性物质,该物质的电子式是
两种元素的原子可构成一种碱性物质,该物质的电子式是_______ 。
(3)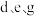 三者简单离子的半径由大到小顺序是(用离子符号表示):
三者简单离子的半径由大到小顺序是(用离子符号表示):_______ 。
(4)写出一个能证明 非金属性强弱的化学方程式:
非金属性强弱的化学方程式:_______ 。
(5)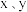 最简单化合物的空间构型为
最简单化合物的空间构型为_______ 。
(6)下列判断不正确的是_______。
 等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。
等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。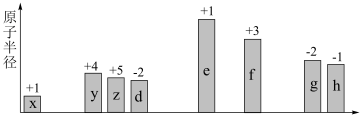
(1)f在周期表中的位置是
(2)
 、
、 两种元素的原子可构成一种碱性物质,该物质的电子式是
两种元素的原子可构成一种碱性物质,该物质的电子式是(3)
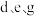 三者简单离子的半径由大到小顺序是(用离子符号表示):
三者简单离子的半径由大到小顺序是(用离子符号表示):(4)写出一个能证明
 非金属性强弱的化学方程式:
非金属性强弱的化学方程式:(5)
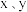 最简单化合物的空间构型为
最简单化合物的空间构型为(6)下列判断不正确的是_______。
A. 和 和 可以形成 可以形成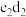 型化合物,正、负离子物质的量之比为 型化合物,正、负离子物质的量之比为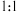 |
B.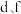 组成的化合物具有两性 组成的化合物具有两性 |
C. 的最高价氧化物对应水化物与 的最高价氧化物对应水化物与 的氢化物反应生成产物中既含有离子键又含有共价键 的氢化物反应生成产物中既含有离子键又含有共价键 |
D. 与 与 同主族,相差两个周期 同主族,相差两个周期 |
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐1】钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料,回答下列问题:
(1)基态Ti原子的核外电子排布式为_ 。
(2)Ti的四卤化物熔点如表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是___ 。
(3)CaTiO3的晶胞如图所示,其组成元素的电负性大小顺序是__ ;金属离子与氧离子间的作用力为__ ,Ca2+的配位数是__ 。
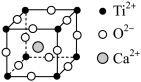
(1)基态Ti原子的核外电子排布式为
(2)Ti的四卤化物熔点如表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是
| 化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | ﹣24.12 | 38.3 | 155 |

您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐2】三明清流“天芳悦潭”温泉富含珍稀“锗”元素。其中锗石含有人体所需的硒、锌、镍、钴、锰、镁、钙等30多种对人体有益的微量元素。回答下列问题:
(1)锗与碳同族,性质和结构有一定的相似性,锗元素能形成无机化合物(如锗酸钠: ;二锗酸钠:
;二锗酸钠: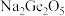 等),也能形成类似于烷烃的锗烷(
等),也能形成类似于烷烃的锗烷( )。
)。
① 中锗原子的杂化方式是
中锗原子的杂化方式是_______ 。
②推测1mol 中含有的σ键的数目是
中含有的σ键的数目是_______ (用 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
(2)利用离子液体 可电沉积还原金属Ge,其熔点只有7℃,其中
可电沉积还原金属Ge,其熔点只有7℃,其中 结构如图所示。
结构如图所示。

①该物质的晶体类型是_______ 。
② 中组成元素的电负性由小到大的顺序是
中组成元素的电负性由小到大的顺序是_______ 。
(3)独立的 分子中H−N−H的键角约为
分子中H−N−H的键角约为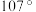 ,
, 中H−N−H的键角
中H−N−H的键角_______ 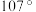 (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。
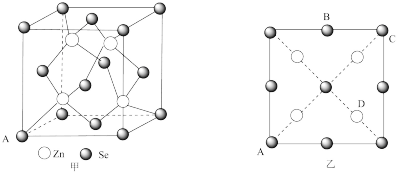
(4)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,该晶胞中硒原子的配位数是_______ ;已知晶胞边长为apm,乙图为甲图的俯视图,A点坐标为(0,0,0),B点坐标为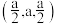 ,则D点坐标为
,则D点坐标为_______ ;若该晶胞密度为 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值 为
为_______ (只列出计算式)。
(1)锗与碳同族,性质和结构有一定的相似性,锗元素能形成无机化合物(如锗酸钠:
 ;二锗酸钠:
;二锗酸钠: 等),也能形成类似于烷烃的锗烷(
等),也能形成类似于烷烃的锗烷( )。
)。①
 中锗原子的杂化方式是
中锗原子的杂化方式是②推测1mol
 中含有的σ键的数目是
中含有的σ键的数目是 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。(2)利用离子液体
 可电沉积还原金属Ge,其熔点只有7℃,其中
可电沉积还原金属Ge,其熔点只有7℃,其中 结构如图所示。
结构如图所示。
①该物质的晶体类型是
②
 中组成元素的电负性由小到大的顺序是
中组成元素的电负性由小到大的顺序是(3)独立的
 分子中H−N−H的键角约为
分子中H−N−H的键角约为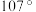 ,
, 中H−N−H的键角
中H−N−H的键角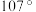 (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。(4)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,该晶胞中硒原子的配位数是
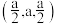 ,则D点坐标为
,则D点坐标为 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值 为
为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐3】太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置。
Ⅰ.第一代电池的光电转换材料是单晶硅。某单晶硅制备工艺中涉及的主要物质转化如下:___________ (填字母)。
a.ⅰ中,C做还原剂
b.碳酸的酸性强于硅酸
c.碳酸的热稳定性弱于硅酸
(2)ⅱ中,1mol Si与3mol HCl反应转移4mol电子。
①该反应的化学方程式为___________ 。
② 中,H的化合价为
中,H的化合价为___________ ,由此推测Si的电负性比H的___________ (填“大”或“小”)。
(3)ⅲ中,利用沸点差异,可直接实现高纯硅与 的分离,从晶体类型角度解释其原因:
的分离,从晶体类型角度解释其原因:___________ 。
Ⅱ.第二代电池的光电转换材料是一种无机物薄膜,其光电转化率高于单晶硅。科学家在元素周期表中Si的附近寻找到元素A和D,并制成化合物AD的薄膜,其晶体结构类似单晶硅。Si、A、D在元素周期表中的位置关系如图所示。
(4)基态A原子核外电子排布式为___________ 。
(5)D的第一电离能比Se的大,从原子结构角度说明理由:___________ 。
Ⅰ.第一代电池的光电转换材料是单晶硅。某单晶硅制备工艺中涉及的主要物质转化如下:

a.ⅰ中,C做还原剂
b.碳酸的酸性强于硅酸
c.碳酸的热稳定性弱于硅酸
(2)ⅱ中,1mol Si与3mol HCl反应转移4mol电子。
①该反应的化学方程式为
②
 中,H的化合价为
中,H的化合价为(3)ⅲ中,利用沸点差异,可直接实现高纯硅与
 的分离,从晶体类型角度解释其原因:
的分离,从晶体类型角度解释其原因:Ⅱ.第二代电池的光电转换材料是一种无机物薄膜,其光电转化率高于单晶硅。科学家在元素周期表中Si的附近寻找到元素A和D,并制成化合物AD的薄膜,其晶体结构类似单晶硅。Si、A、D在元素周期表中的位置关系如图所示。
| Si | ||
| A | D |
(4)基态A原子核外电子排布式为
(5)D的第一电离能比Se的大,从原子结构角度说明理由:
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
【推荐1】氮、氧、硫、磷是与生命活动密切相关的元素。回答下列问题:
(1)SO2分子的VSEPR模型名称是___________
(2)N、O、P三种元素第一电离能由大到小的顺序是___________
(3)SCN-中C原子的杂化类型为___________ 杂化,1 mol SCN-中含π键的数目为___________ NA。
(4)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。磷化硼是一种超硬耐磨的涂层材料,其晶胞结构如图所示,其中原子坐标参数A为(0,0,0);B为( ,
, ,0);D为(1,1,1)。则C的原子坐标参数为
,0);D为(1,1,1)。则C的原子坐标参数为___________

②晶胞参数,描述晶胞的大小和形状。P原子与B原子的最近距离为a cm,则磷化硼晶胞的边长为___________ cm。(用含a的代数式表示)
(1)SO2分子的VSEPR模型名称是
(2)N、O、P三种元素第一电离能由大到小的顺序是
(3)SCN-中C原子的杂化类型为
(4)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。磷化硼是一种超硬耐磨的涂层材料,其晶胞结构如图所示,其中原子坐标参数A为(0,0,0);B为(
 ,
, ,0);D为(1,1,1)。则C的原子坐标参数为
,0);D为(1,1,1)。则C的原子坐标参数为
②晶胞参数,描述晶胞的大小和形状。P原子与B原子的最近距离为a cm,则磷化硼晶胞的边长为
您最近一年使用:0次
解答题-无机推断题
|
较易
(0.85)
解题方法
【推荐2】现有6种短周期元素X、Y、Z、W、M、Q,其原子序数依次增大,部分信息如下表:
请用相应的化学用语回答下列问题:
(1)中子数为8的一种Y原子常用于判断古生物化石年代,其原子符号是________ 。
(2)基态Q原子的核外电子排布中,电子占据的最高能级符号是________ ,其电子云轮廓图为________ 形。
(3)Z的电负性________ W的电负性(填“>”或“<”,下同),Z的第一电离能________ W的第一电离能,Z、W、M的简单离子半径由大到小的顺序是________ (用离子符号回答)。
(4)QW 的VSEPR模型是
的VSEPR模型是________ ,QW3分子中的键角是________ 。
(5)ZX 中的X—Z—X键角比ZX3中的X—Z—X键角大,原因是
中的X—Z—X键角比ZX3中的X—Z—X键角大,原因是________ 。
| X | 阴离子电子层结构与氦原子相同 |
| Y | 最高价氧化物在空气中增多会造成温室效应 |
| Z | 双原子单质分子中键与键的数目之比为1:2 |
| W | 基态原子的价电子排布式为nsnnpn+2 |
| M | 短周期元素中原子半径最大 |
| Q | 元素最高化合价与最低化合价的代数和等于4 |
(1)中子数为8的一种Y原子常用于判断古生物化石年代,其原子符号是
(2)基态Q原子的核外电子排布中,电子占据的最高能级符号是
(3)Z的电负性
(4)QW
 的VSEPR模型是
的VSEPR模型是(5)ZX
 中的X—Z—X键角比ZX3中的X—Z—X键角大,原因是
中的X—Z—X键角比ZX3中的X—Z—X键角大,原因是
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐3】我国将力争在2030年前实现碳达峰,2060年前实现碳中和的目标,因此二氧化碳的固定以及转化将成为重要的研究课题。
Ⅰ.在 催化下
催化下 和
和 反应生成甲醇:
反应生成甲醇: 。
。
Ⅱ.新型 水介质电池放电时,温室气体
水介质电池放电时,温室气体 被转化为储氢物质HCOOH。
被转化为储氢物质HCOOH。
请回答下列问题:
(1)I中涉及的 、
、 、
、 、
、 ,属于非极性分子的是
,属于非极性分子的是___________ ,基态O原子核外有___________ 种不同空间运动状态的电子。
(2)HCOOH分子中 键和
键和 键数目之比为
键数目之比为___________ 。
(3)反应 中,碳原子的杂化方式由
中,碳原子的杂化方式由___________ 转变为___________ 。 的沸点高于
的沸点高于 ,原因是
,原因是___________ 。
(4)一种铜的配合物为 ,其配体为
,其配体为___________ ,0.1mol该配合物与足量 溶液充分反应,生成的白色沉淀质量为
溶液充分反应,生成的白色沉淀质量为___________ g。
Ⅰ.在
 催化下
催化下 和
和 反应生成甲醇:
反应生成甲醇: 。
。Ⅱ.新型
 水介质电池放电时,温室气体
水介质电池放电时,温室气体 被转化为储氢物质HCOOH。
被转化为储氢物质HCOOH。请回答下列问题:
(1)I中涉及的
 、
、 、
、 、
、 ,属于非极性分子的是
,属于非极性分子的是(2)HCOOH分子中
 键和
键和 键数目之比为
键数目之比为(3)反应
 中,碳原子的杂化方式由
中,碳原子的杂化方式由 的沸点高于
的沸点高于 ,原因是
,原因是(4)一种铜的配合物为
 ,其配体为
,其配体为 溶液充分反应,生成的白色沉淀质量为
溶液充分反应,生成的白色沉淀质量为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
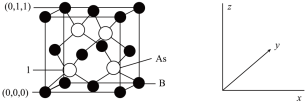
【推荐1】氮(N)、磷(P)、砷(As)等第VA族元素的化合物在研究和生产中有重要用途,请回答下列问题:
(1)第三周期元素的原子中,第一电离能大于磷原子的有_______ 种。
(2)氮族元素氯化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的氢化物(RH3)性质可能有_______ (填序号)。
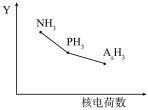
A.稳定性 B.沸点 C.R−H键之间的键角 D.分子间作用力 E.还原性
(3)经测定发现,某种N2O5固体由NO 和
和 两种离子组成,阳离子中N原子的杂化方式是
两种离子组成,阳离子中N原子的杂化方式是_______ 杂化,阴离子的空间构型为_______ 。
(4)超高热导率半导体材料——砷化硼(BAs)的晶胞结构如下图所示,则1号砷原子的坐标为_______ 。已知阿伏加德罗常数的值为NA,若晶胞参数为apm,则该晶体的密度为_______ g·cm−3(列出含a、NA的计算式即可)。
(1)第三周期元素的原子中,第一电离能大于磷原子的有
(2)氮族元素氯化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图所示,则Y轴可表示的氢化物(RH3)性质可能有

A.稳定性 B.沸点 C.R−H键之间的键角 D.分子间作用力 E.还原性
(3)经测定发现,某种N2O5固体由NO
 和
和 两种离子组成,阳离子中N原子的杂化方式是
两种离子组成,阳离子中N原子的杂化方式是(4)超高热导率半导体材料——砷化硼(BAs)的晶胞结构如下图所示,则1号砷原子的坐标为

您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
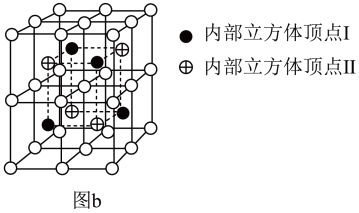
【推荐2】镍的合金及其配合物用途非常广泛。回答下列问题:
(1)Ni与Ca均位于第四周期,最外层电子数也相同,但Ni的熔点和沸点均比Ca的高,这是因为_______ 。
(2)Ni2 MnGa晶体的立方晶胞结构如图a所示。

①已知Ni2MnGa的晶胞参数为0.5822nm,设NA为阿伏加德罗常数的数值,则Ni2MnGa晶体的密度为_______ (列出计算式)g· cm-3。
②Ni2MnGa晶体的晶胞结构还可以用图b表示,若●表示的是Mn,则 表示的是
表示的是_______ ,⊕表示的是_______ 。
(1)Ni与Ca均位于第四周期,最外层电子数也相同,但Ni的熔点和沸点均比Ca的高,这是因为
(2)Ni2 MnGa晶体的立方晶胞结构如图a所示。

①已知Ni2MnGa的晶胞参数为0.5822nm,设NA为阿伏加德罗常数的数值,则Ni2MnGa晶体的密度为
②Ni2MnGa晶体的晶胞结构还可以用图b表示,若●表示的是Mn,则
 表示的是
表示的是
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐3】已发现的高温超导材料按成分分为含铜的和不含铜的。含铜超导材料有铋锶钙铜氧体系、铅锶钇铜氧体系等,不含铜超导体主要是钡镓铋氧体系等。回答下列问题:
(1)钇(Y)的原子序数比 大
大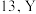 位于元素周期表的第
位于元素周期表的第___________ 族。
(2)基态铜原子的价电子排布式为___________ 。
(3)第一电离能: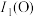
___________ (填“>”“<”或“=”)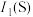 ,其原因是
,其原因是___________ 。
(4) 能与
能与 和
和 形成络合物
形成络合物 。键角:
。键角:
___________ (填“>”或“<”) ,
, 的配位数为
的配位数为___________ , 的空间构型为
的空间构型为___________ , 的杂化方式为
的杂化方式为___________ 。
(5)一种高温超导材料的晶胞结构如图所示,该立方晶胞参数为 。阿伏加德罗常数的值为NA。
。阿伏加德罗常数的值为NA。___________ 。
②晶体中与 最近且距离相等的
最近且距离相等的 有
有___________ 个。
③该晶体的密度为___________  。
。
(1)钇(Y)的原子序数比
 大
大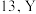 位于元素周期表的第
位于元素周期表的第(2)基态铜原子的价电子排布式为
(3)第一电离能:
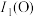
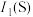 ,其原因是
,其原因是(4)
 能与
能与 和
和 形成络合物
形成络合物 。键角:
。键角:
 ,
, 的配位数为
的配位数为 的空间构型为
的空间构型为 的杂化方式为
的杂化方式为(5)一种高温超导材料的晶胞结构如图所示,该立方晶胞参数为
 。阿伏加德罗常数的值为NA。
。阿伏加德罗常数的值为NA。
②晶体中与
 最近且距离相等的
最近且距离相等的 有
有③该晶体的密度为
 。
。
您最近一年使用:0次



