三明清流“天芳悦潭”温泉富含珍稀“锗”元素。其中锗石含有人体所需的硒、锌、镍、钴、锰、镁、钙等30多种对人体有益的微量元素。回答下列问题:
(1)锗与碳同族,性质和结构有一定的相似性,锗元素能形成无机化合物(如锗酸钠: ;二锗酸钠:
;二锗酸钠: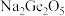 等),也能形成类似于烷烃的锗烷(
等),也能形成类似于烷烃的锗烷( )。
)。
① 中锗原子的杂化方式是
中锗原子的杂化方式是_______ 。
②推测1mol 中含有的σ键的数目是
中含有的σ键的数目是_______ (用 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
(2)利用离子液体 可电沉积还原金属Ge,其熔点只有7℃,其中
可电沉积还原金属Ge,其熔点只有7℃,其中 结构如图所示。
结构如图所示。

①该物质的晶体类型是_______ 。
② 中组成元素的电负性由小到大的顺序是
中组成元素的电负性由小到大的顺序是_______ 。
(3)独立的 分子中H−N−H的键角约为
分子中H−N−H的键角约为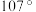 ,
, 中H−N−H的键角
中H−N−H的键角_______ 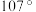 (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。
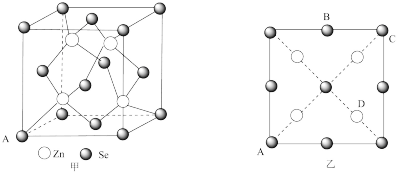
(4)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,该晶胞中硒原子的配位数是_______ ;已知晶胞边长为apm,乙图为甲图的俯视图,A点坐标为(0,0,0),B点坐标为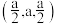 ,则D点坐标为
,则D点坐标为_______ ;若该晶胞密度为 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值 为
为_______ (只列出计算式)。
(1)锗与碳同族,性质和结构有一定的相似性,锗元素能形成无机化合物(如锗酸钠:
 ;二锗酸钠:
;二锗酸钠: 等),也能形成类似于烷烃的锗烷(
等),也能形成类似于烷烃的锗烷( )。
)。①
 中锗原子的杂化方式是
中锗原子的杂化方式是②推测1mol
 中含有的σ键的数目是
中含有的σ键的数目是 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。(2)利用离子液体
 可电沉积还原金属Ge,其熔点只有7℃,其中
可电沉积还原金属Ge,其熔点只有7℃,其中 结构如图所示。
结构如图所示。
①该物质的晶体类型是
②
 中组成元素的电负性由小到大的顺序是
中组成元素的电负性由小到大的顺序是(3)独立的
 分子中H−N−H的键角约为
分子中H−N−H的键角约为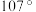 ,
, 中H−N−H的键角
中H−N−H的键角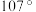 (填“大于”“小于”或“等于”)。
(填“大于”“小于”或“等于”)。(4)硒化锌(ZnSe)是一种重要的半导体材料,其晶胞结构如图甲所示,该晶胞中硒原子的配位数是
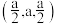 ,则D点坐标为
,则D点坐标为 ,则阿伏加德罗常数的值
,则阿伏加德罗常数的值 为
为
21-22高二·全国·课时练习 查看更多[1]
更新时间:2022-08-28 18:33:09
|
相似题推荐
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐1】已知铜的配合物A(结构如下图)。请回答下列问题:Cu

(1)Cu2+基态核外电子排布式为___________ 。基态Cu原子中,核外电子占据最高能层的符号是___________ 。
(2)A所含三种元素C、N、O的电负性大小顺序为___________ 。其中氮原子的杂化轨道类型为___________ 。
(3)配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2,CO2是___________ 分子(极性或非极性); N2O与CO2互为等电子体,且N2O分子中O只与一个N相连,则N2O的电子式为___________ 。
(4) K与Cu属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cu低。原因是_______
(5)在Cu催化下,甲醇可被氧化为甲醛(HCHO),甲醛分子中H−C=O的键角___________ 120°(选填“大于”、“等于”或“小于”),甲醛能与水形成氢键,其表示式为:___________ 。

(1)Cu2+基态核外电子排布式为
(2)A所含三种元素C、N、O的电负性大小顺序为
(3)配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2,CO2是
(4) K与Cu属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cu低。原因是
(5)在Cu催化下,甲醇可被氧化为甲醛(HCHO),甲醛分子中H−C=O的键角
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐2】钛被誉为太空金属和亲生物金属,拥有卓越的金属特性。它在特定温度下能与多种物质发生反应,在生产和日常生活中都能找到它的踪影。______ ,基态Ti原子的价电子占据原子轨道数目是______ 。
(2) 熔点是
熔点是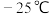 ,沸点136.4℃,可溶于苯或
,沸点136.4℃,可溶于苯或 ,该晶体属于
,该晶体属于______ 晶体; 的制备是以单质Ti和
的制备是以单质Ti和 通过化合反应制得,已知,每转移0.2mol电子放出40.2kJ热量(恢复至室温),请写出该反应的热化学方程式
通过化合反应制得,已知,每转移0.2mol电子放出40.2kJ热量(恢复至室温),请写出该反应的热化学方程式______ ;以 为原料制备
为原料制备 的原理为
的原理为______ (用化学方程式表示)。
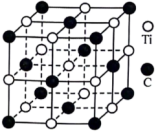
(3)已知TiC在碳化物中硬度最大,工业上一般在真空和高温 条件下用C还原
条件下用C还原 制取
制取 。该反应中涉及的元素按电负性由大到小的顺序排列为
。该反应中涉及的元素按电负性由大到小的顺序排列为______ 。
(4)利用钛粉和碳粉反应可生成碳化钛,它在刀具制造领域有重要应用。在该晶体中Ti原子周围紧邻的Ti原子数目为______ 个;设 为阿伏加德罗常数的值,若晶胞边长为
为阿伏加德罗常数的值,若晶胞边长为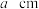 ,则晶体的密度为
,则晶体的密度为______  。(写出表达式)
。(写出表达式)
(2)
 熔点是
熔点是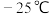 ,沸点136.4℃,可溶于苯或
,沸点136.4℃,可溶于苯或 ,该晶体属于
,该晶体属于 的制备是以单质Ti和
的制备是以单质Ti和 通过化合反应制得,已知,每转移0.2mol电子放出40.2kJ热量(恢复至室温),请写出该反应的热化学方程式
通过化合反应制得,已知,每转移0.2mol电子放出40.2kJ热量(恢复至室温),请写出该反应的热化学方程式 为原料制备
为原料制备 的原理为
的原理为(3)已知TiC在碳化物中硬度最大,工业上一般在真空和高温
 条件下用C还原
条件下用C还原 制取
制取 。该反应中涉及的元素按电负性由大到小的顺序排列为
。该反应中涉及的元素按电负性由大到小的顺序排列为(4)利用钛粉和碳粉反应可生成碳化钛,它在刀具制造领域有重要应用。在该晶体中Ti原子周围紧邻的Ti原子数目为
 为阿伏加德罗常数的值,若晶胞边长为
为阿伏加德罗常数的值,若晶胞边长为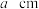 ,则晶体的密度为
,则晶体的密度为 。(写出表达式)
。(写出表达式)
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
【推荐3】钛硅分子筛是一种新型固体催化剂,可催化合成重要有机合成活性试剂甲乙酮肟(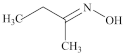 )。回答下列问题:
)。回答下列问题:
(1)基态硅原子的核外电子空间运动状态有___________ 种。
(2)甲乙酮肟中同周期三种元素电负性由大到小的顺序为___________ ,氮原子的杂化方式为___________ ,C=N与C-C键夹角___________ (填“<”“>”或“=”)C=N与N-O键夹角。
(3) 和
和 均是制备钛硅分子筛的重要中间体。
均是制备钛硅分子筛的重要中间体。
① 与光气
与光气 反应可用于制取四氯化钛。
反应可用于制取四氯化钛。 中σ键和π键的数目比为
中σ键和π键的数目比为___________ ,其空间构型为___________ 。
② 与金属
与金属 在高温条件下可反应生成
在高温条件下可反应生成 ,
, 中
中 极易被氧化,还原性很强。试解释
极易被氧化,还原性很强。试解释 还原性强的原因
还原性强的原因___________ 。
 )。回答下列问题:
)。回答下列问题:(1)基态硅原子的核外电子空间运动状态有
(2)甲乙酮肟中同周期三种元素电负性由大到小的顺序为
(3)
 和
和 均是制备钛硅分子筛的重要中间体。
均是制备钛硅分子筛的重要中间体。①
 与光气
与光气 反应可用于制取四氯化钛。
反应可用于制取四氯化钛。 中σ键和π键的数目比为
中σ键和π键的数目比为②
 与金属
与金属 在高温条件下可反应生成
在高温条件下可反应生成 ,
, 中
中 极易被氧化,还原性很强。试解释
极易被氧化,还原性很强。试解释 还原性强的原因
还原性强的原因
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐1】前四周期元素A、B、C、D、E、F,原子序数依次增大,其中A和B同周期,固态的AB2能升华;C和E原子都有一个未成对电子,C+比E-少一个电子层,E原子得到一个电子后3p轨道全充满;D最高价氧化物中D的质量分数为40%,且核内质子数等于中子数;F为红色单质,有F+和F2+两种离子。回答下列问题:
(1)元素电负性:D____ E (填>、<或=);
(2)B、C单质熔点B_____ C(填>、<或=);
(3)AE4中A原子杂化轨道方式为:________ 杂化;其固态晶体类型为________ ;
(4)氢化物的沸点:B比D高的原因______________ ;
(5)F的核外电子排布式为____________________________ ;向F的硫酸盐中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,加入乙醇会析出蓝色晶体,该晶体的化学式为_______ ,其中关于该晶体下列说法中正确的是_____________________ 。
A.加入乙醇的目的是降低溶剂的极性,促使晶体析出
B.F与NH3之间的化学键为离子键
C.该配合物晶体中,N是配位原子,NH3为三角锥型
D.配离子内N原子排列成为平面正方形,则其中F离子是sp3杂化
E.向该晶体的水溶液中加入浓BaCl2溶液有白色沉淀生成
(6)元素X的某价态阴离子Xn−中所有电子正好充满K和L电子层,CnX晶体的最小结构单元为立方体,结构如图所示。该晶体中每个Xn−被________ 个等距离的C+离子包围。已知该晶体的密度为ρg∙cm−3,阿伏伽德罗常数为NA,CnX的摩尔质量为M g∙mol−1,C+和Xn−间的最短距离是_____________ nm。(列出计算式即可) 
(1)元素电负性:D
(2)B、C单质熔点B
(3)AE4中A原子杂化轨道方式为:
(4)氢化物的沸点:B比D高的原因
(5)F的核外电子排布式为
A.加入乙醇的目的是降低溶剂的极性,促使晶体析出
B.F与NH3之间的化学键为离子键
C.该配合物晶体中,N是配位原子,NH3为三角锥型
D.配离子内N原子排列成为平面正方形,则其中F离子是sp3杂化
E.向该晶体的水溶液中加入浓BaCl2溶液有白色沉淀生成
(6)元素X的某价态阴离子Xn−中所有电子正好充满K和L电子层,CnX晶体的最小结构单元为立方体,结构如图所示。该晶体中每个Xn−被

您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
【推荐2】氮的许多重要化合物在半导体材料及炸药等方面用途非常广泛。回答下列问题:
(1)Cu3N是一种半导体材料。基态Cu原子的核外电子排布式为______ ;基态N原子电子占据的最高能级符号为______ ,其电子云轮廓图为______ 形。
(2)NH4NO3是一种炸药,可通过下列方法合成:HNO3+NH3=NH4NO3。
①NH4NO3属于______ 晶体,其中阴离子中氮原子的杂化方式是______ ,该阴离子的空间构型为______ 。
②NH3和NH 中
中 原子的杂化方式
原子的杂化方式______ (填“相同”或“不同”);键角:NH3______ (填“大于”“小于”或“等于”)NH 。
。
(1)Cu3N是一种半导体材料。基态Cu原子的核外电子排布式为
(2)NH4NO3是一种炸药,可通过下列方法合成:HNO3+NH3=NH4NO3。
①NH4NO3属于
②NH3和NH
 中
中 原子的杂化方式
原子的杂化方式 。
。
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐3】过渡金属元素及其化合物的应用广泛,是科学家们进行前沿研究的方向之一、
(1)CuCl的盐酸溶液能够与CO发生反应: 。上述化学方程式中的4种物质含有的化学键类型有
。上述化学方程式中的4种物质含有的化学键类型有___________ 。
A.配位键 B.极性键 C.离子键 D.非极性键 E.氢键 F.金属键
(2) 是一种紫色晶体,其中DMSO为二甲基亚矾,化学式为
是一种紫色晶体,其中DMSO为二甲基亚矾,化学式为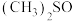 。
。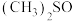 中C—S—O的键角
中C—S—O的键角___________ (填“大于”“小于”或“等于”) 中C—C—O的键角,理由是
中C—C—O的键角,理由是___________ ;元素S、Cl、O的电负性由大到小的顺序为___________ 。
(3) 溶液与乙二胺(
溶液与乙二胺(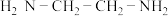 )可形成配离子
)可形成配离子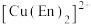 (En是乙二胺的简写):
(En是乙二胺的简写):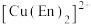 的配位原子为
的配位原子为___________ 。
②乙二胺分子中氮原子轨道的杂化类型为___________ ,乙二胺和三甲胺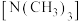 均属于胺,但乙二胺比三甲胺的沸点高的多,原因是
均属于胺,但乙二胺比三甲胺的沸点高的多,原因是___________ 。
(1)CuCl的盐酸溶液能够与CO发生反应:
 。上述化学方程式中的4种物质含有的化学键类型有
。上述化学方程式中的4种物质含有的化学键类型有A.配位键 B.极性键 C.离子键 D.非极性键 E.氢键 F.金属键
(2)
 是一种紫色晶体,其中DMSO为二甲基亚矾,化学式为
是一种紫色晶体,其中DMSO为二甲基亚矾,化学式为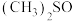 。
。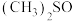 中C—S—O的键角
中C—S—O的键角 中C—C—O的键角,理由是
中C—C—O的键角,理由是(3)
 溶液与乙二胺(
溶液与乙二胺(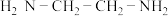 )可形成配离子
)可形成配离子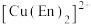 (En是乙二胺的简写):
(En是乙二胺的简写):
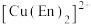 的配位原子为
的配位原子为②乙二胺分子中氮原子轨道的杂化类型为
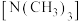 均属于胺,但乙二胺比三甲胺的沸点高的多,原因是
均属于胺,但乙二胺比三甲胺的沸点高的多,原因是
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
解题方法
【推荐1】钛被誉为“21世纪的金属”,可呈现多种化合价,其中以+4价的Ti最为稳定。回答下列问题:
(1)基态Ti原子的价电子排布图为___________ 。
(2)已知电离能:I2(Ti)=1310 kJ·mol-1,I2(K)=3051 kJ·mol-1,I2(Ti)<I2(K),其原因为___________ 。
(3)钛某配合物可用于催化环烯烃聚合,其结构如图所示:
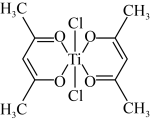
①钛的配位数为___________ ,碳原子的杂化类型___________ 。
②该配合物中存在的化学键有___________ (填字母代号)。
A.离子键 B.配位键 C.金属键 D.共价键 E。氢键
(4)钙钛矿(CaTiO3)是工业获取钛的重要原料。CaTiO3晶胞如下图,边长为a=0.266nm,晶胞中Ti、Ca、O分别处于顶角、体心、面心位置。Ti与O间的最短距离为___________ nm(已知 =1.414),与Ti紧邻的O个数为
=1.414),与Ti紧邻的O个数为___________ 。
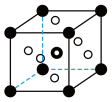
(5)在CaTiO3晶胞结构的另一种表示中,Ca处于各顶角位置,则Ti处于___________ 位置,O处于___________ 位置。
(1)基态Ti原子的价电子排布图为
(2)已知电离能:I2(Ti)=1310 kJ·mol-1,I2(K)=3051 kJ·mol-1,I2(Ti)<I2(K),其原因为
(3)钛某配合物可用于催化环烯烃聚合,其结构如图所示:

①钛的配位数为
②该配合物中存在的化学键有
A.离子键 B.配位键 C.金属键 D.共价键 E。氢键
(4)钙钛矿(CaTiO3)是工业获取钛的重要原料。CaTiO3晶胞如下图,边长为a=0.266nm,晶胞中Ti、Ca、O分别处于顶角、体心、面心位置。Ti与O间的最短距离为
 =1.414),与Ti紧邻的O个数为
=1.414),与Ti紧邻的O个数为
(5)在CaTiO3晶胞结构的另一种表示中,Ca处于各顶角位置,则Ti处于
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐2】黄铜矿(主要成分为CuFeS2)是生产铜、铁和硫酸的原料。回答下列问题:
(1)基态Cu原子的价电子排布式为_______ 。
(2)血红素是吡咯(C4H5N)的重要衍生物,血红素(含Fe2+)可用于治疗缺铁性贫血。吡咯和血红素的结构如图所示:
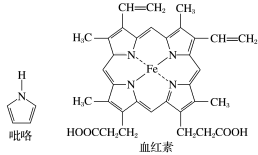
①已知吡咯中的各个原子均在同一平面内,则吡咯分子中N原子的杂化类型为_______ 。
②1mol吡咯分子中所含的σ键总数为_______ 个。
③C、N、O三种元素的简单氢化物中,沸点由低到高的顺序为_______ (填化学式)。
④血液中O2是由血红素在人体内形成的血红蛋白来输送的,则血红蛋白中的Fe2+与O2是通过_______ 键相结合的。
(3)黄铜矿冶炼铜时产生的SO2可经过SO2→SO3→H2SO4途径形成酸雨。SO2的立体构型为_______ 。H2SO4的酸性强于H2SO3的原因是_______ 。
(1)基态Cu原子的价电子排布式为
(2)血红素是吡咯(C4H5N)的重要衍生物,血红素(含Fe2+)可用于治疗缺铁性贫血。吡咯和血红素的结构如图所示:

①已知吡咯中的各个原子均在同一平面内,则吡咯分子中N原子的杂化类型为
②1mol吡咯分子中所含的σ键总数为
③C、N、O三种元素的简单氢化物中,沸点由低到高的顺序为
④血液中O2是由血红素在人体内形成的血红蛋白来输送的,则血红蛋白中的Fe2+与O2是通过
(3)黄铜矿冶炼铜时产生的SO2可经过SO2→SO3→H2SO4途径形成酸雨。SO2的立体构型为
您最近一年使用:0次
解答题-工业流程题
|
较易
(0.85)
【推荐3】镍(Ni)及其化合物广泛应用于电池、电镀和催化剂等领域,一种以电镀废渣(除含镍外,还含有 、
、 、
、 等)为原料获得
等)为原料获得 的流程如图:
的流程如图:
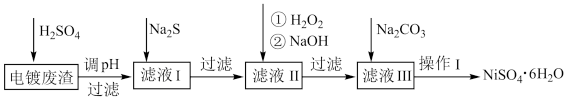
(1) 的VSEPR模型为
的VSEPR模型为_______ 。
(2)加入 的目的是
的目的是_______ [已知: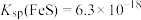 ,
,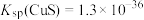 ,
,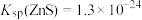 ,
, ]
]
(3) 为
为_______ (填“极性”或“非极性”)分子,写出 与“滤液Ⅱ”反应的离子方程式:
与“滤液Ⅱ”反应的离子方程式:_______ 。
(4)向“滤液Ⅱ”中加入NaOH调节pH在一定范围内可生成氢氧化铁沉淀。已知常温下 的
的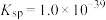 ,若要使溶液中
,若要使溶液中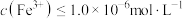 ,则应该控制溶液pH不小于
,则应该控制溶液pH不小于_______ 。
(5)硫酸镍与硫酸铜类似,向硫酸镍中加入足量氨水可以形成 蓝色溶液。在
蓝色溶液。在 中,提供孤对电子的原子是
中,提供孤对电子的原子是_______ , 分子的空间结构为
分子的空间结构为_______ , 的核外电子排布式为
的核外电子排布式为_______ 。
 、
、 、
、 等)为原料获得
等)为原料获得 的流程如图:
的流程如图:
(1)
 的VSEPR模型为
的VSEPR模型为(2)加入
 的目的是
的目的是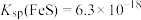 ,
,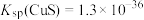 ,
,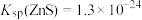 ,
, ]
](3)
 为
为 与“滤液Ⅱ”反应的离子方程式:
与“滤液Ⅱ”反应的离子方程式:(4)向“滤液Ⅱ”中加入NaOH调节pH在一定范围内可生成氢氧化铁沉淀。已知常温下
 的
的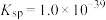 ,若要使溶液中
,若要使溶液中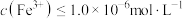 ,则应该控制溶液pH不小于
,则应该控制溶液pH不小于(5)硫酸镍与硫酸铜类似,向硫酸镍中加入足量氨水可以形成
 蓝色溶液。在
蓝色溶液。在 中,提供孤对电子的原子是
中,提供孤对电子的原子是 分子的空间结构为
分子的空间结构为 的核外电子排布式为
的核外电子排布式为
您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
【推荐1】原子序数小于36的X、Y、Z、W、J、G六种元素,原子序数依次增大,其中X元素的含量在宇宙中最高,Y元素原子核外有三种不同的能级且各个能级所填充的电子数相同,W元素原子最外层电子数是内层电子数的3倍,J元素原子核外的3p能级有两个电子,G元素原子核外有6个未成对电子(用元素符号或化学式表示)。
(1)写出G元素的基态原子的价电子排布式_______ ;Y2X2分子中σ键与π键数目之比为_______ 。
(2)Y、Z、W三种元素第一电离能由大到小的顺序为_______ (用元素符号表示)。
(3)XYZ分子中Y原子轨道的杂化类型为_______ ,ZX3在水中的溶解度较大,可能的原因有ZX3能与水反应、_______ 、_______ 。
(4)Z与W可形成Z2W分子,写出一种由短周期元素形成的与该分子互为等电子体的阴离子_______ 。
(5)G元素有δ、γ、α三种同素异形体,晶胞结构如图所示。三种晶体的晶胞中所含有的G原子数之比为_______ 。

(1)写出G元素的基态原子的价电子排布式
(2)Y、Z、W三种元素第一电离能由大到小的顺序为
(3)XYZ分子中Y原子轨道的杂化类型为
(4)Z与W可形成Z2W分子,写出一种由短周期元素形成的与该分子互为等电子体的阴离子
(5)G元素有δ、γ、α三种同素异形体,晶胞结构如图所示。三种晶体的晶胞中所含有的G原子数之比为

您最近一年使用:0次
解答题-结构与性质
|
较易
(0.85)
名校
解题方法
【推荐2】Ⅰ.蒙脱石散对消化道内的病毒、病菌及其产生的毒素、气体等有极强的固定、抑制作用,常用于成人及儿童急性、慢性腹泻。蒙脱石散的有效成分可表示为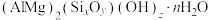 。
。
(1)基态
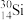 原子的核外电子排布式为
原子的核外电子排布式为(2)O、Mg、Al、Si四种元素的第一电离能从大到小的顺序为
(3)
 是无色透明液体,可以与N-甲基咪唑
是无色透明液体,可以与N-甲基咪唑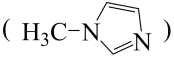 等物质反应。
等物质反应。①将用毛皮摩擦过的橡胶棒靠近 液流,液体流
液流,液体流
②一个N-甲基咪唑分子中含有
(4)硅酸盐与二氧化硅一样,都是以硅氧四面体作为基本结构单元。硅氧四面体可以表示成
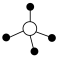 :其中●表示氧原子,中心◯表示硅原子,其俯视图为
:其中●表示氧原子,中心◯表示硅原子,其俯视图为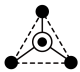 。
。① 晶胞可理解成将金刚石晶胞(如图1所示)中的C原子置换成Si原子,然后在
晶胞可理解成将金刚石晶胞(如图1所示)中的C原子置换成Si原子,然后在 之间插入O原子而形成。
之间插入O原子而形成。
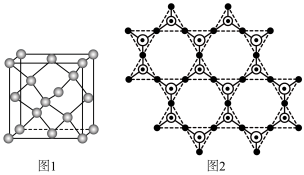
推测 晶胞中含有
晶胞中含有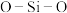 的键角为
的键角为
②蒙脱石散中的“(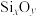 )”是一种大片层状的多硅酸根,其可能结构如图2所示,则
)”是一种大片层状的多硅酸根,其可能结构如图2所示,则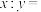
Ⅱ.以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子的分数坐标。四方晶系的晶胞结构如图所示,晶胞棱边夹角均为90°,晶胞中部分原子的分数坐标如下表所示。
坐标原子 | x | y | z |
Cd | 0 | 0 | 0 |
Sn | 0 | 0 | 0.5 |
As | 0.25 | 0.25 | 0.125 |
(5)一个晶胞中有
 最近的Sn
最近的Sn 晶体中与Sn距离最近的As有
晶体中与Sn距离最近的As有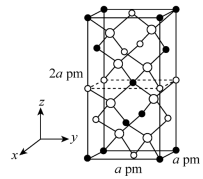
您最近一年使用:0次

 是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:在金属材料中添加
是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:在金属材料中添加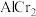 颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。
颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。 和
和 ,则金属原子空间占有率为
,则金属原子空间占有率为


