硒(Se)是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光(AIE)效应以来,AIE在发光材料、生物医学等领域引起广泛关注。一种含Se的新型AIE分子Ⅳ的合成路线如图:
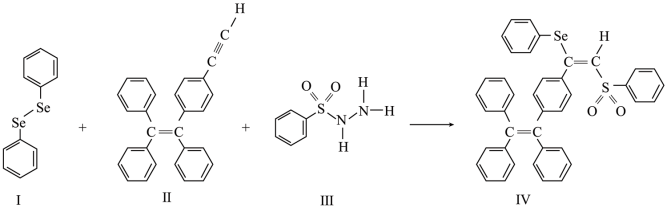
回答下列问题:
(1)Se与S同族,基态硒原子价电子排布式为_____ 。
(2)H2Se的沸点低于H2O,其原因是_____ 。
(3)关于I~Ⅲ三种反应物,下列说法正确的有_____ (填字母)。
A.I中仅有σ键
B.I中的Se-Se键为非极性共价键
C.Ⅱ易溶于水
D.Ⅱ中碳原子的杂化轨道类型只有sp与sp2
E.I~Ⅲ含有的元素中,O电负性最大
(4)Ⅳ中具有孤对电子的原子有_____ (填元素符号)。
(5)硒的两种含氧酸的酸性强弱为H2SeO4_____ H2SeO3(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠(Na2SeO4)可减轻重金属铊引起的中毒。SeO 的立体构型为
的立体构型为_____ 。
(6)钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:
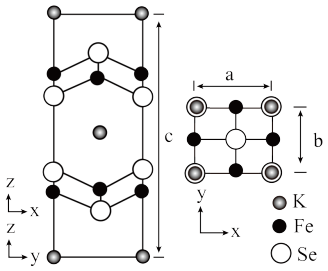
①该超导材料的最简化学式为_____ 。
②Fe原子的配位数为_____ 。
③该晶胞参数a=b=0.4nm、c=1.4nm。阿伏加德罗常数的值为NA,则该晶体的密度为_____ g•cm-3(列出计算式)。

回答下列问题:
(1)Se与S同族,基态硒原子价电子排布式为
(2)H2Se的沸点低于H2O,其原因是
(3)关于I~Ⅲ三种反应物,下列说法正确的有
A.I中仅有σ键
B.I中的Se-Se键为非极性共价键
C.Ⅱ易溶于水
D.Ⅱ中碳原子的杂化轨道类型只有sp与sp2
E.I~Ⅲ含有的元素中,O电负性最大
(4)Ⅳ中具有孤对电子的原子有
(5)硒的两种含氧酸的酸性强弱为H2SeO4
 的立体构型为
的立体构型为(6)钾、铁、硒可以形成一种超导材料,其晶胞在xz、yz和xy平面投影分别如图所示:

①该超导材料的最简化学式为
②Fe原子的配位数为
③该晶胞参数a=b=0.4nm、c=1.4nm。阿伏加德罗常数的值为NA,则该晶体的密度为
2023·陕西咸阳·三模 查看更多[2]
更新时间:2023-05-31 20:28:57
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】化合物I(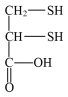 )易与Cu2+结合生成化合物II(
)易与Cu2+结合生成化合物II( )。请回答:
)。请回答:
(1)Cu原子的M电子层中有_______ 个能级,Cu原子的核外电子排布式为_______ 。
(2)下列说法正确的是_______。
(3)化合物I中同周期的两种元素的电负性大小为_______ 。
(4)金属铜的熔点高于钾的原因是_______ 。
(5)Cu可以形成一种离子化合物 。若要确定它是晶体还是非晶体,最科学的方法是对它进行
。若要确定它是晶体还是非晶体,最科学的方法是对它进行_______ 实验;其阴离子的空间构型是_______ 。
(6)CX4的熔沸点如下表所示:
分析上述三种CX4的熔沸点变化原因:_______ 。
 )易与Cu2+结合生成化合物II(
)易与Cu2+结合生成化合物II( )。请回答:
)。请回答:(1)Cu原子的M电子层中有
(2)下列说法正确的是_______。
| A.化合物I中S原子采取sp3杂化 | B.化合物I中碳原子的杂化类型有sp3和sp2 |
| C.化合物II中C-C-C键角是180° | D.化合物II中存在离子键和共价键 |
(4)金属铜的熔点高于钾的原因是
(5)Cu可以形成一种离子化合物
 。若要确定它是晶体还是非晶体,最科学的方法是对它进行
。若要确定它是晶体还是非晶体,最科学的方法是对它进行(6)CX4的熔沸点如下表所示:
| CX4 |  |  | 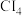 |
| 熔点/℃ | -22.8 | 88 | 170 |
| 沸点/℃ | 76.8 | 190 | 329 |
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】磷酸铁锂LiFePO4)电池在新能源汽车方面应用广泛。回答下列问题:
(1)基态Fe2+的核外电子排布式为_______ ,其电子在原子核外的空间运动状态有_______ 种,基态Fe2+与Fe3+离子中未成对电子数之比为_______ 。
(2)元素的第一电离能用I1表示,则I1(Li)_______ I1(Na)(填“>”、“<”或“=”)。
(3)生产磷酸铁锂离子电池的原料是草酸亚铁(FeC2O4·2H2O)、磷酸氢二铵[(NH4)2HPO4]和碳酸锂(Li2CO3)等。则碳酸根离子的杂化轨道类型为_______ ,磷酸氢二铵中电负性最高的元素是_______ ,1 mol  含σ键的数目为
含σ键的数目为_______ 。
(4)LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。
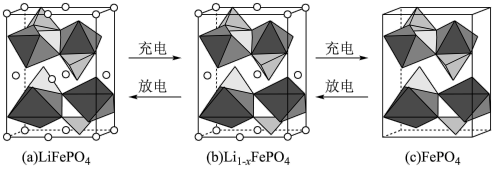
①每个晶胞中含有LiFePO4的单元数有_______ 个。
②当电池充电时,LiFeO4能脱出部分Li+形成Li1-xFePO4,结构示意图如图(b)所示,则x=_______ 。
(1)基态Fe2+的核外电子排布式为
(2)元素的第一电离能用I1表示,则I1(Li)
(3)生产磷酸铁锂离子电池的原料是草酸亚铁(FeC2O4·2H2O)、磷酸氢二铵[(NH4)2HPO4]和碳酸锂(Li2CO3)等。则碳酸根离子的杂化轨道类型为
 含σ键的数目为
含σ键的数目为(4)LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。

①每个晶胞中含有LiFePO4的单元数有
②当电池充电时,LiFeO4能脱出部分Li+形成Li1-xFePO4,结构示意图如图(b)所示,则x=
您最近一年使用:0次
【推荐3】钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料,回答下列问题:
(1)基态Ti原子的核外电子排布式为_______ 。
(2)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是_______ 。
(3)CaTiO3的晶胞如图(a)所示,其组成元素的电负性大小顺序是_______ ;金属离子与氧离子间的作用力为_______ ,Ca2+的配位数是_______ 。
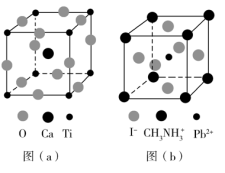
(4)一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I-和有机碱离子 ,其晶胞如图(b)所示。其中Pb2+与图(a)中
,其晶胞如图(b)所示。其中Pb2+与图(a)中_______ 的空间位置相同,有机碱 中,N原子的杂化轨道类型是
中,N原子的杂化轨道类型是_______ ;若晶胞参数为anm,则晶体密度为_______ g∙cm-3(列出计算式)。
(1)基态Ti原子的核外电子排布式为
(2)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是
| 化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | -24.12 | 38.3 | 155 |
(3)CaTiO3的晶胞如图(a)所示,其组成元素的电负性大小顺序是

(4)一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I-和有机碱离子
 ,其晶胞如图(b)所示。其中Pb2+与图(a)中
,其晶胞如图(b)所示。其中Pb2+与图(a)中 中,N原子的杂化轨道类型是
中,N原子的杂化轨道类型是
您最近一年使用:0次
【推荐1】非金属元素数量虽少,却构成了丰富的物质世界,大部分非金属元素分布在元素周期表的p区。回答下列问题:
(1)基态Cl原子的价电子排布式为_______ ,该价层电子中,两种自旋状态的电子数之比为_______ 。
(2)徐光宪在《分子共和国》一书中介绍了许多明星分子,如H2O2、CO2、BF3、CH3COOH等。
①CO2的键角_______ (填“>”“<”或“=”) BF3的键角。
②CH3COOH分子中碳原子的杂化类型为_______ 。
③BF3与一定量水形成晶体Q,Q在一定条件下可转化为R。晶体Q中涉及的化学键类型有_______ (填字母);R中阳离子的空间构型为_______ 。
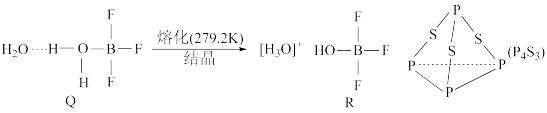
a.离子键 b.共价键 c.配位键 d.氢键
(3)三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如图所示。第一电离能:P_______ (填“>”“<”,或“=”)S,1 mol P4S3分子中含有_______ mol共价键。
(4)化合物K2SeBr6的晶胞结构如图1,沿x、y、z轴方向的投影均力图2,若晶胞参数为a nm,则K2SeBr6晶体密度为_______  (列出计算式,NA为阿伏加德罗常数的值)。
(列出计算式,NA为阿伏加德罗常数的值)。

(1)基态Cl原子的价电子排布式为
(2)徐光宪在《分子共和国》一书中介绍了许多明星分子,如H2O2、CO2、BF3、CH3COOH等。
①CO2的键角
②CH3COOH分子中碳原子的杂化类型为
③BF3与一定量水形成晶体Q,Q在一定条件下可转化为R。晶体Q中涉及的化学键类型有
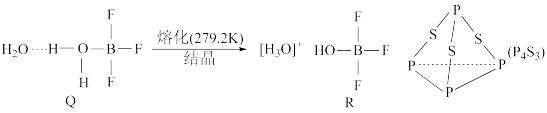
a.离子键 b.共价键 c.配位键 d.氢键
(3)三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如图所示。第一电离能:P
(4)化合物K2SeBr6的晶胞结构如图1,沿x、y、z轴方向的投影均力图2,若晶胞参数为a nm,则K2SeBr6晶体密度为
 (列出计算式,NA为阿伏加德罗常数的值)。
(列出计算式,NA为阿伏加德罗常数的值)。
您最近一年使用:0次
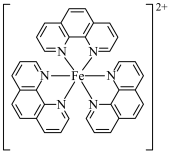
【推荐2】碳元素在自然界中分布很广,是存在形式最复杂的元素。实验室可用邻二氮菲(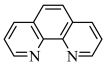 )与
)与 形成的红色配合物(如下图)测定铁的含量。
形成的红色配合物(如下图)测定铁的含量。
回答下列问题:
(1)基态 原子的价电子占据的能量最高的能级是
原子的价电子占据的能量最高的能级是_______ ,基态 原子核外电子的空间运动状态有
原子核外电子的空间运动状态有_______ 种, 的价电子轨道表达式为
的价电子轨道表达式为_______ 。
(2)红色配离子的中心原子的配位数为_______ ;
(3)邻二氮菲分子中C、N两种元素原子的杂化方式分别为_______ 、_______ ;
(4)红色配合物中H、C、N、Fe四种元素的电负性从大到小的顺序为_______ ;
(5)红色配离子中不存在的作用力有_______ ;
A. 键 B.
键 B. 键 C.离子键 D氢键 E.配位键
键 C.离子键 D氢键 E.配位键
(6)临床建议服用维生素 促进“亚铁”的吸收,避免生成
促进“亚铁”的吸收,避免生成 ,从结构角度来看,
,从结构角度来看, 易被氧化成
易被氧化成 的原因是
的原因是_______ ;
(7)汽车安全气囊产生气体的功臣是叠氮化钠 ,
, 的空间构型为
的空间构型为_______ 。
 )与
)与 形成的红色配合物(如下图)测定铁的含量。
形成的红色配合物(如下图)测定铁的含量。
回答下列问题:
(1)基态
 原子的价电子占据的能量最高的能级是
原子的价电子占据的能量最高的能级是 原子核外电子的空间运动状态有
原子核外电子的空间运动状态有 的价电子轨道表达式为
的价电子轨道表达式为(2)红色配离子的中心原子的配位数为
(3)邻二氮菲分子中C、N两种元素原子的杂化方式分别为
(4)红色配合物中H、C、N、Fe四种元素的电负性从大到小的顺序为
(5)红色配离子中不存在的作用力有
A.
 键 B.
键 B. 键 C.离子键 D氢键 E.配位键
键 C.离子键 D氢键 E.配位键(6)临床建议服用维生素
 促进“亚铁”的吸收,避免生成
促进“亚铁”的吸收,避免生成 ,从结构角度来看,
,从结构角度来看, 易被氧化成
易被氧化成 的原因是
的原因是(7)汽车安全气囊产生气体的功臣是叠氮化钠
 ,
, 的空间构型为
的空间构型为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】氨是重要的无机化工产品之一,在国民经济中占有重要地位。我国采用铁触媒(以铁为主的混合物) 做催化剂合成氨。回答下列问题:
(1)Fe基态原子核外电子排布式为____ 。氮化铁是一种重要的无机化合物,不溶于水,暴露在潮湿环境中可释放出氨气,元素Fe和N中,第一电离能较大的是_____ ,基态原子核外未成对电子数较多的是_______ 。
(2)N的氧化物有N2O等,N2O与CO2互为等电子体,N2O的空间构型为__________ 。
(3)N有多种氢化物,其中肼(N2H4)常用作火箭推进剂的燃料,N2H4中N 原子的杂化形式为____ 。
(4)N、P、As为同族元素,NH3、PH3、AsH3三种物质的沸点由高到低的顺序为_____ 。原因是____ 。
(5)K3[Fe(CN)6]常用于检验Fe2+,K3[Fe(CN)6]中存在的化学键类型有_______ 。
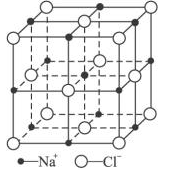
(6)FeO晶体的晶胞与NaCl的相似,NaCl的晶胞如图所示。由于晶体缺陷,某氧化亚铁晶体的实际组成为Fe0.9O,其中包含有Fe2+和Fe3+,晶胞边长为428pm,则该晶体的密度为____ g/cm3(列出计算式即可,用NA表示阿伏伽德罗常数的值)。
 。
。
(1)Fe基态原子核外电子排布式为
(2)N的氧化物有N2O等,N2O与CO2互为等电子体,N2O的空间构型为
(3)N有多种氢化物,其中肼(N2H4)常用作火箭推进剂的燃料,N2H4中N 原子的杂化形式为
(4)N、P、As为同族元素,NH3、PH3、AsH3三种物质的沸点由高到低的顺序为
(5)K3[Fe(CN)6]常用于检验Fe2+,K3[Fe(CN)6]中存在的化学键类型有
(6)FeO晶体的晶胞与NaCl的相似,NaCl的晶胞如图所示。由于晶体缺陷,某氧化亚铁晶体的实际组成为Fe0.9O,其中包含有Fe2+和Fe3+,晶胞边长为428pm,则该晶体的密度为
 。
。
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】氮、磷及其化合物在工农业生产中都有重要作用。
(1)与氯同族的第四周期元素原子的基态核外电子排布式为_______________________ 。
(2)第一电离能介于B、F两种元素之间的第二周期元素有__________ 种。
(3)N2H4是火箭的燃料,与氧气的相对分子质量相同,它在常温常压下是液态,而氧气是气态,造成这种差异的主要原因是____________ 。
(4)2008年,Yoon等人发现Ca与C60(分子结构如图1)生成的Ca32C60能大量吸附H2分子。1 mol C60分子中,含有σ键与π键数目之比为________ 。

(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼可由三溴化硼和三溴化磷于高温下在氢气中反应合成。
①三溴化磷分子的空间构型是_________ ;
②磷化硼晶体晶胞如图2所示:其中实心球为磷原子,在一个晶胞中磷原子空间堆积方式为________ ;
③磷化硼晶胞沿着体对角线方向的投影如图3所示(图中虚线圆圈表示P 原子的投影),用实线圆圈画出B 原子的投影位置(注意原子体积的相对大小)_________ 。
(1)与氯同族的第四周期元素原子的基态核外电子排布式为
(2)第一电离能介于B、F两种元素之间的第二周期元素有
(3)N2H4是火箭的燃料,与氧气的相对分子质量相同,它在常温常压下是液态,而氧气是气态,造成这种差异的主要原因是
(4)2008年,Yoon等人发现Ca与C60(分子结构如图1)生成的Ca32C60能大量吸附H2分子。1 mol C60分子中,含有σ键与π键数目之比为

(5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼可由三溴化硼和三溴化磷于高温下在氢气中反应合成。
①三溴化磷分子的空间构型是
②磷化硼晶体晶胞如图2所示:其中实心球为磷原子,在一个晶胞中磷原子空间堆积方式为
③磷化硼晶胞沿着体对角线方向的投影如图3所示(图中虚线圆圈表示P 原子的投影),用实线圆圈画出B 原子的投影位置(注意原子体积的相对大小)
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。
(1)写出B原子的电子排布式___________ 。
(2)A元素的氢化物的沸点比同主族相邻元素氢化物沸点___________ (填“高”或“低”),其原因是___________ 。
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点___________ (填“高”或“低”),其原因___________ 。
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为___________ ,简要描述该配合物中化学键的成键情况___________ 。
(5)下列分子结构图中的“ ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“•”表示没有形成共价键的最外层电子,短线表示共价键。
”表示氢原子,小黑点“•”表示没有形成共价键的最外层电子,短线表示共价键。
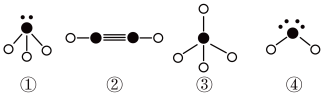
则在以上分子中,中心原子采用sp3杂化形成化学键的是___________ (填写序号);在②的分子中有___________ 个σ键和___________ 个π键。
| 元素 | A | B | C | D |
| 性质结构信息 | 原子核外两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(2)A元素的氢化物的沸点比同主族相邻元素氢化物沸点
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为
(5)下列分子结构图中的“
 ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“•”表示没有形成共价键的最外层电子,短线表示共价键。
”表示氢原子,小黑点“•”表示没有形成共价键的最外层电子,短线表示共价键。
则在以上分子中,中心原子采用sp3杂化形成化学键的是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的价电子排布式为_______ ,它位于周期表_______ 区。
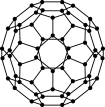
(2)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(C60)的结构如图,分子中碳原子轨道的杂化类型为_______ ;1 mol C60分子中σ键的数目为_______ 个。
(3)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓(GaAs)、硫化镉(CdS)薄膜电池等。
①第一电离能:As_______ Ga(填“>”“<”或“=”)。
②SeO2分子的空间结构为_______ 。
(4)三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,在太阳能电池制造中得到广泛应用。它可在铜的催化作用下由F2和过量的NH3反应得到,该反应中NH3的沸点_______ (填“>”“<”或“=”)PH3的沸点,NH4F固体属于_______ 晶体(填写晶体类型),写出NH3与F2反应的方程式_______ 。
(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的价电子排布式为
(2)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(C60)的结构如图,分子中碳原子轨道的杂化类型为

(3)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓(GaAs)、硫化镉(CdS)薄膜电池等。
①第一电离能:As
②SeO2分子的空间结构为
(4)三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,在太阳能电池制造中得到广泛应用。它可在铜的催化作用下由F2和过量的NH3反应得到,该反应中NH3的沸点
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】镓与ⅤA族元素形成的化合物是重要的半导体材料,应用最广泛的是砷化镓(GaAs)。回答下列问题:
(1)基态Ga原子的核外电子排布式为_______ ,基态As原子核外有_______ 个未成对电子。
(2)①比较上述镓的卤化物的熔点和沸点,分析其变化规律及原因:_______ 。
②GaF3的熔点超过1000℃,可能的原因是_______ 。
(3)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565pm,晶体的密度为_______ g·cm-3 (列出算式即可。设NA为阿伏加德罗常数的数值,已知相对原子质量:Ga-70,As-75)。
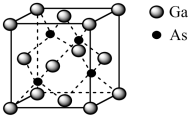
(1)基态Ga原子的核外电子排布式为
| 镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
| 熔点/℃ | 77.75 | 122.3 | 211.5 |
| 沸点/℃ | 201.2 | 279 | 346 |
②GaF3的熔点超过1000℃,可能的原因是
(3)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565pm,晶体的密度为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】柠檬酸铁铵和铁氰化钾在紫外线照射下产生普鲁士蓝(PB),可用于染色和能源行业。
(1)制备柠檬酸铁铵的原料有铁盐、氨水和柠檬酸。
①基态 的价层电子轨道表示式是
的价层电子轨道表示式是___________ 。
② 的VSEPR模型名称是
的VSEPR模型名称是___________ 。
(2)避光条件下,柠檬酸铁铵与铁氰化钾反应得到普鲁士黄(PY),其晶胞形状为立方体,结构如图所示。 均与
均与 形成配位键。结合电子式,解释
形成配位键。结合电子式,解释 在PY中作配体的原因:
在PY中作配体的原因:___________ 。
②已知PY中相邻 之间的距离为a nm,
之间的距离为a nm, 表示阿伏加德罗常数的值,PY的密度为
表示阿伏加德罗常数的值,PY的密度为___________
 (用代数式表示,
(用代数式表示, )。
)。
(3)在紫外线照射下,PY中部分 转化为
转化为 ,同时
,同时 嵌入,PY转变为PB.PB晶胞结构如图所示,其中
嵌入,PY转变为PB.PB晶胞结构如图所示,其中 周围最近且等距的
周围最近且等距的 有12个。图中“
有12个。图中“ ”位置被
”位置被 或
或 占据,用“
占据,用“ ”补全PB晶胞结构中Ⅰ和Ⅱ两个小立方体中的
”补全PB晶胞结构中Ⅰ和Ⅱ两个小立方体中的
___________ 。[PB晶胞( 未画出)]
未画出)] 能很容易地嵌入和脱嵌,因此PB可作为钾离子电池的正极材料。充电过程中,推测
能很容易地嵌入和脱嵌,因此PB可作为钾离子电池的正极材料。充电过程中,推测 会从PB中脱嵌出来,理由是
会从PB中脱嵌出来,理由是___________ 。
(1)制备柠檬酸铁铵的原料有铁盐、氨水和柠檬酸。
①基态
 的价层电子轨道表示式是
的价层电子轨道表示式是②
 的VSEPR模型名称是
的VSEPR模型名称是(2)避光条件下,柠檬酸铁铵与铁氰化钾反应得到普鲁士黄(PY),其晶胞形状为立方体,结构如图所示。
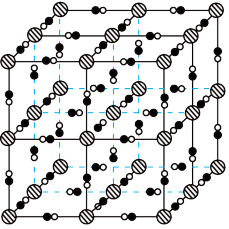
 均与
均与 形成配位键。结合电子式,解释
形成配位键。结合电子式,解释 在PY中作配体的原因:
在PY中作配体的原因:②已知PY中相邻
 之间的距离为a nm,
之间的距离为a nm, 表示阿伏加德罗常数的值,PY的密度为
表示阿伏加德罗常数的值,PY的密度为 (用代数式表示,
(用代数式表示,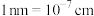 )。
)。(3)在紫外线照射下,PY中部分
 转化为
转化为 ,同时
,同时 嵌入,PY转变为PB.PB晶胞结构如图所示,其中
嵌入,PY转变为PB.PB晶胞结构如图所示,其中 周围最近且等距的
周围最近且等距的 有12个。图中“
有12个。图中“ ”位置被
”位置被 或
或 占据,用“
占据,用“ ”补全PB晶胞结构中Ⅰ和Ⅱ两个小立方体中的
”补全PB晶胞结构中Ⅰ和Ⅱ两个小立方体中的
 未画出)]
未画出)]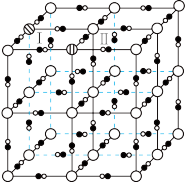
 能很容易地嵌入和脱嵌,因此PB可作为钾离子电池的正极材料。充电过程中,推测
能很容易地嵌入和脱嵌,因此PB可作为钾离子电池的正极材料。充电过程中,推测 会从PB中脱嵌出来,理由是
会从PB中脱嵌出来,理由是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】A,B,C,D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型:C,D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是_______ (填元素符号)
(2)单质A有两种同素异形体,其中沸点高的是_______ (填分子式),原因是_______ ;
(3)C和D反应可生成组成比为1∶3的化合物E,E的立体构型为_______ ,中心原子的杂化轨道类型为_______ 。
(4)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为_______ ;晶胞中A原子的配位数为_______ ;列式计算晶体F的密度(g·cm-3)_______ 。

(1)四种元素中电负性最大的是
(2)单质A有两种同素异形体,其中沸点高的是
(3)C和D反应可生成组成比为1∶3的化合物E,E的立体构型为
(4)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为

您最近一年使用:0次



