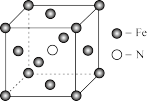
四种常见元素的性质或结构信息如下表。试根据信息回答有关问题。
(1)写出B原子的电子排布式___________ 。
(2)A元素的氢化物的沸点比同主族相邻元素氢化物沸点___________ (填“高”或“低”),其原因是___________ 。
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点___________ (填“高”或“低”),其原因___________ 。
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为___________ ,简要描述该配合物中化学键的成键情况___________ 。
(5)下列分子结构图中的“ ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“•”表示没有形成共价键的最外层电子,短线表示共价键。
”表示氢原子,小黑点“•”表示没有形成共价键的最外层电子,短线表示共价键。
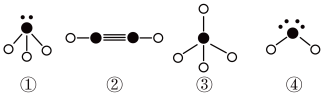
则在以上分子中,中心原子采用sp3杂化形成化学键的是___________ (填写序号);在②的分子中有___________ 个σ键和___________ 个π键。
| 元素 | A | B | C | D |
| 性质结构信息 | 原子核外两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(2)A元素的氢化物的沸点比同主族相邻元素氢化物沸点
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为
(5)下列分子结构图中的“
 ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“•”表示没有形成共价键的最外层电子,短线表示共价键。
”表示氢原子,小黑点“•”表示没有形成共价键的最外层电子,短线表示共价键。
则在以上分子中,中心原子采用sp3杂化形成化学键的是
更新时间:2021-07-12 07:43:46
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】氧化钪( )在合金、电光源、催化剂和陶瓷等领域有广泛应用,以钪锰矿石(含
)在合金、电光源、催化剂和陶瓷等领域有广泛应用,以钪锰矿石(含 、
、 、
、 、
、 、CaO、FeO)为原料制备氧化钪的一种工艺流程如图所示。
、CaO、FeO)为原料制备氧化钪的一种工艺流程如图所示。
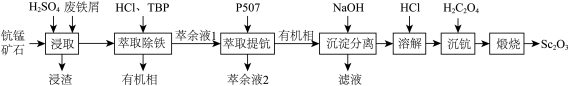
已知:①TBP和P507均为有机萃取剂:②常温下,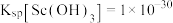 ;③草酸可与多种金属离子形成可溶性络合物。回答下列问题:
;③草酸可与多种金属离子形成可溶性络合物。回答下列问题:
(1)钪锰矿石中含铁元素,则基态Fe的价电子排布式为___________ 。
(2)“浸取”时铁屑被 氧化为
氧化为 ,该反应的离子方程是
,该反应的离子方程是___________ 。
(3)常温下,“沉淀分离”时加入NaOH溶液调节pH至6,滤液中 的浓度为
的浓度为___________ 。
(4)已知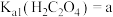 ,
,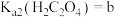 ,
,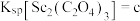 。“沉钪”时,发生反应
。“沉钪”时,发生反应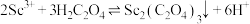 ,此反应的平衡常数K=
,此反应的平衡常数K=___________ (用含a、b、c的代数式表示)。反应过程中,草酸用量过多时,钪的沉淀率下降,原因可能是___________ 。
(5)草酸钪晶体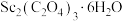 :在空气中加热,
:在空气中加热, 随温度的变化情况如图所示。250℃时,晶体的主要成分是
随温度的变化情况如图所示。250℃时,晶体的主要成分是___________ (填化学式)。550~850℃发生反应的化学方程式为___________ 。

 )在合金、电光源、催化剂和陶瓷等领域有广泛应用,以钪锰矿石(含
)在合金、电光源、催化剂和陶瓷等领域有广泛应用,以钪锰矿石(含 、
、 、
、 、
、 、CaO、FeO)为原料制备氧化钪的一种工艺流程如图所示。
、CaO、FeO)为原料制备氧化钪的一种工艺流程如图所示。
已知:①TBP和P507均为有机萃取剂:②常温下,
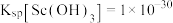 ;③草酸可与多种金属离子形成可溶性络合物。回答下列问题:
;③草酸可与多种金属离子形成可溶性络合物。回答下列问题:(1)钪锰矿石中含铁元素,则基态Fe的价电子排布式为
(2)“浸取”时铁屑被
 氧化为
氧化为 ,该反应的离子方程是
,该反应的离子方程是(3)常温下,“沉淀分离”时加入NaOH溶液调节pH至6,滤液中
 的浓度为
的浓度为(4)已知
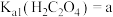 ,
,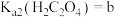 ,
,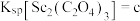 。“沉钪”时,发生反应
。“沉钪”时,发生反应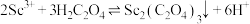 ,此反应的平衡常数K=
,此反应的平衡常数K=(5)草酸钪晶体
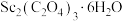 :在空气中加热,
:在空气中加热, 随温度的变化情况如图所示。250℃时,晶体的主要成分是
随温度的变化情况如图所示。250℃时,晶体的主要成分是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】磷及其化合物有许多用途。回答下列问题:
(1)基态磷原子核外共有_______ 种不同空间运动状态的电子,核外电子占据最高能层的符号是_______ ,占据该能层电子的能级最高的电子云轮廓图为_______ 形。
(2) 为三元中强酸,与
为三元中强酸,与 形成
形成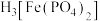 ,此性质常用于掩蔽溶液中的
,此性质常用于掩蔽溶液中的 。基态
。基态 价层电子的电子排布式为
价层电子的电子排布式为_______ ,该配合物中的配体是_______ ,1mol该配合物中含有_______ mol配位键。
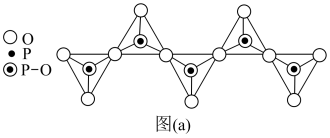
(3)磷酸盐分为直链多磷酸盐、支链状超磷酸盐和环状聚偏磷酸盐三类。某直链多磷酸钠的阴离子呈如图(a)所示的无限单链状结构,其中磷氧四面体通过共用顶角氧原子相连。该多磷酸钠中,磷、氧原子个数比为_______ 。
(1)基态磷原子核外共有
(2)
 为三元中强酸,与
为三元中强酸,与 形成
形成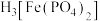 ,此性质常用于掩蔽溶液中的
,此性质常用于掩蔽溶液中的 。基态
。基态 价层电子的电子排布式为
价层电子的电子排布式为(3)磷酸盐分为直链多磷酸盐、支链状超磷酸盐和环状聚偏磷酸盐三类。某直链多磷酸钠的阴离子呈如图(a)所示的无限单链状结构,其中磷氧四面体通过共用顶角氧原子相连。该多磷酸钠中,磷、氧原子个数比为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】为了实现“将全球温度上升控制在2℃以内”,科学家正在研究温室气体CH4和CO2的转化和利用。
(1)下列说法正确的是__________ (填序号)。
(2)CH4和CO2在Ni催化作用下反应可获得化工原料CO和H2。
①Ni基态原子核外电子排布式为__________ 。
②与CO互为等电子体的阴离子的电子式为__________ ,Ni能与CO形成正四面体形的配合物Ni(CO)4,1 mol Ni(CO)4中含有σ键的数目为__________ 。
(3)CH4和CO2在含有钛氧化物的某种催化剂作用下,可直接转化为CH3COOH。
①CH3COOH中C原子轨道杂化类型为__________ ;
②钛氧化物晶胞结构如图所示,写出其化学式:__________ 。

(1)下列说法正确的是
| A.CH4与CO2分子均为含有极性共价键的非极性分子 | B.第一电离能:O>N>C |
| C.沸点高低:CH4>SnH4>GeH4>SiH4 | D.CH 离子的空间构型为平面正三角形 离子的空间构型为平面正三角形 |
①Ni基态原子核外电子排布式为
②与CO互为等电子体的阴离子的电子式为
(3)CH4和CO2在含有钛氧化物的某种催化剂作用下,可直接转化为CH3COOH。
①CH3COOH中C原子轨道杂化类型为
②钛氧化物晶胞结构如图所示,写出其化学式:

您最近一年使用:0次
【推荐1】原子序数依次递增且都小于36的A、B、C、D、E五种元素,其中A的一种核素中没有中子,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E元素的原子结构中3d能级上未成对电子数是成对电子数的2倍.回答下列问题:

(1)B2A4分子中B原子轨道的杂化类型为________ ,B2A4分子中σ键和π键个数比为________
(2)A、B、C、D四种元素的电负性从大到小的顺序为________ (用元素符号表示);化合物CA3的沸点比化合物BA4的高,其主要原因是________
(3)元素B的一种氧化物与元素C的一种氧化物互为等电子体,元素C的这种氧化物的分子式是________
(4)元素E能形成多种配合物,如:E(CO)5等.
①基态E原子的价电子排布式为________ .
②E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断E(CO)5晶体属于________ (填晶体类型),该晶体中E的化合价为________

(1)B2A4分子中B原子轨道的杂化类型为
(2)A、B、C、D四种元素的电负性从大到小的顺序为
(3)元素B的一种氧化物与元素C的一种氧化物互为等电子体,元素C的这种氧化物的分子式是
(4)元素E能形成多种配合物,如:E(CO)5等.
①基态E原子的价电子排布式为
②E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断E(CO)5晶体属于
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】Fe、Cu为过渡金属元素,它们在工业生产中都有重要的应用。回答下列问题:
(1)将乙醇蒸气通过赤热的氧化铜粉末,会发生反应: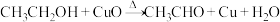
①有同学书写基态碳原子的核外电子排布图为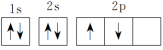 ,这样的书写不正确,违背了
,这样的书写不正确,违背了___________ 。
②乙醛和乙醇的相对分子质量相差2,但是,乙醇的沸点高于乙醛,其主要原因是___________ 。
(2)Fe、 都能被硝酸氧化。
都能被硝酸氧化。 中氮原子轨道的杂化类型为
中氮原子轨道的杂化类型为___________ 。
(3)研究发现,阳离子的颜色与未成对电子数有关。例如: 、
、 、
、 等。
等。 呈无色,其原因是
呈无色,其原因是___________ 。
(1)将乙醇蒸气通过赤热的氧化铜粉末,会发生反应:
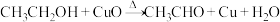
①有同学书写基态碳原子的核外电子排布图为
 ,这样的书写不正确,违背了
,这样的书写不正确,违背了②乙醛和乙醇的相对分子质量相差2,但是,乙醇的沸点高于乙醛,其主要原因是
(2)Fe、
 都能被硝酸氧化。
都能被硝酸氧化。 中氮原子轨道的杂化类型为
中氮原子轨道的杂化类型为(3)研究发现,阳离子的颜色与未成对电子数有关。例如:
 、
、 、
、 等。
等。 呈无色,其原因是
呈无色,其原因是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】硼化钒(VB2)一空气电池是目前储电能力最高的电池之一,该电池工作时的反应为4VB2+11O2=4B2O3+2V2O5。回答下列问题:
(1)基态B原子电子占据最高能级的电子云轮廓图为___ 形。钒有+2、+3、+4、+5等几种化合价,其中V3+的价电子排布图为__ 。
(2)在第二周期中第一电离能介于B和O两种元素之间的元素有__ (填元素符号)。
(3)V2O5常用作SO2转化为SO3的催化剂:SO2分子中键角___ (填“>”“<”或“=”)120°,原因是__ ;SO3的三聚体环状结构如图所示,该分子中含有___ 个σ键。S原子的杂化方式为___ 。

(4)钒(II)与H2O形成[V(H2O)6]2+配离子过程中, 下列描述不合理的是__ (填序号)。
a.提供孤电子对的成键原子是氧原子
b.微粒的化学性质发生了改变
c.微粒中氢氧键(H-O)的夹角未发生改变
d.在[V(H2O)6]2+中存在的化学键有配位键、σ键、π键和氢键
(5)某六方硫钒化合物晶体的晶胞如图甲所示,该晶胞的化学式为___ 。图乙为该晶胞俯视图,该晶胞的密度为__ g·cm-3(NA为阿伏加 德罗常数的数值,列出计算式即可)。

(1)基态B原子电子占据最高能级的电子云轮廓图为
(2)在第二周期中第一电离能介于B和O两种元素之间的元素有
(3)V2O5常用作SO2转化为SO3的催化剂:SO2分子中键角

(4)钒(II)与H2O形成[V(H2O)6]2+配离子过程中, 下列描述不合理的是
a.提供孤电子对的成键原子是氧原子
b.微粒的化学性质发生了改变
c.微粒中氢氧键(H-O)的夹角未发生改变
d.在[V(H2O)6]2+中存在的化学键有配位键、σ键、π键和氢键
(5)某六方硫钒化合物晶体的晶胞如图甲所示,该晶胞的化学式为

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】实验小组研究硫酸四氨合铜(II)([Cu(NH3)4]SO4·H2O)晶体的制备。
[实验一]制备[Cu(NH3)4]SO4溶液
甲:向2 mol/L CuSO4溶液中滴加NaOH溶液,产生蓝色沉淀,再向所得浊液(标记为浊液a)中加入过量6mol/L氨水,沉淀不溶解。
乙:向2mol/LCuSO4溶液中滴加6mol/L氨水,产生蓝色沉淀,再向浊液中继续滴加过量6mol/L氨水,沉淀溶解,得到深蓝色溶液。
(1)画出四氨合铜配离子中的配位键:_______ 。
(2)甲中,生成蓝色沉淀的离子方程式是_______ 。
(3)研究甲、乙中现象不同的原因。
[提出猜测]
i.Na+可能影响[Cu(NH3)4]2+的生成。
ii. 促进了[Cu(NH3)4]2+的生成。
促进了[Cu(NH3)4]2+的生成。
[进行实验]
①将浊液a过滤,洗涤沉淀,把所得固体分成两份。
②向其中一份加入过量6 mol/L氨水,观察到_______ , 说明猜测i不成立。
③向另一份加入过量6 mol/L氨水,再滴入几滴_______ (填试剂),沉淀溶解,得到深蓝色溶液,说明猜测ii成立。
[实验反思]
④从平衡移动的角度,结合化学用语解释为什么 能促进[Cu(NH3)4]2+的生成:
能促进[Cu(NH3)4]2+的生成:_______ 。
[实验二]制备硫酸四氨合铜晶体
资料:
i.[Cu(NH3)4]SO4·H2O受热易分解;
ii. [Cu(NH3)4]SO4·H2O在乙醇-水的混合溶剂中溶解度随乙醇体积分数的变化如下图所示。
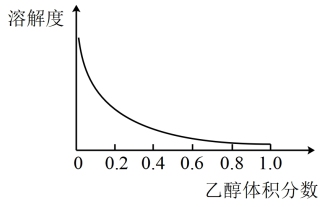
用蒸发、结晶的方法从乙所得深蓝色溶液中获得的晶体中往往含有Cu(OH)2、Cu2(OH)2SO4等杂质。
(4)结合,上述信息分析,从乙所得深蓝色溶液中获得较多晶体[Cu(NH3)4]SO4·H2O的措施是_______ (写出两条即可)。
[实验一]制备[Cu(NH3)4]SO4溶液
甲:向2 mol/L CuSO4溶液中滴加NaOH溶液,产生蓝色沉淀,再向所得浊液(标记为浊液a)中加入过量6mol/L氨水,沉淀不溶解。
乙:向2mol/LCuSO4溶液中滴加6mol/L氨水,产生蓝色沉淀,再向浊液中继续滴加过量6mol/L氨水,沉淀溶解,得到深蓝色溶液。
(1)画出四氨合铜配离子中的配位键:
(2)甲中,生成蓝色沉淀的离子方程式是
(3)研究甲、乙中现象不同的原因。
[提出猜测]
i.Na+可能影响[Cu(NH3)4]2+的生成。
ii.
 促进了[Cu(NH3)4]2+的生成。
促进了[Cu(NH3)4]2+的生成。[进行实验]
①将浊液a过滤,洗涤沉淀,把所得固体分成两份。
②向其中一份加入过量6 mol/L氨水,观察到
③向另一份加入过量6 mol/L氨水,再滴入几滴
[实验反思]
④从平衡移动的角度,结合化学用语解释为什么
 能促进[Cu(NH3)4]2+的生成:
能促进[Cu(NH3)4]2+的生成:[实验二]制备硫酸四氨合铜晶体
资料:
i.[Cu(NH3)4]SO4·H2O受热易分解;
ii. [Cu(NH3)4]SO4·H2O在乙醇-水的混合溶剂中溶解度随乙醇体积分数的变化如下图所示。

用蒸发、结晶的方法从乙所得深蓝色溶液中获得的晶体中往往含有Cu(OH)2、Cu2(OH)2SO4等杂质。
(4)结合,上述信息分析,从乙所得深蓝色溶液中获得较多晶体[Cu(NH3)4]SO4·H2O的措施是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐2】已知A、B、C、D、E都是周期表中前四周期的元素,它们的原子序数依次增大。其中A元素原子的核外p电子数比s电子数少1。C是电负性最大的元素。D原子次外层电子数是最外层电子数2倍,E是第Ⅷ族中原子序数最小的元素。
(1)写出基态C原子的电子排布式_________________ 。
(2)A、B两种元素的第一电离能由大到小的顺序为______________ (用元素符号表示),原因是___________________ 。
(3)已知DC4常温下为气体,则该物质的晶体类型是_________ ,组成微粒的中心原子的轨道杂化类型为____________ ,空间构型是___________ 。
(4)Cu2+容易与AH3形成配离子[Cu(AH3)4]2+,但AC3不易与Cu2+形成配离子,其原因是______________________ 。
(5)A、B两元素分别与D形成的共价键中,极性较强的是__________ 。A、B两元素间能形成多种二元化合物,其中与A3—互为等电子体的物质的化学式为__________ 。
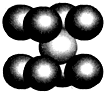
(6)已知E单质的晶胞如图所示,则晶体中E原子的配位数为__________ ,一个E的晶胞质量为___________ 。
(1)写出基态C原子的电子排布式
(2)A、B两种元素的第一电离能由大到小的顺序为
(3)已知DC4常温下为气体,则该物质的晶体类型是
(4)Cu2+容易与AH3形成配离子[Cu(AH3)4]2+,但AC3不易与Cu2+形成配离子,其原因是
(5)A、B两元素分别与D形成的共价键中,极性较强的是
(6)已知E单质的晶胞如图所示,则晶体中E原子的配位数为

您最近一年使用:0次
【推荐3】人类文明的发展历程,也是化学物质的认识和发现的历程。
(1)铜原子在基态时价电子(外围电子)排布式为_______ 。已知高温下Cu2O比CuO更稳定,试从核外电子排布的角度解释:_______ 。
(2)铜与类卤素(SCN)2反应生成Cu(SCN)2,类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是_______ 。每个硫氰酸(H-S-C≡N)分子中都包含_______ 个σ键,_______ 个π键。
(3)BF3与一定量的水可形成如图所示晶体R晶体R中各种微粒间的作用力涉及_______ (填字母代号),
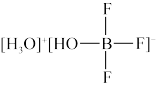
a.离子键 b.共价键 c.配位键 d.金属键 e.范德华力
(4)C、N、O元素原子的第一电离能由大到小的顺序为_______ ;已知第三电离能数据: ,
,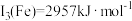 ,锰的第三电离能大于铁的第三电离能,其主要原因是
,锰的第三电离能大于铁的第三电离能,其主要原因是_______ 。
(5)铁和氨在640℃可发生置换反应,产物之一的立方晶胞结构如图所示,写出该反应的化学方程式:_______ 。
(1)铜原子在基态时价电子(外围电子)排布式为
(2)铜与类卤素(SCN)2反应生成Cu(SCN)2,类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是
(3)BF3与一定量的水可形成如图所示晶体R晶体R中各种微粒间的作用力涉及

a.离子键 b.共价键 c.配位键 d.金属键 e.范德华力
(4)C、N、O元素原子的第一电离能由大到小的顺序为
 ,
, ,锰的第三电离能大于铁的第三电离能,其主要原因是
,锰的第三电离能大于铁的第三电离能,其主要原因是(5)铁和氨在640℃可发生置换反应,产物之一的立方晶胞结构如图所示,写出该反应的化学方程式:

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】下表是元素周期表的一部分。表中所列的字母分别代表一种元素。
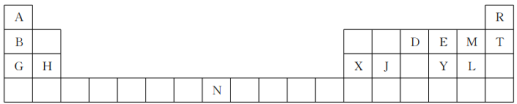
回答下列问题:
(1)请写出H的单质与二氧化碳反应的方程式:_______ 。
(2)D的简单气态氢化物的VSEPR模型为_______ ,分子的空间结构为_______ 。
(3)第一电离能H_______ X(填“>”“<”或“=”),其原因是_______ 。
(4)电负性E_______ M(填“>”“<”或“=”)。
(5)D2E的沸点比DA3的沸点低,其原因是_______ 。

回答下列问题:
(1)请写出H的单质与二氧化碳反应的方程式:
(2)D的简单气态氢化物的VSEPR模型为
(3)第一电离能H
(4)电负性E
(5)D2E的沸点比DA3的沸点低,其原因是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】我国科学家研发的全球首套千吨级太阳能燃料合成项目,为实现“碳中和”目标作出了重大贡献。该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。
(1)钙钛矿( )型化合物是一类可用于生产太阳能电池的功能材料,
)型化合物是一类可用于生产太阳能电池的功能材料, 的晶胞如图所示。
的晶胞如图所示。
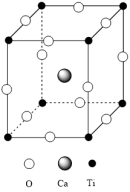
①基态 原子的核外电子排布式为
原子的核外电子排布式为_______ 。
② 组成元素的电负性大小顺序是
组成元素的电负性大小顺序是_______ ;一个晶胞中含_______ O2-。
(2)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是_______ 。
(3)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为 固溶体。在
固溶体。在 中掺杂少量
中掺杂少量 后形成的催化剂,化学式可表示为
后形成的催化剂,化学式可表示为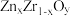 ,则y=
,则y=_______ (用含x的表达式)。
(1)钙钛矿(
 )型化合物是一类可用于生产太阳能电池的功能材料,
)型化合物是一类可用于生产太阳能电池的功能材料, 的晶胞如图所示。
的晶胞如图所示。
①基态
 原子的核外电子排布式为
原子的核外电子排布式为②
 组成元素的电负性大小顺序是
组成元素的电负性大小顺序是(2)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是
(3)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为
 固溶体。在
固溶体。在 中掺杂少量
中掺杂少量 后形成的催化剂,化学式可表示为
后形成的催化剂,化学式可表示为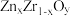 ,则y=
,则y=
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐3】铁及其化合物在生活、生产中有重要应用。回答下列问题:
(1)乳酸亚铁 是一种常用的补铁剂。
是一种常用的补铁剂。
① 的价电子排布图为
的价电子排布图为___________ 。 可用于治疗急性心率衰竭。
可用于治疗急性心率衰竭。
①硝普钠中 的配位数为
的配位数为___________ 。
②硝普钠中不存在的化学键有___________ (填序号)。
a.离子键 b.金属键 c. 配位键 d.极性共价键
(3)咔唑 (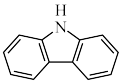 ),)用于制备靶向Fe2+荧光探针,咔唑沸点比
),)用于制备靶向Fe2+荧光探针,咔唑沸点比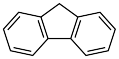 高的主要原因是
高的主要原因是___________ ,咔唑分子中所有原子共平面,咔唑与  都能与
都能与  配位,配位能力: 咔唑
配位,配位能力: 咔唑___________ 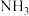 (填"> "、"<"、"=")。
(填"> "、"<"、"=")。
(4)由铁、钾、硒形成的一种超导材料,其晶胞结构和xy平面投影如图所示。___________ 。
②该晶胞参数分别为 a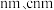 ,该晶体密度
,该晶体密度
___________ 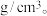 ( 用
( 用  表示阿伏加德罗常数 )
表示阿伏加德罗常数 )
(1)乳酸亚铁
 是一种常用的补铁剂。
是一种常用的补铁剂。①
 的价电子排布图为
的价电子排布图为②乳酸分子( )中
)中  键与
键与  键的数目之比为
键的数目之比为
 可用于治疗急性心率衰竭。
可用于治疗急性心率衰竭。①硝普钠中
 的配位数为
的配位数为②硝普钠中不存在的化学键有
a.离子键 b.金属键 c. 配位键 d.极性共价键
(3)咔唑 (
 ),)用于制备靶向Fe2+荧光探针,咔唑沸点比
),)用于制备靶向Fe2+荧光探针,咔唑沸点比 高的主要原因是
高的主要原因是 都能与
都能与  配位,配位能力: 咔唑
配位,配位能力: 咔唑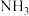 (填"> "、"<"、"=")。
(填"> "、"<"、"=")。(4)由铁、钾、硒形成的一种超导材料,其晶胞结构和xy平面投影如图所示。

②该晶胞参数分别为 a
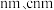 ,该晶体密度
,该晶体密度
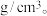 ( 用
( 用  表示阿伏加德罗常数 )
表示阿伏加德罗常数 )
您最近一年使用:0次



