非金属元素数量虽少,却构成了丰富的物质世界,大部分非金属元素分布在元素周期表的p区。回答下列问题:
(1)基态Cl原子的价电子排布式为_______ ,该价层电子中,两种自旋状态的电子数之比为_______ 。
(2)徐光宪在《分子共和国》一书中介绍了许多明星分子,如H2O2、CO2、BF3、CH3COOH等。
①CO2的键角_______ (填“>”“<”或“=”) BF3的键角。
②CH3COOH分子中碳原子的杂化类型为_______ 。
③BF3与一定量水形成晶体Q,Q在一定条件下可转化为R。晶体Q中涉及的化学键类型有_______ (填字母);R中阳离子的空间构型为_______ 。
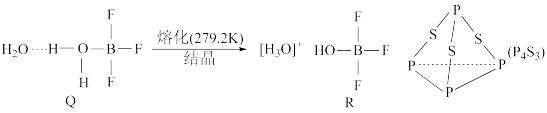
a.离子键 b.共价键 c.配位键 d.氢键
(3)三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如图所示。第一电离能:P_______ (填“>”“<”,或“=”)S,1 mol P4S3分子中含有_______ mol共价键。
(4)化合物K2SeBr6的晶胞结构如图1,沿x、y、z轴方向的投影均力图2,若晶胞参数为a nm,则K2SeBr6晶体密度为_______  (列出计算式,NA为阿伏加德罗常数的值)。
(列出计算式,NA为阿伏加德罗常数的值)。

(1)基态Cl原子的价电子排布式为
(2)徐光宪在《分子共和国》一书中介绍了许多明星分子,如H2O2、CO2、BF3、CH3COOH等。
①CO2的键角
②CH3COOH分子中碳原子的杂化类型为
③BF3与一定量水形成晶体Q,Q在一定条件下可转化为R。晶体Q中涉及的化学键类型有
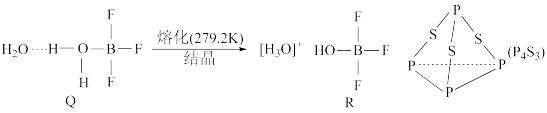
a.离子键 b.共价键 c.配位键 d.氢键
(3)三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如图所示。第一电离能:P
(4)化合物K2SeBr6的晶胞结构如图1,沿x、y、z轴方向的投影均力图2,若晶胞参数为a nm,则K2SeBr6晶体密度为
 (列出计算式,NA为阿伏加德罗常数的值)。
(列出计算式,NA为阿伏加德罗常数的值)。
更新时间:2022-08-28 21:13:32
|
相似题推荐
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】三乙酸锰可作单电子氧化剂,用如下反应可以制取三乙酸锰:4Mn(NO3)2·6H2O+26(CH3CO)2O=4(CH3COO)3Mn+8HNO2+3O2↑+40CH3COOH。
(1)基态锰原子的价层电子排布式为___ 。
(2)CH3COOH中碳原子的杂化形式为___ 。
(3)NO3-的空间构型是___ ,与NO3-互为等电子体的分子的化学式为___ (任写一种)。
(4)某种镁铝合金可作为储钠材料,该合金晶胞结构如图所示,晶胞棱长为anm,晶体中每个镁原子周围距离最近的铝原子数目为___ ,该晶体的密度为___ g/cm3(阿伏加 德罗常数的数值用NA表示)。
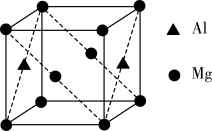
(1)基态锰原子的价层电子排布式为
(2)CH3COOH中碳原子的杂化形式为
(3)NO3-的空间构型是
(4)某种镁铝合金可作为储钠材料,该合金晶胞结构如图所示,晶胞棱长为anm,晶体中每个镁原子周围距离最近的铝原子数目为

您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】X、Y、Z、Q、R五种元素的原子序数依次增大.其中:X的最外层电子排布为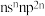 ;Y是元素周期表中电负性最大的元素;Y、Z位于同一主族;Q基态原子核外的M能层中有两个未成对电子和三个空轨道;R位于第四周期ⅥB族。
;Y是元素周期表中电负性最大的元素;Y、Z位于同一主族;Q基态原子核外的M能层中有两个未成对电子和三个空轨道;R位于第四周期ⅥB族。
请回答下列问题:
 元素基态原子的电子排布式为
元素基态原子的电子排布式为 ______ ,它的最高价氧化物的水化物的化学式为 ______ 。
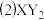 分子的立体构型是
分子的立体构型是 ______ ,中心原子的杂化方式是 ______ 。
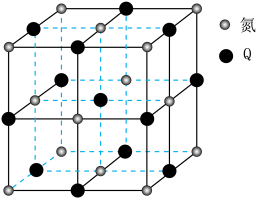
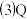 与氮元素形成的一种化合物晶胞如图所示,该化合物的化学式为
与氮元素形成的一种化合物晶胞如图所示,该化合物的化学式为 ______ 。该晶体中与氮原子距离相等且最近的氮原子有 ______ 个。
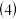 化合物
化合物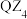 熔点为
熔点为 ,沸点为
,沸点为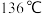 ,熔融态不导电,可知
,熔融态不导电,可知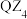 的晶体类型是
的晶体类型是 ______ 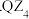 与热水反应的化学方程式为
与热水反应的化学方程式为 ______ 。
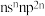 ;Y是元素周期表中电负性最大的元素;Y、Z位于同一主族;Q基态原子核外的M能层中有两个未成对电子和三个空轨道;R位于第四周期ⅥB族。
;Y是元素周期表中电负性最大的元素;Y、Z位于同一主族;Q基态原子核外的M能层中有两个未成对电子和三个空轨道;R位于第四周期ⅥB族。请回答下列问题:
 元素基态原子的电子排布式为
元素基态原子的电子排布式为 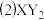 分子的立体构型是
分子的立体构型是 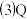 与氮元素形成的一种化合物晶胞如图所示,该化合物的化学式为
与氮元素形成的一种化合物晶胞如图所示,该化合物的化学式为 
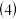 化合物
化合物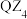 熔点为
熔点为 ,沸点为
,沸点为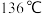 ,熔融态不导电,可知
,熔融态不导电,可知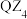 的晶体类型是
的晶体类型是 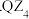 与热水反应的化学方程式为
与热水反应的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】分铜液净化渣主要含铜、碲(Te)、锑(Sb)、砷(As)等元素的化合物,一种回收工艺流程如图所示。

已知:①“碱浸”时,铜、锑转化为难溶氢氧化物或氧化物,碱浸液含有Na2TeO3、Na3AsO4。
②“酸浸”时,锑元素反应生成难溶的Sb2O(SO4)4浸渣。
③查阅资料得知:离子晶体的熔点一般较高,在600~2000℃,共价晶体具有较高的熔点,一般在1000℃以上。
回答下列问题:
(1)基态As的价层电子轨道表示式为_______ 。
(2)“碱浸”时,TeO2与NaOH反应的离子方程式为______ 。
(3)向碱浸液中加盐酸调节pH=4,有TeO2析出,分离TeO2,滤液中As元素最主要的存在形式为_______ (常温下,H3AsO4的各级电离常数:Ka1=6.3×10-3、Ka2=1.0×10-7、Ka3=3.2×10-12,填字母)。
(4)“氯盐酸浸”时,通入SO2的目的是_______ 。
(5)“水解”时,生成SbOCl的化学方程式为_______ 。
(6)TeO2可用作电子元件材料,熔点为733℃,其熔点远高于SO2的原因为______ 。TeO2晶胞是长方体结构(如图所示),已知NA为阿伏加德罗常数的值,则该晶体的密度为______ g•cm-3(列出计算表达式)。


已知:①“碱浸”时,铜、锑转化为难溶氢氧化物或氧化物,碱浸液含有Na2TeO3、Na3AsO4。
②“酸浸”时,锑元素反应生成难溶的Sb2O(SO4)4浸渣。
③查阅资料得知:离子晶体的熔点一般较高,在600~2000℃,共价晶体具有较高的熔点,一般在1000℃以上。
回答下列问题:
(1)基态As的价层电子轨道表示式为
(2)“碱浸”时,TeO2与NaOH反应的离子方程式为
(3)向碱浸液中加盐酸调节pH=4,有TeO2析出,分离TeO2,滤液中As元素最主要的存在形式为
| A.H3AsO4 | B.H2As | C.HAsO | D.AsO |
(4)“氯盐酸浸”时,通入SO2的目的是
(5)“水解”时,生成SbOCl的化学方程式为
(6)TeO2可用作电子元件材料,熔点为733℃,其熔点远高于SO2的原因为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐1】锂盐二氟草酸硼酸锂[LiBF2(C2O4)]是新型锂离子电池电解质,乙酸锰可用于制造离子电池的负极材料。合成方法如下:
2H2C2O4+SiCl4+2LiBF4=2LiBF2(C2O4)+SiF4+4HCl
4Mn(NO3)2•6H2O+26(CH3CO)2O=4(CH3COO)3Mn+8HNO2+3O2↑+40CH3COOH
(1)Mn3+基态核外电子排布式为_____ 。
(2)草酸(HOOCCOOH)分子中碳原子轨道的杂化类型是_______ ,1mol草酸分子中含有σ键的数目为______ 。
(3)与SiF4互为等电子体的阴离子的化学式为______ 。
(4)CH3COOH易溶于水,除了它是极性分子外,还因为_______ 。
(5)锰的一种晶胞结构如图所示,锰晶体中每个锰原子距离最近的锰原子数目为______ 。

2H2C2O4+SiCl4+2LiBF4=2LiBF2(C2O4)+SiF4+4HCl
4Mn(NO3)2•6H2O+26(CH3CO)2O=4(CH3COO)3Mn+8HNO2+3O2↑+40CH3COOH
(1)Mn3+基态核外电子排布式为
(2)草酸(HOOCCOOH)分子中碳原子轨道的杂化类型是
(3)与SiF4互为等电子体的阴离子的化学式为
(4)CH3COOH易溶于水,除了它是极性分子外,还因为
(5)锰的一种晶胞结构如图所示,锰晶体中每个锰原子距离最近的锰原子数目为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
解题方法
【推荐2】新材料技术的发展促进了信息技术和生物技术的革命,并对制造业.物资供应和个人生活方式产生了重大影响。回答下列问题:
(1)近期,PNAS报道了无规超支化聚合物RHP的自愈过程,合成RHP的基础原料为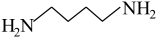 和
和 ,RHP结构表示如下(
,RHP结构表示如下(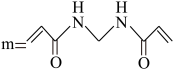 ):
):
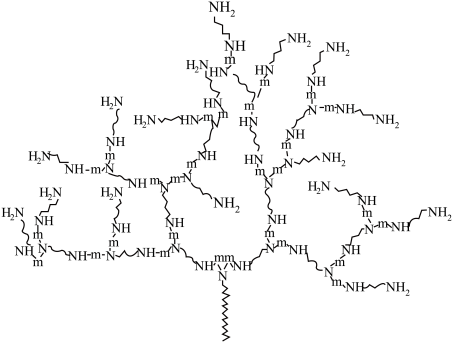
①"自愈”是指材料断裂后,再次接触使其抗拉能力部分恢复,由RHP结构推测其具有自愈能力的主要原因为_________________ 。
②沸点: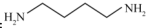
_____  (填“<”或“>”),理由为
(填“<”或“>”),理由为________________________________________ 。
③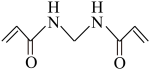 中含有各元素的电负性由小到大的顺序为
中含有各元素的电负性由小到大的顺序为______ ;该物质中,含有σ键和π键数目之比为______________________ 。
(2)纳米材料Cu—SiO2用于催化DMO和氢气反应获得EG,示意图如下:
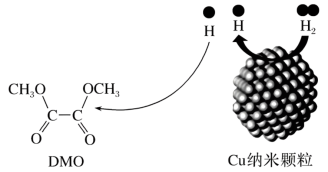
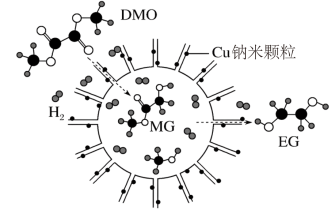
①基态铜原子的核外电子排布式为________ ,基态碳原子核外电子占据的最高能级的电子云形状为_______________ 。
②CuSCN是一种生物防腐涂料,可用CuSO4、NaSCN、Na2SO4作原料,并用EG作分散剂进行制备。与SCN-互为等电子体的分子为____ ; 中心原子的杂化方式为
中心原子的杂化方式为_____________ 。
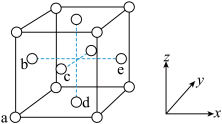
③铜的晶胞如图。它的空间利用率为______ ;原子分数坐标:a为(0,0,0);d分子坐标为( ,
, ,0),则b处的分数坐标为
,0),则b处的分数坐标为____________
(1)近期,PNAS报道了无规超支化聚合物RHP的自愈过程,合成RHP的基础原料为
 和
和 ,RHP结构表示如下(
,RHP结构表示如下( ):
):
①"自愈”是指材料断裂后,再次接触使其抗拉能力部分恢复,由RHP结构推测其具有自愈能力的主要原因为
②沸点:

 (填“<”或“>”),理由为
(填“<”或“>”),理由为③
 中含有各元素的电负性由小到大的顺序为
中含有各元素的电负性由小到大的顺序为(2)纳米材料Cu—SiO2用于催化DMO和氢气反应获得EG,示意图如下:


①基态铜原子的核外电子排布式为
②CuSCN是一种生物防腐涂料,可用CuSO4、NaSCN、Na2SO4作原料,并用EG作分散剂进行制备。与SCN-互为等电子体的分子为
 中心原子的杂化方式为
中心原子的杂化方式为③铜的晶胞如图。它的空间利用率为
 ,
, ,0),则b处的分数坐标为
,0),则b处的分数坐标为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】A,B,C,D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型:C,D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是_______ (填元素符号)
(2)单质A有两种同素异形体,其中沸点高的是_______ (填分子式),原因是_______ ;
(3)C和D反应可生成组成比为1∶3的化合物E,E的立体构型为_______ ,中心原子的杂化轨道类型为_______ 。
(4)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为_______ ;晶胞中A原子的配位数为_______ ;列式计算晶体F的密度(g·cm-3)_______ 。

(1)四种元素中电负性最大的是
(2)单质A有两种同素异形体,其中沸点高的是
(3)C和D反应可生成组成比为1∶3的化合物E,E的立体构型为
(4)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】科学家在钙钛矿型电池(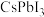 )中添加离子液体HMImCl(
)中添加离子液体HMImCl(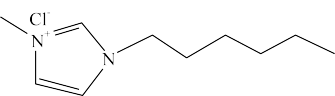 )可防止水进入电池,以提高电池工作寿命。相关物质结构示意如图。
)可防止水进入电池,以提高电池工作寿命。相关物质结构示意如图。
(1)Pb位干第6周期ⅣA族,基态Pb原子的价电子轨道表示式为_______ 。

(2)HMImCl中碳原子的杂化方式为_______ 。
(3)HMImCl中存在的化学键有_______(填标号)。
(4)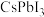 晶胞结构示意如图。Cs的配位数为
晶胞结构示意如图。Cs的配位数为_______ 。
(5)已知 的配位数最多可达12,
的配位数最多可达12, 五元环一端能靠近
五元环一端能靠近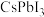 的原因是
的原因是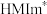 与
与_______ 形成静电作用; 与
与_______ 原子的孤对电子配位。
(6)添加HMImCl后,可防止水进入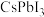 的原因是
的原因是_______ 。
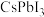 )中添加离子液体HMImCl(
)中添加离子液体HMImCl( )可防止水进入电池,以提高电池工作寿命。相关物质结构示意如图。
)可防止水进入电池,以提高电池工作寿命。相关物质结构示意如图。(1)Pb位干第6周期ⅣA族,基态Pb原子的价电子轨道表示式为

(2)HMImCl中碳原子的杂化方式为
(3)HMImCl中存在的化学键有_______(填标号)。
| A.离子键 | B.π键 | C.σ键 | D.氢键 |
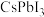 晶胞结构示意如图。Cs的配位数为
晶胞结构示意如图。Cs的配位数为(5)已知
 的配位数最多可达12,
的配位数最多可达12,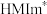 五元环一端能靠近
五元环一端能靠近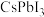 的原因是
的原因是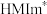 与
与 与
与(6)添加HMImCl后,可防止水进入
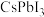 的原因是
的原因是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】元素A~D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题。
(1)A与Cl形成的化合物为__________ (填“离子”或“共价”)化合物,含有__________ 键。
(2)D和C形成的化合物中含有__________ 键。写出C单质与水反应的化学方程式:____________________ 。
(3)下列对元素B及元素B的常见单质描述正确的是__________ (填序号)。
a.B元素的最高正价为+6
b.常温、常压下B的常见单质难溶于水
c.B的常见单质分子中含有18个电子
d.在一定条件下镁条能与B的常见单质反应
(4)若B与H能形成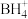 ,则B为
,则B为__________ 元素,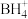 中含有的化学键为
中含有的化学键为__________ 。
(5)A和D两元素中金属性较强的是__________ (写元素符号),写出能证明该结论的一个实验事实:____________________ 。
| 元素 | A | B | C | D |
| 性质或结构信息 | 单质制成的高压灯发出的黄光透雾力强、射程远 | 工业上通过分离液态空气获得其单质。原子的最外层未达到稳定结构 | 单质在常温、常压下是气体,原子的 层有一个未成对的 层有一个未成对的 电子 电子 | 2价阳离子的核外电子排布与氖原子相同 |
(2)D和C形成的化合物中含有
(3)下列对元素B及元素B的常见单质描述正确的是
a.B元素的最高正价为+6
b.常温、常压下B的常见单质难溶于水
c.B的常见单质分子中含有18个电子
d.在一定条件下镁条能与B的常见单质反应
(4)若B与H能形成
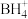 ,则B为
,则B为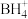 中含有的化学键为
中含有的化学键为(5)A和D两元素中金属性较强的是
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】金属单质及其化合物是化工生产、生活中常用的材料
(1)基态Ni原子价电子排布图为_______ 。
(2)某镍配合物由1个Ni2+与2个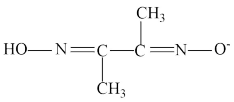 形成。
形成。
①形成该镍配合物的元素中,第二周期元素的第一电离能由小到大的顺序为_______ (用元素符号表示) ,配合物中C采用的杂化类型为_______ 。
②已知该配合物中只有一种元素的原子与Ni2+配位,则与镍配位的原子为_______ (填“C”、“N"”或“O")
(3)Ni(CO)4是常温下呈液态的镍的重要配合物,易溶于CCl4、苯等有机溶剂,则Ni(CO)4的空间构型为_______ ,Ni(CO)4中含有的σ键与π键的数目之比为_______ ,与CO互为等电子的离子有_______ (任写一种)。
(4)MgCO3的热分解温度低于CaCO3的原因是_______ 。
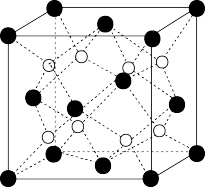
(5)Na2O的晶胞结构如图,Na+的配位数为_______ 。已知该晶胞的密度为ρg·cm-3,阿伏加德罗常数为NA,则两个最近的氧离子间距离为_______ nm(用含ρ、NA的计算式表示)。
(1)基态Ni原子价电子排布图为
(2)某镍配合物由1个Ni2+与2个
 形成。
形成。①形成该镍配合物的元素中,第二周期元素的第一电离能由小到大的顺序为
②已知该配合物中只有一种元素的原子与Ni2+配位,则与镍配位的原子为
(3)Ni(CO)4是常温下呈液态的镍的重要配合物,易溶于CCl4、苯等有机溶剂,则Ni(CO)4的空间构型为
(4)MgCO3的热分解温度低于CaCO3的原因是
(5)Na2O的晶胞结构如图,Na+的配位数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐1】磷酸氯喹是用于治疗疟疾的药物,有研究表明该药物在细胞水平上能有效抑制新型冠状病毒2019-nCoV的感染。磷酸氯喹的结构简式如下图,请回答下列问题。

(1)基态P原子中,电子占据的最高能级符号为___________ , 基态Cl原子价层电子排布式为___________ 。
(2)磷酸氯喹分子中电负性最大的元素是___________ ; 第一电离能I(P)___________ I(C1)(填“>”或“<”)。
(3)磷酸氯喹中C原子的杂化方式为___________ ,NH3沸点比AsH3的沸点高,其理由是_____ 。
(4)磷酸根离子的空间构型为___________ , 磷酸分子中π键数为___________ 。
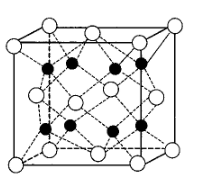
(5)金属磷化物Rh2P (化学式量为237)可用作电解水的高效催化剂,其立方晶胞如图所示,晶胞中P的配位数为___________ , 已知晶胞参数为a nm,则晶体的密度为___________ g·cm-3(列出计算表式,阿伏加德罗常数用NA表示)。

(1)基态P原子中,电子占据的最高能级符号为
(2)磷酸氯喹分子中电负性最大的元素是
(3)磷酸氯喹中C原子的杂化方式为
(4)磷酸根离子的空间构型为
(5)金属磷化物Rh2P (化学式量为237)可用作电解水的高效催化剂,其立方晶胞如图所示,晶胞中P的配位数为

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐2】A、B、C是中学化学中常见的三种元素(A、B、C代表元素符号)。A位于元素周期表中第4周期,其基态原子最外层电子数为2且内层轨道全部排满电子。短周期元素B的一种常见单质为淡黄色粉末。元素C的原子最外层电子数是其内层电子数的3倍。
(1)在第3周期中,第一电离能大于B的元素有_______ 种;A与B形成晶体的晶胞如图所示,该晶胞实际拥有Bn-的数目为_______ ;
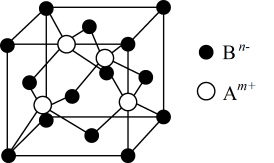
(2)B的氢化物(H2B)分子的空间构型为__________ ;
在乙醇中的溶解度:sH2C)>s(H2B),其原因是_______ 。
(3)B与C可形成BC
①BC 中,B原子轨道的杂化类型是
中,B原子轨道的杂化类型是________ 。
②人们将价电子数和原子数分别相同的不同分子、离子或原子团称为等电子体。与BC 互为等电子体的分子的化学式为
互为等电子体的分子的化学式为_______ (写出一种即可)。
(4)A的氯化物与氨水反应可形成配合物[A(NH3)4]Cl2,l mol该配合物中含有 键的物质的量为
键的物质的量为___ mol。
(1)在第3周期中,第一电离能大于B的元素有

(2)B的氢化物(H2B)分子的空间构型为
在乙醇中的溶解度:sH2C)>s(H2B),其原因是
(3)B与C可形成BC

①BC
 中,B原子轨道的杂化类型是
中,B原子轨道的杂化类型是②人们将价电子数和原子数分别相同的不同分子、离子或原子团称为等电子体。与BC
 互为等电子体的分子的化学式为
互为等电子体的分子的化学式为(4)A的氯化物与氨水反应可形成配合物[A(NH3)4]Cl2,l mol该配合物中含有
 键的物质的量为
键的物质的量为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐3】太阳能电池板材料除单晶硅外,还有铜、铟、镓、硒等化学物质。
(1)基态硅原子的电子排布式:_______________ 。
(2)有一类组成最简单的有机硅化合物叫硅烷。硅烷的组成、结构与相应的烷烃相似。硅烷中硅采取____ 杂化方式,硅烷的沸点与相对分子质量的关系如图所示,呈现这种变化的原因是_______________ 。

(3)硒和硫同为VIA族元素,与其相邻的元素有砷和溴,则三种元素的电负性由小到大的顺序为_______ 。 (用元素符号表示)
(4)气态SeO3分子的立体构型为_________ ,与SeO3互为等电子体的一种离子为____________ (填化学式)。
(5)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为_________ ;若该晶体的晶胞棱长为a pm,则该合金密度为______ g/cm 3。(列出计算式,不要求计算结果,阿伏加德罗常数的值为NA)
(1)基态硅原子的电子排布式:
(2)有一类组成最简单的有机硅化合物叫硅烷。硅烷的组成、结构与相应的烷烃相似。硅烷中硅采取

(3)硒和硫同为VIA族元素,与其相邻的元素有砷和溴,则三种元素的电负性由小到大的顺序为
(4)气态SeO3分子的立体构型为
(5)一种铜金合金晶体具有面心立方最密堆积结构,在晶胞中金原子位于顶点,铜原子位于面心,则该合金中金原子(Au)与铜原子(Cu)个数比为
您最近一年使用:0次



