名校
解题方法
1 . 利用 合成的新型三元催化剂[La0.8Cu0.2Ni1-xMxO3(M 分别为Mn、Fe和Co)]可以使汽车尾气中NO和CO发生反应而减少尾气污染,同时可大大降低重金属的用量。回答下列问题:
合成的新型三元催化剂[La0.8Cu0.2Ni1-xMxO3(M 分别为Mn、Fe和Co)]可以使汽车尾气中NO和CO发生反应而减少尾气污染,同时可大大降低重金属的用量。回答下列问题:
(1)Mn2+的核外电子排布式为:________________ ,其单电子数为_________________ 。
(2)C、N、O、Mn电负性由大到小的顺序是___________ 。
(3) 也是常见配体,其中采取sp2杂化的碳原子和sp3杂化的碳原子个数比为
也是常见配体,其中采取sp2杂化的碳原子和sp3杂化的碳原子个数比为_____ 。
(4)蓝色物质KFe(Ⅲ)x[Fe(Ⅱ)(CN)6]可缓解重金属中毒,x=_______ ;该物质中不存在的作用力有_____ 。
A.范德华力 B.离子键 C.σ键 D.π键 E.氢键
(5)副族元素钴的氧化物可以在室温下完全氧化甲醛(HCHO)。甲醛分子的立体构型为_____ ;甲醛常温下为气体而甲醇(CH3OH)为液体的原因是________________________________ 。
(6)副族元素Mn和元素Se形成的某化合物属于立方晶系,其晶胞结构如图所示,其中(○为Se, 为Mn),该化合物的化学式为
为Mn),该化合物的化学式为________ ,Se的配位数为______ ,Mn和Se的摩尔质量分别为M1g/mol、M2g/mol,该晶体的密度为ρg/cm3,则Mn—Se键的键长为_____________ nm(计算表达式)。

 合成的新型三元催化剂[La0.8Cu0.2Ni1-xMxO3(M 分别为Mn、Fe和Co)]可以使汽车尾气中NO和CO发生反应而减少尾气污染,同时可大大降低重金属的用量。回答下列问题:
合成的新型三元催化剂[La0.8Cu0.2Ni1-xMxO3(M 分别为Mn、Fe和Co)]可以使汽车尾气中NO和CO发生反应而减少尾气污染,同时可大大降低重金属的用量。回答下列问题:(1)Mn2+的核外电子排布式为:
(2)C、N、O、Mn电负性由大到小的顺序是
(3)
 也是常见配体,其中采取sp2杂化的碳原子和sp3杂化的碳原子个数比为
也是常见配体,其中采取sp2杂化的碳原子和sp3杂化的碳原子个数比为(4)蓝色物质KFe(Ⅲ)x[Fe(Ⅱ)(CN)6]可缓解重金属中毒,x=
A.范德华力 B.离子键 C.σ键 D.π键 E.氢键
(5)副族元素钴的氧化物可以在室温下完全氧化甲醛(HCHO)。甲醛分子的立体构型为
(6)副族元素Mn和元素Se形成的某化合物属于立方晶系,其晶胞结构如图所示,其中(○为Se,
 为Mn),该化合物的化学式为
为Mn),该化合物的化学式为
您最近一年使用:0次
2018-01-11更新
|
659次组卷
|
4卷引用:四川省广安市眉山市2018届高三第一次诊断性考试理综化学试题
2 . 钾、氟及锌的相关化合物用途非常广泛。回答下列问题:
(1)基态锌原子的价电子排布式为___________ ;K、F、Zn的电负性从大到小的顺序为___________ 。
(2)Zn与Ca位于同一周期且最外层电子数相等,钙的熔点与沸点均比锌高,其原因是_______________ 。
(3)OF2分子的几何构型为___________ ,中心原子的杂化类型为___________ 。
(4)KOH 与O3反应可得到KO3(臭氧化钾),KO3 中除σ键外,还存在___________ ;与O3-互为等电子体的分子为___________ (任 写一种 )。
(5)K、F、Zn组成的一种晶体结构如图所示,其晶胞参数为a=0.4058 nm。
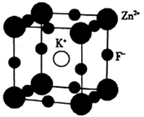
①晶胞中Zn2+的配位数为___________ 个。
②晶胞中紧邻的两个F-间的距离为_______________________ (列出算式即可)nm。
③该晶体的密度为___________ (列出算式即可,用NA表示阿伏伽德罗常数的数值)g·cm-3。
(1)基态锌原子的价电子排布式为
(2)Zn与Ca位于同一周期且最外层电子数相等,钙的熔点与沸点均比锌高,其原因是
(3)OF2分子的几何构型为
(4)KOH 与O3反应可得到KO3(臭氧化钾),KO3 中除σ键外,还存在
(5)K、F、Zn组成的一种晶体结构如图所示,其晶胞参数为a=0.4058 nm。

①晶胞中Zn2+的配位数为
②晶胞中紧邻的两个F-间的距离为
③该晶体的密度为
您最近一年使用:0次
2018-01-07更新
|
409次组卷
|
6卷引用:四川省内江市威远中学2021届高三1月月考化学试题
解题方法
3 . [化学一选修3:物质结构与性质]我国具有悠久的历史,在西汉就有湿法炼铜(Fe+CuSO4=Cu+FeSO4),试回答下列问题。
(1)Cu2+的未成对电子数有______ 个,H、O、S 电负性由大到小的顺序为_______ 。
(2)在硫酸铜溶液中滴加过量氨水可形成[Cu(NH3)4]SO4蓝色溶液。
①[Cu(NH3)4]SO4中化学键类型有_______ ,[Cu(NH3)4]2+ 的结构简式为_______ ,阴离子中心原子杂化类型为______ 。
②氨的沸点远高于膦(PH3),原因是______________ 。
(3)铁铜合金晶体类型为_____ ;铁的第三(I3)和第四(I4)电离能分别为2957kJ/mol、5290kJ/mol,比较数据并分析原因________________ 。
(4)金铜合金的一种晶体结构为立方晶型,如图所示。

①该合金的化学式为____ ;
②已知该合金的密度为dg/cm3,阿伏伽德罗常数值为NA,两个金原子间最小间隙为apm(1pm=10-10cm)。则铜原子的半径为_______ cm(写出计算表达式)。
(1)Cu2+的未成对电子数有
(2)在硫酸铜溶液中滴加过量氨水可形成[Cu(NH3)4]SO4蓝色溶液。
①[Cu(NH3)4]SO4中化学键类型有
②氨的沸点远高于膦(PH3),原因是
(3)铁铜合金晶体类型为
(4)金铜合金的一种晶体结构为立方晶型,如图所示。

①该合金的化学式为
②已知该合金的密度为dg/cm3,阿伏伽德罗常数值为NA,两个金原子间最小间隙为apm(1pm=10-10cm)。则铜原子的半径为
您最近一年使用:0次
解题方法
4 . 根据已学物质结构与性质的有关知识,回答下列问题:
(1)基态铁原子的价电子轨道排布图为__________ 。铁元素常见的离子有Fe2+和Fe3+,稳定性Fe2+____ Fe3+(填“大于”或“小于”),原因是________________ 。
(2)已知FeCl3的沸点:319℃,熔点:306℃,则FeCl3的晶体类型为__________ 。
(3)C、H、N、O四种元素中电负性由大到小的顺序是________ (填元素符号下同),前四周期元素中基态原子核外未成对电子数最多的是______________ 。
(4)一种铜的溴化物晶胞结构如下图所示
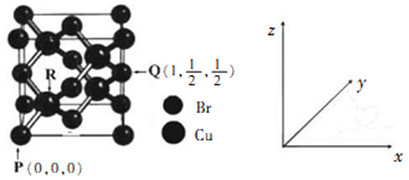
由图可知,该晶体的化学式为________ ,与每个Br紧邻Br有______ 个,由图中的P点和Q点的原子坐标参数,可确定R点的原子坐标参数为_________ 。
(1)基态铁原子的价电子轨道排布图为
(2)已知FeCl3的沸点:319℃,熔点:306℃,则FeCl3的晶体类型为
(3)C、H、N、O四种元素中电负性由大到小的顺序是
(4)一种铜的溴化物晶胞结构如下图所示

由图可知,该晶体的化学式为
您最近一年使用:0次
解题方法
5 . 铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)铬元素基态原子的电子排布式为_________ ;硫酸铜溶于氨水,形成[Cu(NH3)4]SO4溶液,[Cu(NH3)4]SO4中阴离子的立体构型是______ ,_________ 接受孤对电子对;金属铜的堆积方式为______ 。
(2)制备Cr2O2Cl2的反应式为K2Cr2O2+3CCl4=2KCl+2Cr2O2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由小到大的顺序是_____________ (用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中中心原子的杂化方式为________ ,COCl2分子中ɑ键和π键的个数比为__________ 。
③NiO、FeO的晶体结构均与氯化钠的晶体结构相同。其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO_________ FeO(填“>”、“<”或“=”)。
(4)Cu和Ca的合金呈粉末状,极易被氧化,其晶胞结构如图所示:
①该晶体的化学式为_________ ,铜和钙两种金属相比铜的熔点比钙高,其原因是_______ 。
②已知该晶胞的密度为dg·cm-3,Ca半径为r1cm,Cu半径为r2cm,设NA为阿伏伽德罗常数,则该晶胞的空间利用率为________ (用含d、r1、r2、NA的代数式表示)。
(1)铬元素基态原子的电子排布式为
(2)制备Cr2O2Cl2的反应式为K2Cr2O2+3CCl4=2KCl+2Cr2O2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由小到大的顺序是
②COCl2分子中所有原子均满足8电子构型,COCl2分子中中心原子的杂化方式为
③NiO、FeO的晶体结构均与氯化钠的晶体结构相同。其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO
(4)Cu和Ca的合金呈粉末状,极易被氧化,其晶胞结构如图所示:

①该晶体的化学式为
②已知该晶胞的密度为dg·cm-3,Ca半径为r1cm,Cu半径为r2cm,设NA为阿伏伽德罗常数,则该晶胞的空间利用率为
您最近一年使用:0次
名校
解题方法
6 . 砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。回答下列问题:
(1)基态Ga原子的核外电子排布式为[Ar]________ 。
(2)根据元素周期律,元素的电负性Ga________ (填“大于”或“小于”,下同)As,第一电离能B________ Ga;BF3和NH3的分子能够通过配位键相结合的原因是_______________________ 。
(3)杀虫剂Na3AsO4中阴离子的空间构型为________ ,As原子采取________ 杂化。
(4)组成相似的GaF3和GaCl3晶体,前者属于离子晶体,后者属于分子晶体,从F-和Cl-结构的不同分析其原因是_____________ 。
(5)原子晶体GaAs的晶胞参数a=x pm,它的晶胞结构如下图所示。该晶胞内部存在的共价键数为________ ;A原子距离B原子所在六面体的侧面的最短距离为________ (用x表示)pm;该晶体的密度为________ g·cm-3(阿伏伽德罗常数的值用NA表示)
 。
。
(1)基态Ga原子的核外电子排布式为[Ar]
(2)根据元素周期律,元素的电负性Ga
(3)杀虫剂Na3AsO4中阴离子的空间构型为
(4)组成相似的GaF3和GaCl3晶体,前者属于离子晶体,后者属于分子晶体,从F-和Cl-结构的不同分析其原因是
(5)原子晶体GaAs的晶胞参数a=x pm,它的晶胞结构如下图所示。该晶胞内部存在的共价键数为
 。
。
您最近一年使用:0次
2017-03-11更新
|
129次组卷
|
3卷引用:四川省广安市第二中学2019届高三上学期第一次月考化学试题
7 . X、Y、Z、Q、R、W是原子序数依次增大的前四周期元素。X的原子核内无中子,Y与Z能形成两种无色无味的气体,Q与X同族,R在同周期主族元素中原子半径最小,基态原子W的3d能级有2个空轨道。请回答下列问题:
(1)W在元素周期表中的位置:_____ 。上述6种元素中电负性最大的是(填名称)_____ 。
(2)RZ-3的空间构型为_______ ,化合物YX4Z的沸点比YX3R高,其原因是____________ 。
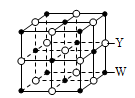
(3)Y和W能够形成强度极高的化合物G,其晶胞结构如图所示, G的化学式为________ 。如从该晶胞中抽出Y原子,所得晶胞即为单质W的晶胞,其配位数为________ 。
(4)强酸性溶液中,WZ 在加热条件下可以被X2Y2Z4还原为WZ,该反应的离子方程式是______________ 。
(1)W在元素周期表中的位置:
(2)RZ-3的空间构型为
(3)Y和W能够形成强度极高的化合物G,其晶胞结构如图所示, G的化学式为

(4)强酸性溶液中,WZ 在加热条件下可以被X2Y2Z4还原为WZ,该反应的离子方程式是
您最近一年使用:0次
8 . Q、R、T、X、Y、Z是六种原子序数依次增大的前四周期常见元素,其相关信息如下表:
(1)Z元素的原子基态时的电子排布式是__________________
(2)下列叙述正确的是____________
a. Q的最简单气态氢化物比R的气体氢化物稳定
b. Q的含氧酸一定比R的含氧酸酸性强
c. R的气态氢化物的熔点在同族元素形成的氢化物中最低
d. R的第一电离能、电负性都比Q大
(3)Q和T可形成两种常见化合物,分别表示为QT与QT2。QT分子中σ键π键的个数比为____________ ;QT2分子中,Q原子采取________ 杂化。
(4)笑气(R2T)是一种麻醉剂,有关理论认为R2T与QT2具有相似的结构。故的空间构型为______________ ,且为_______________ (填“极性”或“非极性”)分子。
(5)现有Q、Y和镁三种元素的某种晶体具有超导性,其晶胞结构如右上图所示。该晶体的化学式为____________ ;晶体中每个镁原子周围距离相等且最近的Y原子有________ 个。

| 元素 | 相关信息 |
| Q | Q的单质是实验室常用的惰性电极材料 |
| R | R原子基态时2p原子轨道上有3个未成对电子 |
| T | 负二价的元素T的氢化物在通常情况下是一种液体,且 T的质量分数为88.9% |
| X | X是第三周期电负性最大的元素 |
| Y | 元素Y位于周期表第10列 |
| Z | Z存在质量数为65,中子数为36的核素 |
(1)Z元素的原子基态时的电子排布式是
(2)下列叙述正确的是
a. Q的最简单气态氢化物比R的气体氢化物稳定
b. Q的含氧酸一定比R的含氧酸酸性强
c. R的气态氢化物的熔点在同族元素形成的氢化物中最低
d. R的第一电离能、电负性都比Q大
(3)Q和T可形成两种常见化合物,分别表示为QT与QT2。QT分子中σ键π键的个数比为
(4)笑气(R2T)是一种麻醉剂,有关理论认为R2T与QT2具有相似的结构。故的空间构型为
(5)现有Q、Y和镁三种元素的某种晶体具有超导性,其晶胞结构如右上图所示。该晶体的化学式为

您最近一年使用:0次
9 . 科学家正在研究温室气体CH4和CO2的转化和利用。
(1)CH4和CO2所含的三种元素电负性从小到大的顺序为______ 。
(2)下列关于CH4和CO2的说法正确的是______ (填序号)。
a.固态CO2属于分子晶体
b. CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d. CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
(3)在Ni基催化剂作用下,CH4和CO2反应可获得化工原料CO和H2。
①基态Ni原子的电子排布式为____________ ,Ni该元素位于元素周期表的第___ 族。
②Ni能与CO形成正四面体形的配合物Ni(CO)4,1mol Ni(CO)4中含有_____ molσ键。
(4)一定条件下,CH4和CO2都能与H2O形成笼状结构(如图所示)的水合物晶体,其相关参数见下表.CH4与H2O形成的水合物俗称“可燃冰”。


①“可燃冰”中分子间存在的2种作用力是______ 。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想.已知图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是___________________________ 。
(1)CH4和CO2所含的三种元素电负性从小到大的顺序为
(2)下列关于CH4和CO2的说法正确的是
a.固态CO2属于分子晶体
b. CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d. CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
(3)在Ni基催化剂作用下,CH4和CO2反应可获得化工原料CO和H2。
①基态Ni原子的电子排布式为
②Ni能与CO形成正四面体形的配合物Ni(CO)4,1mol Ni(CO)4中含有
(4)一定条件下,CH4和CO2都能与H2O形成笼状结构(如图所示)的水合物晶体,其相关参数见下表.CH4与H2O形成的水合物俗称“可燃冰”。


①“可燃冰”中分子间存在的2种作用力是
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想.已知图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是
您最近一年使用:0次
2016-12-09更新
|
1723次组卷
|
3卷引用:2020届四川省成都市第七中学高三二月份网络教学质量监测卷化学试题



