1 . 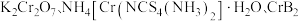 均是铬的重要化合物,回答下列问题:
均是铬的重要化合物,回答下列问题: 原子有
原子有___________ 种能量不同的电子,价电子排布式为___________ 。
(2)已知电子亲和能(E)是基态的气态原子得到电子变为气态阴离子所放出的能量, 。氧的第一电子亲和能
。氧的第一电子亲和能 为
为___________  ;
; ,其原因是
,其原因是___________ 。
(3)雷氏盐的化学式为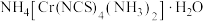 。
。
①H、C、N、O四种元素的电负性由大到小的顺序为___________ 。
②雷氏盐中所含化学键类型___________ 。
A.离子键 B.共价键 C.配位键 D.金属键 E.氢键
③配体之一 分子的
分子的 模型名称为
模型名称为___________ ,与配体 互为等电子体的分子和离子有
互为等电子体的分子和离子有___________ 、___________ (各写1种)。
(4)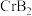 的晶体密度为
的晶体密度为 ,晶体结构(如图)为六棱柱,底边边长为
,晶体结构(如图)为六棱柱,底边边长为 ,高为
,高为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则
,则
___________ (列出计算式)。
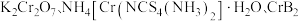 均是铬的重要化合物,回答下列问题:
均是铬的重要化合物,回答下列问题: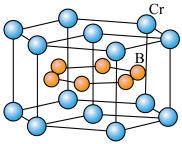
 原子有
原子有(2)已知电子亲和能(E)是基态的气态原子得到电子变为气态阴离子所放出的能量,
 。氧的第一电子亲和能
。氧的第一电子亲和能 为
为 ;
; ,其原因是
,其原因是(3)雷氏盐的化学式为
 。
。①H、C、N、O四种元素的电负性由大到小的顺序为
②雷氏盐中所含化学键类型
A.离子键 B.共价键 C.配位键 D.金属键 E.氢键
③配体之一
 分子的
分子的 模型名称为
模型名称为 互为等电子体的分子和离子有
互为等电子体的分子和离子有(4)
 的晶体密度为
的晶体密度为 ,晶体结构(如图)为六棱柱,底边边长为
,晶体结构(如图)为六棱柱,底边边长为 ,高为
,高为 ,设阿伏加德罗常数的值为
,设阿伏加德罗常数的值为 ,则
,则
您最近一年使用:0次
名校
2 . 2023年诺贝尔化学奖授予蒙吉·G·巴文迪等三位科学家,以表彰他们在发现和合成量子点方面所作出的贡献,碳量子点是一类具有显著荧光性能的零维碳纳米材料,其结构如图所示。回答下列问题:_______ 区,图中C的杂化方式为_______ 。
(2)碳量子点结构包含的元素中电负性由大到小排列为:_______ 。
(3)碳量子点水溶性_______ (选填“>”“<”“=”)石墨水溶性,理由是:_______ 。
(4)高压合成金刚石的原料是廉价的石墨,用高压釜持续施加高温高压并加入金属镍等金属催化剂,石墨可转化为金刚石。基态镍原子核外电子的空间运动状态有_______ 种,比较二者C-C共价键的键长:石墨_______ 金刚石(选填“>”“<”“=”)。
(5)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,其中一种结构为立方氮化硼(如图),类似于金刚石。_______ ,则立方氮化硼晶体密度为_______ g·cm-3(列出计算式,阿伏加德罗常数的值为NA)。

(2)碳量子点结构包含的元素中电负性由大到小排列为:
(3)碳量子点水溶性
(4)高压合成金刚石的原料是廉价的石墨,用高压釜持续施加高温高压并加入金属镍等金属催化剂,石墨可转化为金刚石。基态镍原子核外电子的空间运动状态有
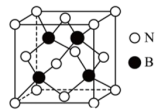
(5)氮化硼(BN)是一种性能优异、潜力巨大的新型材料,其中一种结构为立方氮化硼(如图),类似于金刚石。
您最近一年使用:0次
名校
解题方法
3 . 含铜物质在生产生活中有着广泛应用。回答下列问题:
(1)一个原子轨道填充2个自旋方向相反(顺时针和逆时针)的电子。原子中电子有两种相反的自旋状态,分别用 和
和 表示,称为电子的自旋磁量子数,则基态铜原子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,则基态铜原子自旋磁量子数的代数和为_______ ;基态 较基态
较基态 更稳定的原因是
更稳定的原因是_______ 。
(2) 稀溶液中存在
稀溶液中存在 ,
, 的空间构型为八面体形:下列对
的空间构型为八面体形:下列对 中
中 杂化方式推断合理的是_______(填标号)。
杂化方式推断合理的是_______(填标号)。
(3) 可形成
可形成 ,其中en代表
,其中en代表 。1mol该配合物中,VSEPR模型为四面体的非金属原子共有
。1mol该配合物中,VSEPR模型为四面体的非金属原子共有_______ 个;C、N、F的电负性由大到小的顺序为_______ 。
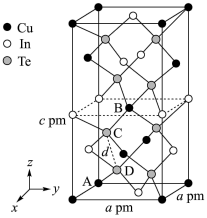
(4)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为_______ ;该晶体的化学式为_______ 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点,B点原子的分数坐标分别为(0,0,0)、 ,则C点原子的分数坐标为
,则C点原子的分数坐标为_______ ,晶胞中C、D间距离
_______ pm。
(1)一个原子轨道填充2个自旋方向相反(顺时针和逆时针)的电子。原子中电子有两种相反的自旋状态,分别用
 和
和 表示,称为电子的自旋磁量子数,则基态铜原子自旋磁量子数的代数和为
表示,称为电子的自旋磁量子数,则基态铜原子自旋磁量子数的代数和为 较基态
较基态 更稳定的原因是
更稳定的原因是(2)
 稀溶液中存在
稀溶液中存在 ,
, 的空间构型为八面体形:下列对
的空间构型为八面体形:下列对 中
中 杂化方式推断合理的是_______(填标号)。
杂化方式推断合理的是_______(填标号)。A. | B. | C.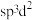 | D. |
(3)
 可形成
可形成 ,其中en代表
,其中en代表 。1mol该配合物中,VSEPR模型为四面体的非金属原子共有
。1mol该配合物中,VSEPR模型为四面体的非金属原子共有(4)一种由Cu、In、Te组成的晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,晶体中Te原子填充在Cu、In围成的四面体空隙中,则四面体空隙的占有率为
 ,则C点原子的分数坐标为
,则C点原子的分数坐标为

您最近一年使用:0次
2024-04-04更新
|
700次组卷
|
3卷引用:2024届四川省成都市第七中学高三下学期二模诊断考试理综试题-高中化学
2024届四川省成都市第七中学高三下学期二模诊断考试理综试题-高中化学(已下线) 2024届四川省成都市第七中学高三下学期二诊模拟考试理综试卷-高中化学2024届四川省仁寿第一中学校(北校区)二模理综试题-高中化学
解题方法
4 . 铜配合物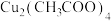 (见图1,未表示出氢原子)和锌配合物
(见图1,未表示出氢原子)和锌配合物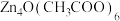 (见图2,未表示出氢原子)可分别形成笼状配合物和多孔配位聚合物。回答下列问题:
(见图2,未表示出氢原子)可分别形成笼状配合物和多孔配位聚合物。回答下列问题:
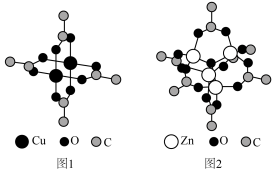
(1)基态 的未成对电子数为
的未成对电子数为___________ ; 第二电离能较大者是
第二电离能较大者是___________ 。
(2) 中C原子的轨道杂化类型为
中C原子的轨道杂化类型为___________ ,所含元素电负性由小到大的顺序为___________ 。
(3)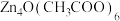 中锌离子的配位数为
中锌离子的配位数为___________ ;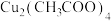 熔点为
熔点为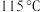 ,属于
,属于___________ (填“离子”、“共价”或“分子”)晶体。
(4)用对苯二甲酸根替换 后,
后,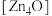 团簇被对苯二甲酸根相互连接形成的晶体Z立方晶胞的1/8如图。已知该晶体密度为
团簇被对苯二甲酸根相互连接形成的晶体Z立方晶胞的1/8如图。已知该晶体密度为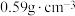 ,假设其摩尔质量为
,假设其摩尔质量为 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
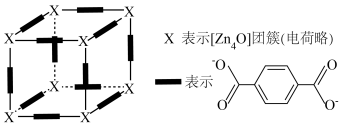
①对苯二甲酸根的___________ 原子提供孤对电子与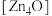 团簇形成配位键。
团簇形成配位键。
②晶体Z的化学式为___________ 。
③立方晶胞参数为___________  (列出计算式)。
(列出计算式)。
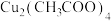 (见图1,未表示出氢原子)和锌配合物
(见图1,未表示出氢原子)和锌配合物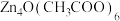 (见图2,未表示出氢原子)可分别形成笼状配合物和多孔配位聚合物。回答下列问题:
(见图2,未表示出氢原子)可分别形成笼状配合物和多孔配位聚合物。回答下列问题:
(1)基态
 的未成对电子数为
的未成对电子数为 第二电离能较大者是
第二电离能较大者是(2)
 中C原子的轨道杂化类型为
中C原子的轨道杂化类型为(3)
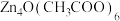 中锌离子的配位数为
中锌离子的配位数为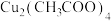 熔点为
熔点为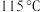 ,属于
,属于(4)用对苯二甲酸根替换
 后,
后,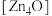 团簇被对苯二甲酸根相互连接形成的晶体Z立方晶胞的1/8如图。已知该晶体密度为
团簇被对苯二甲酸根相互连接形成的晶体Z立方晶胞的1/8如图。已知该晶体密度为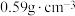 ,假设其摩尔质量为
,假设其摩尔质量为 为阿伏加德罗常数的值。
为阿伏加德罗常数的值。
①对苯二甲酸根的
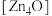 团簇形成配位键。
团簇形成配位键。②晶体Z的化学式为
③立方晶胞参数为
 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
2024-01-06更新
|
335次组卷
|
2卷引用:2024届四川省成都市高中毕业班第一次诊断性检测理科综合
5 . 决定物质性质的根本因素是物质结构。请回答下列问题:
(1)物质 中非金属元素的电负性由小到大的顺序为
中非金属元素的电负性由小到大的顺序为______ 。
(2)Ca元素基态原子的价电子排布式为______ ;Ca元素的气态原子逐个依次失去第1至第5个电子所需能量(电离能)用I1至I5表示,其中所需能量差值最大的是______ (填字母)。
A、 B、
B、 C、
C、 D、
D、
(3)物质Na3AsO3中As原子的杂化方式为______ ;AsCl3的空间构型为______ 。
(4)已知:GaAs和GaN的晶胞结构均与金刚石的相似,GaAs熔点为1238℃,GaN熔点约为l500℃,则GaAs熔点低于GaN的原因为______ 。
(5)与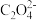 互为等电子体的分子的化学式为
互为等电子体的分子的化学式为______ (写一种)。
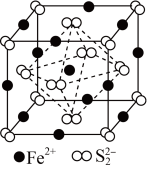
(6)FeS2晶体的晶胞如图所示。晶胞边长为anm,FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为______ 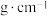 ;晶胞中Fe2+位于S2-所形成的正八面体的体心,该正八面体的边长为
;晶胞中Fe2+位于S2-所形成的正八面体的体心,该正八面体的边长为______ nm。
(1)物质
 中非金属元素的电负性由小到大的顺序为
中非金属元素的电负性由小到大的顺序为(2)Ca元素基态原子的价电子排布式为
A、
 B、
B、 C、
C、 D、
D、
(3)物质Na3AsO3中As原子的杂化方式为
(4)已知:GaAs和GaN的晶胞结构均与金刚石的相似,GaAs熔点为1238℃,GaN熔点约为l500℃,则GaAs熔点低于GaN的原因为
(5)与
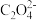 互为等电子体的分子的化学式为
互为等电子体的分子的化学式为(6)FeS2晶体的晶胞如图所示。晶胞边长为anm,FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为
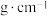 ;晶胞中Fe2+位于S2-所形成的正八面体的体心,该正八面体的边长为
;晶胞中Fe2+位于S2-所形成的正八面体的体心,该正八面体的边长为
您最近一年使用:0次
名校
解题方法
6 . 硼和镓及其化合物在合金工业、制药工业、电池工业有广泛的应用。用于制氢的氨硼烷是非常有应用潜力的车载储氢材料之一,氨硼烷水解释放氢气,在催化剂存在条件下进行,该反应是氢元素间的归中反应,其反应方程式为:NH3BH3+2H2O= +
+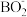 +3H2↑。回答下列问题:
+3H2↑。回答下列问题:
(1)基态B原子的最高能级电子排布式为___________ 。
(2)NH3BH3中所含元素电负性由大到小的顺序为___________ ,氨硼烷比其等电子体乙烷熔点高,原因是___________ 。
(3)反应方程式中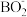 是
是 的简写形式,
的简写形式, 中含有一个六元环状结构,且只有氧原子最外层达到8e-稳定结构,写出
中含有一个六元环状结构,且只有氧原子最外层达到8e-稳定结构,写出 的结构式:
的结构式:___________ 。
(4)一种含镓的药物合成方法如图所示:

①化合物Ⅰ中环上N原子的杂化方式为___________ ,1mol化合物Ⅰ中含有的C-H和C-Cσ键的数目共为___________ NA。
②化合物Ⅱ中Ga的配位数为___________ ,x=___________ 。
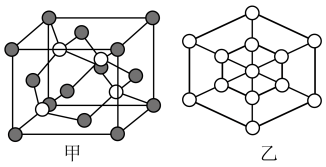
(5)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞结构如图甲所示,已知该晶体的密度为ρg/cm3),设NA是阿伏加德罗常数的值,若P原子半径为apm,晶胞中B、P原子相切,则B原子半径为___________ pm(写计算表达式);磷化硼晶胞沿着体对角线方向的投影(图乙中○表示P原子的投影),在图乙中用●画出B原子的投影位置___________ 。
 +
+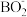 +3H2↑。回答下列问题:
+3H2↑。回答下列问题:(1)基态B原子的最高能级电子排布式为
(2)NH3BH3中所含元素电负性由大到小的顺序为
(3)反应方程式中
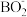 是
是 的简写形式,
的简写形式, 中含有一个六元环状结构,且只有氧原子最外层达到8e-稳定结构,写出
中含有一个六元环状结构,且只有氧原子最外层达到8e-稳定结构,写出 的结构式:
的结构式:(4)一种含镓的药物合成方法如图所示:

①化合物Ⅰ中环上N原子的杂化方式为
②化合物Ⅱ中Ga的配位数为
(5)磷化硼(BP)是一种超硬耐磨涂层材料,其晶胞结构如图甲所示,已知该晶体的密度为ρg/cm3),设NA是阿伏加德罗常数的值,若P原子半径为apm,晶胞中B、P原子相切,则B原子半径为

您最近一年使用:0次
名校
解题方法
7 . 元素周期表中第四周期过渡元素在工业及生活方面有重要应用。请回答下列问题:
(1)“钛”被称为21世纪金属,画出基态钛的价电子的电子排布图___________ 。
(2)CrO5中Cr为+6价,则-1价的O与-2价的O的个数比为_________ 。
(3)[Co(NH3)4Cl2]+中中心离子的配位数_________ 。能区别[Co(NH3)4Cl2]Cl和[Co(NH3)4Cl2]NO3两种溶液的试剂是_________ (填标号)。
A.浓氨水 B.NaOH溶液 C.稀H2SO4 D.AgNO3溶液
(4)K3[Fe(CN)6]是鉴别Fe2+的重要试剂,这四种元素的电负性从大到小的顺序是_________ (填元素符号),下列碳的杂化为sp的是_________ (填标号)。
A.CH2Cl2 B.C2H2 C.溴苯 D.HCN
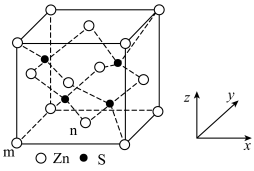
(5)ZnS的晶胞如图所示,若m点坐标为(0,0,0),n点坐标为( ,
, ,0)此晶胞中与n点最远的S的坐标为
,0)此晶胞中与n点最远的S的坐标为___________ 。若晶胞参数为apm,则ZnS的密度为___________ g·cm-3(设NA为阿伏加德罗常数的值)。
(1)“钛”被称为21世纪金属,画出基态钛的价电子的电子排布图
(2)CrO5中Cr为+6价,则-1价的O与-2价的O的个数比为
(3)[Co(NH3)4Cl2]+中中心离子的配位数
A.浓氨水 B.NaOH溶液 C.稀H2SO4 D.AgNO3溶液
(4)K3[Fe(CN)6]是鉴别Fe2+的重要试剂,这四种元素的电负性从大到小的顺序是
A.CH2Cl2 B.C2H2 C.溴苯 D.HCN
(5)ZnS的晶胞如图所示,若m点坐标为(0,0,0),n点坐标为(
 ,
, ,0)此晶胞中与n点最远的S的坐标为
,0)此晶胞中与n点最远的S的坐标为
您最近一年使用:0次
名校
8 . 镓及其化合物在合金工业、制药工业、电池工业有广泛的应用。回答下列问题:
(1)基态Ga原子的价层电子排布式为_______ 。
(2)LiGaH4是一种温和的还原剂,其可由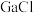 3和过量的LiH反应制得:
3和过量的LiH反应制得: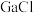 3
3 4
4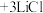 。
。
①已知GaCl3的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为_______ 。
②GaCl3在270℃左右以二聚物存在,该二聚物的每个原子都满足8电子稳定结构,写出它的结构式:_______ 。
③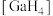 -的立体构型为
-的立体构型为_______ 。
(3)一种含镓的药物合成方法如图所示
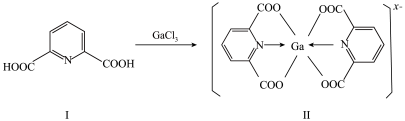
①化合物I中环上N原子的杂化方式为_______ ,1mol化合物Ⅰ中含有的σ键的物质的量为_______ 。化合物I中所含元素的电负性由大到小的顺序为_______ (用元素符号表示)。
②化合物Ⅱ中Ga的配位数为_______ ,x=_______ 。
(4)Ga、Li和O三种原子形成的一种晶体基片在二极管中有重要用途。其晶胞结构如图所示:
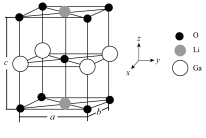
①上述晶胞沿着a轴的投影图为_______ (填选项字母)。
A.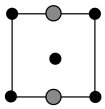 B.
B.  C.
C.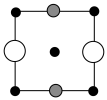
②用NA表示阿伏加德罗常数的值,晶胞参数为a=b=0.3nm,c=0.386nm,晶胞棱边夹角均为90°,则该晶体密度为_______ g·cm-3(列出计算式即可)。
(1)基态Ga原子的价层电子排布式为
(2)LiGaH4是一种温和的还原剂,其可由
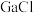 3和过量的LiH反应制得:
3和过量的LiH反应制得: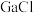 3
3 4
4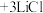 。
。①已知GaCl3的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为
②GaCl3在270℃左右以二聚物存在,该二聚物的每个原子都满足8电子稳定结构,写出它的结构式:
③
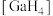 -的立体构型为
-的立体构型为(3)一种含镓的药物合成方法如图所示

①化合物I中环上N原子的杂化方式为
②化合物Ⅱ中Ga的配位数为
(4)Ga、Li和O三种原子形成的一种晶体基片在二极管中有重要用途。其晶胞结构如图所示:

①上述晶胞沿着a轴的投影图为
A.
 B.
B.  C.
C.
②用NA表示阿伏加德罗常数的值,晶胞参数为a=b=0.3nm,c=0.386nm,晶胞棱边夹角均为90°,则该晶体密度为
您最近一年使用:0次
名校
解题方法
9 . 含碘的物质广泛应用于生活中。如(CH3NH3)PbI3作为典型的有机金属卤化物,一直是太阳能电池研究的宠儿;AgI可用于显影剂和人工增雨。
(1)基态碘原子的价电子排布式为___________ 。
(2)CH3NH 中所含元素电负性从大到小的顺序为
中所含元素电负性从大到小的顺序为___________ 。
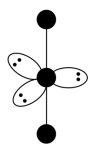
(3)I 的VSEPR模型如下图,中心I原子的杂化方式是
的VSEPR模型如下图,中心I原子的杂化方式是___________ (填“sp3”、“sp”、“sp3d”或“sp3d2”)。I 的空间构型为
的空间构型为___________ 。
(4)Ti的四卤化物熔点如下表所示。由此可推知,TiF4中的化学键类型是___________ TiCl4至TiI4熔点依次升高,原因是___________ 。
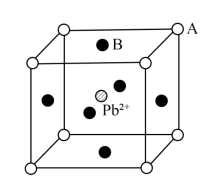
(5)(CH3NH3)PbI3晶体属于钙钛矿型结构(如图所示)。Pb2+周围距离最近且相等的I-数目有___________ 个;晶胞中A、B之间的距离为apm,(CH3NH3)PbI3式量为M,该物质的密度ρ=___________ g·cm-3(列出计算式,设NA为阿伏加德罗常数的值)。
(6)在离子晶体中,当0.414<r(阳离子)∶r(阴离子)<0.732时,AB型化合物往往采用和NaCl晶体相同的晶体结构。已知r(Ag+)∶r(I-)=0.573,但在室温下,AgI的晶体结构如下图所示,称为六方碘化银。造成AgI晶体结构不同于NaCl晶体结构的原因不可能 是___________ (填标号)。
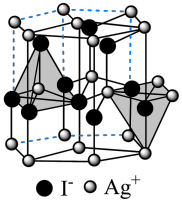
a.几何因素 b.电荷因素 c.键性因素
(1)基态碘原子的价电子排布式为
(2)CH3NH
 中所含元素电负性从大到小的顺序为
中所含元素电负性从大到小的顺序为(3)I
 的VSEPR模型如下图,中心I原子的杂化方式是
的VSEPR模型如下图,中心I原子的杂化方式是 的空间构型为
的空间构型为
(4)Ti的四卤化物熔点如下表所示。由此可推知,TiF4中的化学键类型是
| 化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | -24.12 | 38.3 | 155 |
(5)(CH3NH3)PbI3晶体属于钙钛矿型结构(如图所示)。Pb2+周围距离最近且相等的I-数目有

(6)在离子晶体中,当0.414<r(阳离子)∶r(阴离子)<0.732时,AB型化合物往往采用和NaCl晶体相同的晶体结构。已知r(Ag+)∶r(I-)=0.573,但在室温下,AgI的晶体结构如下图所示,称为六方碘化银。造成AgI晶体结构不同于NaCl晶体结构的原因

a.几何因素 b.电荷因素 c.键性因素
您最近一年使用:0次
名校
10 . 铝离子电池能量密度高、成本低且安全性高,是有前景的下一代储能电池。铝离子电池一般采用离子液体作为电解质,几种离子液体的结构如下。
(1)基态铝原子的核外电子排布式为___________ 。
(2)基态氮原子的价层电子排布图为___________ 。
(3)化合物Ⅰ中碳原子的杂化轨道类型为___________ ,化合物II中阳离子的空间构型为___________ 。
(4)化合物Ⅲ中O、F、S电负性由大到小的顺序为___________ 。
(5)传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是___________ 。
(6)铝离子电池的其中一种正极材料为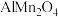 ,其晶胞中铝原子的骨架如图所示。
,其晶胞中铝原子的骨架如图所示。 距离最近的
距离最近的 的个数为
的个数为___________ 。
②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,如图中原子1的坐标为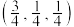 ,原子2的坐标为
,原子2的坐标为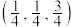 ,则原子3的坐标为
,则原子3的坐标为___________ 。
③已知该晶体属于立方晶系,晶胞参数为a ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶体的密度为
,则晶体的密度为___________  (列出计算式)。
(列出计算式)。

(1)基态铝原子的核外电子排布式为
(2)基态氮原子的价层电子排布图为
(3)化合物Ⅰ中碳原子的杂化轨道类型为
(4)化合物Ⅲ中O、F、S电负性由大到小的顺序为
(5)传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是
(6)铝离子电池的其中一种正极材料为
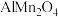 ,其晶胞中铝原子的骨架如图所示。
,其晶胞中铝原子的骨架如图所示。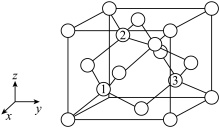
 距离最近的
距离最近的 的个数为
的个数为②以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,如图中原子1的坐标为
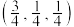 ,原子2的坐标为
,原子2的坐标为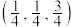 ,则原子3的坐标为
,则原子3的坐标为③已知该晶体属于立方晶系,晶胞参数为a
 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则晶体的密度为
,则晶体的密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次



