名校
解题方法
1 . 锰(Mn)、钴(Co)、镍(Ni)等过渡金属元素化合物的应用研究是前沿科学之一,回答下列问题:
(1) 的价电子排布式为
的价电子排布式为_______ 。金属锰可导电、导热,有金属光泽和延展性,这些性质都可以用“_______ 理论”解释。
(2)已知金属锰有多种晶型,γ型锰的面心立方晶胞俯视图符合下列_______ (填序号),Mn原子的配位数为_______ 。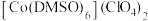 是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为
是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为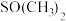 。DMSO中硫原子的杂化轨道类型为
。DMSO中硫原子的杂化轨道类型为_______ ,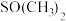 中键角
中键角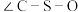
_______  中键角
中键角 (填“大于”“小于”或“等于”),
(填“大于”“小于”或“等于”), 的中心原子价层电子对数为
的中心原子价层电子对数为_______ ,元素S、Mn、N的电负性由大到小的顺序为_______ 。
(4)镍和苯基硼酸在催化剂作用下可以合成丙烯醇(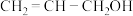 ),该物质与丙醛(
),该物质与丙醛(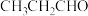 )相比,两者沸点相差较大,原因是
)相比,两者沸点相差较大,原因是_______ 。
(5) 的晶胞结构如图甲所示,其中离子坐标参数A为
的晶胞结构如图甲所示,其中离子坐标参数A为 ,B为
,B为 ,则C的离子坐标参数为
,则C的离子坐标参数为_______ 。一定温度下, 晶体可以自发地分散并形成“单分子层”,可以认为
晶体可以自发地分散并形成“单分子层”,可以认为 作密置单层排列,
作密置单层排列, 填充其中(如图乙),已知
填充其中(如图乙),已知 的半径为
的半径为 ,设阿伏加德罗常数值为NA,每平方米面积上具有该晶体的质量为
,设阿伏加德罗常数值为NA,每平方米面积上具有该晶体的质量为_______ g(用含a、NA的代数式表示)。
(1)
 的价电子排布式为
的价电子排布式为(2)已知金属锰有多种晶型,γ型锰的面心立方晶胞俯视图符合下列
A.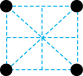 B.
B. C.
C.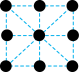 D.
D.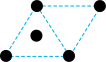
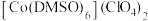 是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为
是一种紫色晶体,其中DMSO为二甲基亚砜,化学式为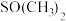 。DMSO中硫原子的杂化轨道类型为
。DMSO中硫原子的杂化轨道类型为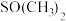 中键角
中键角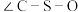
 中键角
中键角 (填“大于”“小于”或“等于”),
(填“大于”“小于”或“等于”), 的中心原子价层电子对数为
的中心原子价层电子对数为(4)镍和苯基硼酸在催化剂作用下可以合成丙烯醇(
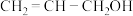 ),该物质与丙醛(
),该物质与丙醛(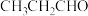 )相比,两者沸点相差较大,原因是
)相比,两者沸点相差较大,原因是(5)
 的晶胞结构如图甲所示,其中离子坐标参数A为
的晶胞结构如图甲所示,其中离子坐标参数A为 ,B为
,B为 ,则C的离子坐标参数为
,则C的离子坐标参数为 晶体可以自发地分散并形成“单分子层”,可以认为
晶体可以自发地分散并形成“单分子层”,可以认为 作密置单层排列,
作密置单层排列, 填充其中(如图乙),已知
填充其中(如图乙),已知 的半径为
的半径为 ,设阿伏加德罗常数值为NA,每平方米面积上具有该晶体的质量为
,设阿伏加德罗常数值为NA,每平方米面积上具有该晶体的质量为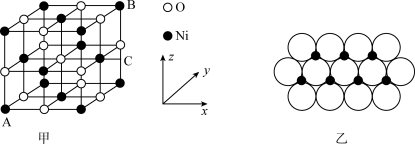
您最近一年使用:0次
2024-04-21更新
|
285次组卷
|
2卷引用:四川省绵阳南山中学2024届高三下学期三诊热身考试理综-化学试题
名校
2 . 固体电解质以其在电池、传感器等装置中的广泛应用而备受关注,大致分为无机物类及高分子类。
(1)固体电解质中研究得最多的是 和O等的导体。
和O等的导体。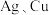 在元素周期表中位于同一族且
在元素周期表中位于同一族且 在
在 的下一周期,具有类似的价层电子排布式,
的下一周期,具有类似的价层电子排布式, 的价层电子排布式为
的价层电子排布式为___________ 。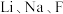 和O的电负性从小到大的顺序为
和O的电负性从小到大的顺序为___________ 。F的第二电离能___________ O的第二电离能(填“>”或“=”或“<”)。
(2) 中阴离子的空间构型为
中阴离子的空间构型为___________ 。
(3)1979年,法国Armand等报道了聚氧化乙烯( )碱金属盐络合物可用作锂离子电池固体聚合物电解质。聚氧化乙烯中O的
)碱金属盐络合物可用作锂离子电池固体聚合物电解质。聚氧化乙烯中O的___________ 杂化轨道与C的 杂化轨道成键;因氢键的形成,聚氧化乙烯是一种水溶性聚合物,若水分子之间形成的氢键可以表示为
杂化轨道成键;因氢键的形成,聚氧化乙烯是一种水溶性聚合物,若水分子之间形成的氢键可以表示为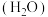
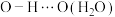 ,请写出使聚氧化乙烯具有水溶性的氢键的表示式
,请写出使聚氧化乙烯具有水溶性的氢键的表示式___________ 。
(4)过渡金属配合物常满足“18电子规则”,即中心原子的价电子数加上配体提供的电子数之和等于18,如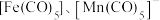 等都满足这个规则。钒配合物
等都满足这个规则。钒配合物 的熔点为
的熔点为 ,其晶体类型为:
,其晶体类型为:___________ ;已知该化合物满足18电子规则,其配体“ ”中的大
”中的大 键可表示为
键可表示为___________ 。(已知苯中的大 键表示为:
键表示为: )
)
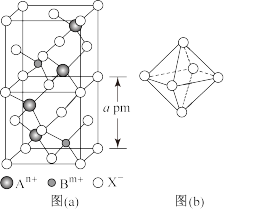
(5)图(a)为一种由阳离子 和阴离子
和阴离子 组成的无机固体电解质的晶胞结构。用A、B、X表示出这种电解质的化学式为
组成的无机固体电解质的晶胞结构。用A、B、X表示出这种电解质的化学式为___________ ,
___________ 。 堆积形成了正八面体和正四面体两种空隙,阳离子占据的空隙类型为
堆积形成了正八面体和正四面体两种空隙,阳离子占据的空隙类型为___________ ,占有率为___________ 。图(b)为 堆积形成的正八面体,其边长为
堆积形成的正八面体,其边长为___________  。(用含a的式子表示)
。(用含a的式子表示)
(1)固体电解质中研究得最多的是
 和O等的导体。
和O等的导体。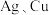 在元素周期表中位于同一族且
在元素周期表中位于同一族且 在
在 的下一周期,具有类似的价层电子排布式,
的下一周期,具有类似的价层电子排布式, 的价层电子排布式为
的价层电子排布式为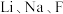 和O的电负性从小到大的顺序为
和O的电负性从小到大的顺序为(2)
 中阴离子的空间构型为
中阴离子的空间构型为(3)1979年,法国Armand等报道了聚氧化乙烯(
 )碱金属盐络合物可用作锂离子电池固体聚合物电解质。聚氧化乙烯中O的
)碱金属盐络合物可用作锂离子电池固体聚合物电解质。聚氧化乙烯中O的 杂化轨道成键;因氢键的形成,聚氧化乙烯是一种水溶性聚合物,若水分子之间形成的氢键可以表示为
杂化轨道成键;因氢键的形成,聚氧化乙烯是一种水溶性聚合物,若水分子之间形成的氢键可以表示为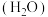
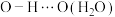 ,请写出使聚氧化乙烯具有水溶性的氢键的表示式
,请写出使聚氧化乙烯具有水溶性的氢键的表示式(4)过渡金属配合物常满足“18电子规则”,即中心原子的价电子数加上配体提供的电子数之和等于18,如
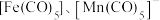 等都满足这个规则。钒配合物
等都满足这个规则。钒配合物 的熔点为
的熔点为 ,其晶体类型为:
,其晶体类型为: ”中的大
”中的大 键可表示为
键可表示为 键表示为:
键表示为: )
)(5)图(a)为一种由阳离子
 和阴离子
和阴离子 组成的无机固体电解质的晶胞结构。用A、B、X表示出这种电解质的化学式为
组成的无机固体电解质的晶胞结构。用A、B、X表示出这种电解质的化学式为
 堆积形成了正八面体和正四面体两种空隙,阳离子占据的空隙类型为
堆积形成了正八面体和正四面体两种空隙,阳离子占据的空隙类型为 堆积形成的正八面体,其边长为
堆积形成的正八面体,其边长为 。(用含a的式子表示)
。(用含a的式子表示)
您最近一年使用:0次
名校
3 . 锂电池的电解液是目前研究的热点。
(1)锂电池的电解液可采用溶有 的碳酸酯类有机溶液。
的碳酸酯类有机溶液。
①基态 的电子云轮廓图的形状为
的电子云轮廓图的形状为_______ 。
②基态P原子的价层电子轨道表示式为_______ 。
(2)为提高锂电池的安全性,科研人员采用离子液体作电解液。某种离子液体的阳离子的结构简式如下,阴离子为 。
。_______ 。
②该阳离子中,带“*”的C原子的杂化轨道类型为_______ 杂化。
③根据VSEPR模型, 的中心原子上的价层电子对数为
的中心原子上的价层电子对数为_______ ,空间结构为正八面体形。
(3) 因其良好的锂离子传输性能可作锂电池的固体电解质,其晶胞结构示意图如图所示,晶胞的边长为
因其良好的锂离子传输性能可作锂电池的固体电解质,其晶胞结构示意图如图所示,晶胞的边长为 。
。_______ (填“ ”或“
”或“ ”)。
”)。
②距离 最近的
最近的 有
有_______ 个。
③已知 的摩尔质量是
的摩尔质量是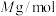 ,阿伏伽德罗常数为
,阿伏伽德罗常数为 。该晶体的密度为
。该晶体的密度为_______  。
。
(1)锂电池的电解液可采用溶有
 的碳酸酯类有机溶液。
的碳酸酯类有机溶液。①基态
 的电子云轮廓图的形状为
的电子云轮廓图的形状为②基态P原子的价层电子轨道表示式为
(2)为提高锂电池的安全性,科研人员采用离子液体作电解液。某种离子液体的阳离子的结构简式如下,阴离子为
 。
。
②该阳离子中,带“*”的C原子的杂化轨道类型为
③根据VSEPR模型,
 的中心原子上的价层电子对数为
的中心原子上的价层电子对数为(3)
 因其良好的锂离子传输性能可作锂电池的固体电解质,其晶胞结构示意图如图所示,晶胞的边长为
因其良好的锂离子传输性能可作锂电池的固体电解质,其晶胞结构示意图如图所示,晶胞的边长为 。
。
 ”或“
”或“ ”)。
”)。②距离
 最近的
最近的 有
有③已知
 的摩尔质量是
的摩尔质量是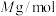 ,阿伏伽德罗常数为
,阿伏伽德罗常数为 。该晶体的密度为
。该晶体的密度为 。
。
您最近一年使用:0次
2024-01-20更新
|
326次组卷
|
3卷引用:2024届四川省绵阳市东辰中学高三下学期模拟考试(一)理科综合试题-高中化学
解题方法
4 . 铁及其化合物在生活、生产中有重要应用。回答下列问题:
(1)乳酸亚铁[CH3CH(OH)COO]2Fe是一种常用的补铁剂。
①Fe2+的价层电子排布式是___________ 。
②乳酸分子(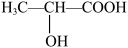 )中 σ 键与π键的数目比为
)中 σ 键与π键的数目比为___________ 。
③乳酸亚铁中各元素的电负性由大到小的顺序为___________ 。
(2)无水FeCl2可与NH3形成[Fe(NH3)6]Cl2。
①[Fe(NH3)6]Cl2中Fe2+的配位数为___________ 。
②NH3的空间构型是___________ ,其中N原子的杂化方式是___________ 。
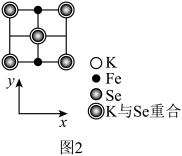
(3)由铁、钾、硒形成的一种超导材料,其晶胞结构如图1所示。
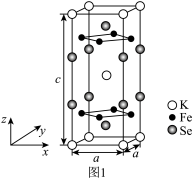
①该超导材料的化学式是___________ 。
②该晶胞参数a=0.4 nm、c=1.4 nm,该晶体密度ρ=___________ g·cm-3。(用 NA表示阿伏加德罗常数,写出计算表达式即可)
③该晶胞在xy平面投影如图2所示,将图2补充完整___________ 。
(1)乳酸亚铁[CH3CH(OH)COO]2Fe是一种常用的补铁剂。
①Fe2+的价层电子排布式是
②乳酸分子(
 )中 σ 键与π键的数目比为
)中 σ 键与π键的数目比为③乳酸亚铁中各元素的电负性由大到小的顺序为
(2)无水FeCl2可与NH3形成[Fe(NH3)6]Cl2。
①[Fe(NH3)6]Cl2中Fe2+的配位数为
②NH3的空间构型是
(3)由铁、钾、硒形成的一种超导材料,其晶胞结构如图1所示。

①该超导材料的化学式是
②该晶胞参数a=0.4 nm、c=1.4 nm,该晶体密度ρ=
③该晶胞在xy平面投影如图2所示,将图2补充完整

您最近一年使用:0次
名校
解题方法
5 . Ⅰ.锂离子电池是近年来的研究热点,常见的锂离子聚合物电池材料有石墨、LiAsF6、LiPF6、 LiMn2O4等。回答下列问题:
(1)As的价电子排布式为___________ ,Mn在周期表中的位置___________ (周期和族),Li、O、P、As四种元素电负性由大到小的顺序为___________ (填元素符号)。
(2)LiPF6的阴离子中心原子的价层电子对数为___________ 。
(3)一种类石墨的聚合物g—C3N4可由三聚氰胺 制得。三聚氰胺分子中氮原子杂化类型有___________ ;三聚氰胺分子能溶于水,主要原因是___________ 。

Ⅱ.四方ZrO2晶胞如图所示。

(4)Zr4+离子在晶胞中的配位数是___________ ,晶胞参数为a pm、a pm、c pm,该晶体密度为___________ g·cm-3。(写出表达式)。在ZrO2中掺杂少量ZnO后形成的催化剂,化学式可表示为ZnxZr1-xOy, 则根据化合价计算y=___________ (用x表达)。
(1)As的价电子排布式为
(2)LiPF6的阴离子中心原子的价层电子对数为
(3)一种类石墨的聚合物g—C3N4可由三聚氰胺 制得。三聚氰胺分子中氮原子杂化类型有

Ⅱ.四方ZrO2晶胞如图所示。

(4)Zr4+离子在晶胞中的配位数是
您最近一年使用:0次
名校
6 . 我国在新材料领域研究的重大突破,为“天宫”空间站的建设提供了坚实的物质基础。“天宫”空间站使用的材料中含有B、C、N、Ni等元素。回答下列问题:
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是_______ (填标号,下同),用光谱仪可捕捉到发射光谱的是_______ 。
A.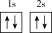 B.
B.
C. D.
D.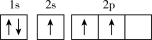
(2)基态N原子的成对电子数与未成对电子数之比为_______ , 离子的空间构型为
离子的空间构型为_______ 。
(3)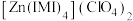 是
是 的一种配合物,IMI的结构为
的一种配合物,IMI的结构为 ,其中碳原子杂化方式为
,其中碳原子杂化方式为_______ ,所含元素电负性由大到小的顺序是_______ 。IMI中大π键可表示为_______ (已知苯中的大π键可表示为 ),该配合物的配位原子为
),该配合物的配位原子为_______ (填序号)。
(4)镍能形成多种配合物,其中 是无色挥发性液体,
是无色挥发性液体, 是红黄色单斜晶体。
是红黄色单斜晶体。 的熔点高于
的熔点高于 的原因是
的原因是_______ 。
(5)红银矿NiAs晶体结构如图所示:

①两个As原子的原子分数坐标依次为( ,
, ,
, )和
)和_______ 。
②已知NA为阿伏加德罗常数的值,X射线光谱测算出的晶胞参数为a=b=m pm、c=n pm,则该晶体的密度为_______  (用含m、n的代数式表示)。
(用含m、n的代数式表示)。
(1)下列不同状态的硼中,失去一个电子需要吸收能量最多的是
A.
 B.
B.
C.
 D.
D.
(2)基态N原子的成对电子数与未成对电子数之比为
 离子的空间构型为
离子的空间构型为(3)
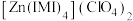 是
是 的一种配合物,IMI的结构为
的一种配合物,IMI的结构为 ,其中碳原子杂化方式为
,其中碳原子杂化方式为 ),该配合物的配位原子为
),该配合物的配位原子为(4)镍能形成多种配合物,其中
 是无色挥发性液体,
是无色挥发性液体, 是红黄色单斜晶体。
是红黄色单斜晶体。 的熔点高于
的熔点高于 的原因是
的原因是(5)红银矿NiAs晶体结构如图所示:

①两个As原子的原子分数坐标依次为(
 ,
, ,
, )和
)和②已知NA为阿伏加德罗常数的值,X射线光谱测算出的晶胞参数为a=b=m pm、c=n pm,则该晶体的密度为
 (用含m、n的代数式表示)。
(用含m、n的代数式表示)。
您最近一年使用:0次
名校
解题方法
7 . A、B、C、D、E、F均是短周期元素,其原子序数依次增大,A和B同周期,A和E同主族,A原子最外层电子数是内层电子数的二倍,B元素族序数是周期数的三倍,B的阴离子与C、D的阳离子电子层结构相同,C与B可生成C2B或C2B2,D的阳离子半径是同周期最小的,F的原子半径是所在周期中最小的。请回答:
(1)E在元素周期表中的位置是_______ 。
(2)C所在周期电负性最强的是_______ ;AB2的结构式是_______ 。
(3)B、C、F的离子半径由大到小的顺序为_______ (用化学式回答,下同);A、D、E元素的最高价氧化物对应水化物中,酸性最强的是_______ 。
(4)B的简单氢化物比H2S沸点高的原因是_______ 。
(5)C与D两元素的最高价氧化物对应水化物反应的离子方程式:_______ 。
(6)用一个离子方程式证明A、E的非金属性强弱:_______ 。
(1)E在元素周期表中的位置是
(2)C所在周期电负性最强的是
(3)B、C、F的离子半径由大到小的顺序为
(4)B的简单氢化物比H2S沸点高的原因是
(5)C与D两元素的最高价氧化物对应水化物反应的离子方程式:
(6)用一个离子方程式证明A、E的非金属性强弱:
您最近一年使用:0次
解题方法
8 . 工业上制备纯碱的原理为:NaCl+CO2+NH3+H2O=NH4Cl+NaHCO3,请回答下列问题:
(1)上述反应体系中出现的几种短周期元素中,第二周期元素电负性由大到小的顺序是_____ 。
(2)反应体系中出现的非金属元素,可形成多种化合物,其中和铵根离子空间构型相同,且属于气态有机物的电子式是_____ ,该分子为_____ (填“极性”或“非极性”)分子;
(3)PH3分子与NH3分子结构相似PH3相对分子质量大于NH3,但NH3沸点高于PH3,其原因是:_____ ;
(4)复兴号高铁车体材质用到Mn、Co等元素。Mn的一种配合物化学式[Mn(CO)5(CH3CN)],
①Mn原子的配位数为_____ ;
②CH3CN中C原子的杂化类型为:_____ ;
③CH3CN中σ键与π键数目之比为:_____ ;
(5)化合物FeF3熔点高于1000°C而Fe(CO)5的熔点却低于0°C,FeF3熔点远高于Fe(CO)5的原因可能是_____ ;
(6)氧元素可分别与Fe和Cu形成低价态氧化物FeO和Cu2O;
①FeO立方晶胞结构如图甲所示,则Fe2+的配位数为_____ ;
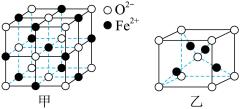
②Cu2O立方晶胞结构如图乙所示,若晶胞参数为apm,则该晶体的密度为_____ g/cm3(用含a、NA的代数式表示,NA代表阿伏加德罗常数的值)。
(1)上述反应体系中出现的几种短周期元素中,第二周期元素电负性由大到小的顺序是
(2)反应体系中出现的非金属元素,可形成多种化合物,其中和铵根离子空间构型相同,且属于气态有机物的电子式是
(3)PH3分子与NH3分子结构相似PH3相对分子质量大于NH3,但NH3沸点高于PH3,其原因是:
(4)复兴号高铁车体材质用到Mn、Co等元素。Mn的一种配合物化学式[Mn(CO)5(CH3CN)],
①Mn原子的配位数为
②CH3CN中C原子的杂化类型为:
③CH3CN中σ键与π键数目之比为:
(5)化合物FeF3熔点高于1000°C而Fe(CO)5的熔点却低于0°C,FeF3熔点远高于Fe(CO)5的原因可能是
(6)氧元素可分别与Fe和Cu形成低价态氧化物FeO和Cu2O;
①FeO立方晶胞结构如图甲所示,则Fe2+的配位数为

②Cu2O立方晶胞结构如图乙所示,若晶胞参数为apm,则该晶体的密度为
您最近一年使用:0次
2023-06-21更新
|
143次组卷
|
2卷引用:四川省绵阳市2023-2024学年高三理科突击班上学期第一次诊断性考试模拟考试理科综合化学试题
名校
解题方法
9 . CuO、Cu2S等含铜化合物可以催化合成HCOOH。回答下列问题:
(1)基态铜原子的价电子排布式为___________ ,其核外电子占据的原子轨道共有___________ 个。
(2)HCOOH中元素电负性从大到小的顺序为___________ ;催化过程中可能产生 ,
, 的空间构型为
的空间构型为___________ ,碳氧键的平均键长 比CH3OH要
比CH3OH要___________ (填“长”或“短”);在有机溶剂中,H2SO4的电离平衡常数Ka1(H2SO4)比H2CO3的电离平衡常数Ka1(H2CO3)大,除S的非金属性比C强外,在分子结构上还存在的原因是___________ 。
(3)已知Cu2S晶胞中S2-的位置如图所示,Cu+位于S2-所构成的正四面体中心。
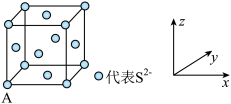
S2-配位数为___________ ;已知图中A处(S2-)的原子分数坐标为(0,0,0),则晶胞中与A距离最近的Cu+的原子分数坐标为___________ ;若晶胞参数anm,晶体的密度为dg·cm-3,则阿伏加德罗常数的值为___________ (用含a和d的式子表示)。
(1)基态铜原子的价电子排布式为
(2)HCOOH中元素电负性从大到小的顺序为
 ,
, 的空间构型为
的空间构型为 比CH3OH要
比CH3OH要(3)已知Cu2S晶胞中S2-的位置如图所示,Cu+位于S2-所构成的正四面体中心。

S2-配位数为
您最近一年使用:0次
2023-04-06更新
|
817次组卷
|
3卷引用:四川省绵阳南山中学2023届高三下学期热身考试理综化学试题
四川省绵阳南山中学2023届高三下学期热身考试理综化学试题四川省自贡市2023届高三下学期第二次诊断性考试理综化学试题(已下线)化学-2023年高考押题预测卷01(全国甲卷)(含考试版、全解全析、参考答案、答题卡)
解题方法
10 . 我国科学家研究发现AgGrS2在室温下具有超离子行为(原子可在晶体中自由移动)。回答下列问题:
(1)基态铬原子的核外电子排布式为___________ , 基态硫原子核外有___________ 种不同运动状态的电子。
(2)与硫元素同族的几种元素中,电负性最大的是___________ ( 填元素符号)。常见含硫的微粒有SO2、SO3、 、
、 、 H2S等,
、 H2S等, 的空间构型为
的空间构型为___________ ; 请写出与H2S互为等电子体的一种微粒的化学式___________ ;SO2、SO3杂化轨道类型相同,但键角SO3大于SO2,原因是___________ 。
(3)Ag+与氨水形成的二氨合银配离子[Ag(NH3)2]+的空间构型是直线型,则其中心原子的杂化类型是_____ ,该配离子中的配位原子是___________ (填元素符号),lmol该配离子中含有的σ键的数目为________ 。
(4)复合材料氧铬酸钙的立方晶胞如图所示。
已知A、B的原子分数坐标分别为(0,0,0)、(1,1,0),则C的原子分数坐标为___________ ,该物质的化学式为___________ ,已 知钙和氧的最近距离为a pm。晶体的密度ρ g·cm-3,则阿伏加德罗常数NA=___________ mol-1( 用含a和ρ的式子表示,列出计算式即可)。
(1)基态铬原子的核外电子排布式为
(2)与硫元素同族的几种元素中,电负性最大的是
 、
、 、 H2S等,
、 H2S等, 的空间构型为
的空间构型为(3)Ag+与氨水形成的二氨合银配离子[Ag(NH3)2]+的空间构型是直线型,则其中心原子的杂化类型是
(4)复合材料氧铬酸钙的立方晶胞如图所示。

已知A、B的原子分数坐标分别为(0,0,0)、(1,1,0),则C的原子分数坐标为
您最近一年使用:0次
2022-05-30更新
|
1287次组卷
|
2卷引用:四川省绵阳市2023届高三零诊模拟检测试题理科综合化学试题



