解题方法
1 . “无机”碳化学的一个重要领域是含有C—N键的化合物,其中重要的化合物有氰 、氰化氢、氰化物、氰酸盐等。回答下列问题:
、氰化氢、氰化物、氰酸盐等。回答下列问题:
(1)基态 的价层电子轨道表示式为
的价层电子轨道表示式为_______ 。
(2) 与卤素性质相似,与
与卤素性质相似,与 反应生成HCN和HOCN,反应中所含元素的电负性由大到小的顺序为
反应生成HCN和HOCN,反应中所含元素的电负性由大到小的顺序为_______ , 中C原子的杂化方式为
中C原子的杂化方式为_______ 。
(3)科学家研究发现,在低温下,HCN可结晶成晶体,在晶体中HCN分子排列可形成 的无限长链,其原因是
的无限长链,其原因是_______ ;写出 分子的链状结构
分子的链状结构_______ 。
(4)将氰化物与氟化物或氯化物一起反应,即可得FCN和ClCN,它们的沸点数据如下表所示:
ClCN的沸点比FCN的沸点高原因是_______ 。
(5)氰酸根离子可与大多数金属阳离子形成氰化物,几种金属氰化物的晶胞转化关系如图一所示,从普鲁士蓝晶胞中切出 的结构,如图二所示。
的结构,如图二所示。

①下列说法正确的是_______ (填标号)。
A.每个普鲁士蓝晶胞中含6个 键
键
B.普鲁士白的化学式为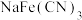
C.格林绿晶体中 周围等距且最近的
周围等距且最近的 数目为12
数目为12
②已知普鲁士白晶胞的晶胞参数均为a pm,设 为阿伏加德罗常数的值,则普鲁士白晶体密度为
为阿伏加德罗常数的值,则普鲁士白晶体密度为_______  (用含
(用含 、
、 、
、 计算式表示)。
计算式表示)。
 、氰化氢、氰化物、氰酸盐等。回答下列问题:
、氰化氢、氰化物、氰酸盐等。回答下列问题:(1)基态
 的价层电子轨道表示式为
的价层电子轨道表示式为(2)
 与卤素性质相似,与
与卤素性质相似,与 反应生成HCN和HOCN,反应中所含元素的电负性由大到小的顺序为
反应生成HCN和HOCN,反应中所含元素的电负性由大到小的顺序为 中C原子的杂化方式为
中C原子的杂化方式为(3)科学家研究发现,在低温下,HCN可结晶成晶体,在晶体中HCN分子排列可形成
 的无限长链,其原因是
的无限长链,其原因是 分子的链状结构
分子的链状结构(4)将氰化物与氟化物或氯化物一起反应,即可得FCN和ClCN,它们的沸点数据如下表所示:
| FCN | ClCN | |
| 沸点/K | 227 | 286 |
(5)氰酸根离子可与大多数金属阳离子形成氰化物,几种金属氰化物的晶胞转化关系如图一所示,从普鲁士蓝晶胞中切出
 的结构,如图二所示。
的结构,如图二所示。
①下列说法正确的是
A.每个普鲁士蓝晶胞中含6个
 键
键B.普鲁士白的化学式为
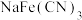
C.格林绿晶体中
 周围等距且最近的
周围等距且最近的 数目为12
数目为12②已知普鲁士白晶胞的晶胞参数均为a pm,设
 为阿伏加德罗常数的值,则普鲁士白晶体密度为
为阿伏加德罗常数的值,则普鲁士白晶体密度为 (用含
(用含 、
、 、
、 计算式表示)。
计算式表示)。
您最近一年使用:0次
2 . 超分子在生命科学和物理学等领域中具有重要意义。由Fe将2个C60分子、2个p—甲酸丁酯吡啶及2个CO分子自组装的超分子结构如图所示。
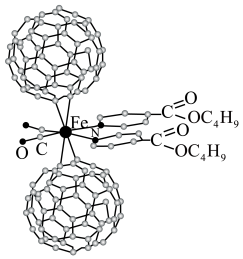
回答下列问题:
(1)基态Fe原子的核外有____ 种不同空间运动状态的电子。
(2)该超分子含有的第二周期元素中,电负性由大到小的顺序是____ 。
(3)该超分子中含有的微粒间作用力有____ (填标号)。
(4)p—甲酸丁酯吡啶配体中C原子的杂化方式是____ (吡啶可看作苯分子中的一个CH原子团被N取代的化合物)。
(5)已知:C60中存在碳碳单、双键,C60中每个碳原子只跟相邻的3个碳原子形成化学键,C60分子只含有五边形和六边形;多面体的顶点数V、面数F及棱边数E遵循欧拉定理:V+F-E=2。
①一个C60分子中,五边形的数目有____ 个、碳碳双键的数目有____ 个。
②固体C60与金刚石相比较,熔点较高的是____ ,理由是____ 。
(6)铁的一种立方晶系晶体结构中,每个晶胞平均含有2个Fe,Fe原子坐标是(0,0,0)和( ,
, ,
, )。根据以上信息,推断该晶体的原子堆积方式是
)。根据以上信息,推断该晶体的原子堆积方式是____ 。已知该晶体中距离最近的Fe原子核之间的距离为apm,阿伏加德罗常数是NA,则晶体的密度为____ g·cm-3。

回答下列问题:
(1)基态Fe原子的核外有
(2)该超分子含有的第二周期元素中,电负性由大到小的顺序是
(3)该超分子中含有的微粒间作用力有
| A.共价键 | B.氢键 | C.金属键 | D.配位键 |
(5)已知:C60中存在碳碳单、双键,C60中每个碳原子只跟相邻的3个碳原子形成化学键,C60分子只含有五边形和六边形;多面体的顶点数V、面数F及棱边数E遵循欧拉定理:V+F-E=2。
①一个C60分子中,五边形的数目有
②固体C60与金刚石相比较,熔点较高的是
(6)铁的一种立方晶系晶体结构中,每个晶胞平均含有2个Fe,Fe原子坐标是(0,0,0)和(
 ,
, ,
, )。根据以上信息,推断该晶体的原子堆积方式是
)。根据以上信息,推断该晶体的原子堆积方式是
您最近一年使用:0次
3 . C、S、Cr、Cu及其化合物在化工、材料等方面应用十分广泛。回答下列问题:
(1)二甲基亚砜(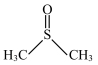 )所含元素的电负性由大到小的顺序为
)所含元素的电负性由大到小的顺序为_______ 。所含碳原子和硫原子的杂化类型分别为_______ 、_______ 。
(2)25℃时,顺-丁烯二酸( )和反-丁烯二酸(
)和反-丁烯二酸(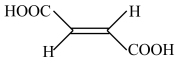 )的电离平衡常数如下表。
)的电离平衡常数如下表。
结合氢键,分析顺-丁烯二酸的K1明显大于反-丁烯二酸的原因是_______ 。
(3)元素Cr位于元素周期表中_______ 区,其基态原子次外层电子数目为_______ 个,其基态原子价层电子的空间运动状态有_______ 种。
(4)某晶体晶胞结构如图所示,其中Cu均匀分散在立方体内,NA为阿伏加德罗常数的值。

①该化合物中铜粒子的价电子排布式为_______ ,a、b氧粒子的坐标参数依次为(0,0,0)、( ,
, ,
, ),则d点粒子的坐标参数为
),则d点粒子的坐标参数为_______ 。
②若a、b间的距离=xcm,计算该晶胞的密度_______ g/cm3(写表达式)。
(1)二甲基亚砜(
 )所含元素的电负性由大到小的顺序为
)所含元素的电负性由大到小的顺序为(2)25℃时,顺-丁烯二酸(
 )和反-丁烯二酸(
)和反-丁烯二酸( )的电离平衡常数如下表。
)的电离平衡常数如下表。| 物质 | 电离平衡常数 | |
| 顺-丁烯二酸 | K1=1.17×10-2 | K2=2.6×10-7 |
| 反-丁烯二酸 | K1=9.3×10-4 | K2=2.9×10-5 |
(3)元素Cr位于元素周期表中
(4)某晶体晶胞结构如图所示,其中Cu均匀分散在立方体内,NA为阿伏加德罗常数的值。

①该化合物中铜粒子的价电子排布式为
 ,
, ,
, ),则d点粒子的坐标参数为
),则d点粒子的坐标参数为②若a、b间的距离=xcm,计算该晶胞的密度
您最近一年使用:0次



