名校
解题方法
1 . 铜、铁及其化合物在科学研究和工农业生产中有许多用途。回答下列问题:
(1)某氨基吡啶衍生物铜配合物X的结构简式如下图所示。
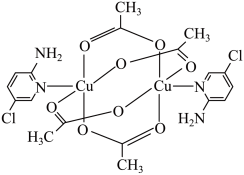
①基态氮原子的价层电子排布图为___________ ,在元素周期表中铜属于___________ (填“s”、“p”、“d”或“ds”)区。
②C.N、O元素原子的第一电离能由大到小的顺序为___________ 。
③X中 的配位数是
的配位数是___________ ,C原子的杂化轨道类型为___________ 。
(2)胆矾的简单平面结构式如图所示。
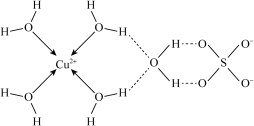
胆矾的化学式用配合物的形式可表示为___________ ;其阴离子的立体构型为___________ 。
(3)铁与硫能形成多种化合物,某种化合物的晶胞结构如下图所示。该化合物的化学式是___________ ;若该晶胞边长为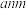 ,
, 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为___________  。
。

(1)某氨基吡啶衍生物铜配合物X的结构简式如下图所示。

①基态氮原子的价层电子排布图为
②C.N、O元素原子的第一电离能由大到小的顺序为
③X中
 的配位数是
的配位数是(2)胆矾的简单平面结构式如图所示。

胆矾的化学式用配合物的形式可表示为
(3)铁与硫能形成多种化合物,某种化合物的晶胞结构如下图所示。该化合物的化学式是
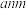 ,
, 为阿伏加德罗常数的值,则该晶体的密度为
为阿伏加德罗常数的值,则该晶体的密度为 。
。
您最近一年使用:0次
2023-12-19更新
|
248次组卷
|
2卷引用:四川省遂宁市射洪市四川省射洪中学校2023-2024学年高三下学期开学理综试题-高中化学
名校
解题方法
2 . 铁及其化合物在生活、生产中有重要应用。回答下列问题:
(1)乳酸亚铁[CH3CH(OH)COO]2Fe是一种常用的补铁剂。
①Fe2+的价层电子排布式是___________ 。
②乳酸分子(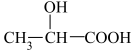 )中σ键与π键的数目比为
)中σ键与π键的数目比为___________ 。
③乳酸亚铁中各元素的电负性由大到小的顺序为___________ 。
④C与O中,第一电离能较大的是___________ ,O的第二电离能远大于第一电离能的原因是___________ 。
(2)无水FeCl2可与NH3形成[Fe(NH3)6]Cl2。
①[Fe(NH3)6]Cl2中Fe2+的配位数为___________ 。
②NH3的空间构型是___________ ,其中N原子的杂化方式是___________ 。
(3)由铁、钾、硒形成的一种超导材料,其晶胞结构如图所示。
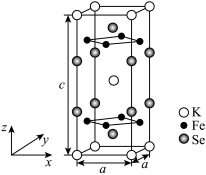
①该超导材料的化学式是___________ 。
②该晶胞参数a=0.4nm、c=1.4nm,该晶体密度ρ=___________ g·cm-3(用NA表示阿伏加德罗常数,写出计算表达式即可)。
(1)乳酸亚铁[CH3CH(OH)COO]2Fe是一种常用的补铁剂。
①Fe2+的价层电子排布式是
②乳酸分子(
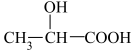 )中σ键与π键的数目比为
)中σ键与π键的数目比为③乳酸亚铁中各元素的电负性由大到小的顺序为
④C与O中,第一电离能较大的是
(2)无水FeCl2可与NH3形成[Fe(NH3)6]Cl2。
①[Fe(NH3)6]Cl2中Fe2+的配位数为
②NH3的空间构型是
(3)由铁、钾、硒形成的一种超导材料,其晶胞结构如图所示。

①该超导材料的化学式是
②该晶胞参数a=0.4nm、c=1.4nm,该晶体密度ρ=
您最近一年使用:0次
名校
解题方法
3 . 硼、碳、氮、磷、硫等元素形成的单质和化合物在生活、生产中有重要的用途。
(1)下列氮原子的电子排布图表示的状态中,能量由低到高的顺序是___________ (填字母)。
A. B.
B.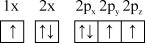
C.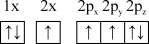 D.
D.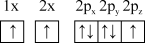
(2)氢、硼、碳、硫四元素的电负性由大到小的顺序为___________
(3)(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子的最外层均满足8电子稳定结构,其结构式为___________ 。其σ键分别为___________ 型σ键。
(4)直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,其结构如图所示。则由n个磷氧四面体形成的这类磷酸根离子的通式为___________

(5)碳酸盐中的阳离子不同,热分解温度就不同。下表为四种碳酸盐的热分解温度和对应金属阳离子的半径。随着金属阳离子半径的增大,碳酸盐的热分解温度逐渐升高,原因是___________
(6)氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性 (晶体结构如图)。
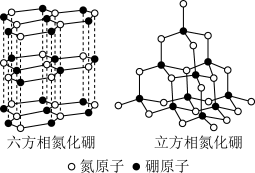
①关于这两种晶体的说法,不正确的是___________ (填字母)。
a.两种晶体均为分子晶体
b.两种晶体中的B﹣N键均为共价键
c.六方相氮化硼层间作用力小,所以质地软
d.立方相氮化硼含有σ键和π键,所以硬度大
②六方相氮化硼晶体其结构与石墨相似却不导电,原因是___________
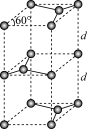
(7)石墨的晶胞结构如图所示。已知石墨的密度为ρg·cm-3,C-C键的键长为r cm,NA为阿伏加德罗常数的值,则石墨晶体的层间距d=___________ cm。
(1)下列氮原子的电子排布图表示的状态中,能量由低到高的顺序是
A.
 B.
B.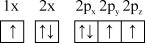
C.
 D.
D.
(2)氢、硼、碳、硫四元素的电负性由大到小的顺序为
(3)(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子的最外层均满足8电子稳定结构,其结构式为
(4)直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,其结构如图所示。则由n个磷氧四面体形成的这类磷酸根离子的通式为

(5)碳酸盐中的阳离子不同,热分解温度就不同。下表为四种碳酸盐的热分解温度和对应金属阳离子的半径。随着金属阳离子半径的增大,碳酸盐的热分解温度逐渐升高,原因是
| 碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
| 热分解温度/℃ | 402 | 900 | 1172 | 1360 |
| 金属阳离子半径/pm | 66 | 99 | 112 | 135 |

①关于这两种晶体的说法,不正确的是
a.两种晶体均为分子晶体
b.两种晶体中的B﹣N键均为共价键
c.六方相氮化硼层间作用力小,所以质地软
d.立方相氮化硼含有σ键和π键,所以硬度大
②六方相氮化硼晶体其结构与石墨相似却不导电,原因是
(7)石墨的晶胞结构如图所示。已知石墨的密度为ρg·cm-3,C-C键的键长为r cm,NA为阿伏加德罗常数的值,则石墨晶体的层间距d=

您最近一年使用:0次
2021-05-24更新
|
321次组卷
|
2卷引用:四川省射洪市2021届高考考前模拟测试理综化学试题
名校
解题方法
4 . 科学家预测21 世纪中叶将进入“氢能经济”时代,许多化合物或合金都是具有广阔应用前景的储氢材料。回答下列问题:
(1)基态Li原子核外电子有___ 种不同的运动状态,占据最高能层电子的电子云轮廓图形状为____________ 。
(2)Li的焰色反应为紫红色,很多金属元素能产生焰色反应的原因为___________________ 。
(3)亚氨基锂(Li2NH) 中所含的元素,电负性由大到小排列的顺序是_________ 。
(4)咔唑(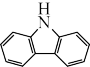 )的沸点比芴(
)的沸点比芴( 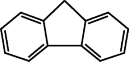 )高的主要原因是
)高的主要原因是___________________ 。
(5)NH3BH3(氨硼烷,熔点104℃)与______ (写出一种分子)互为等电子体。可通过红外光谱测定该分子的立体构型,NH3BH3中B的杂化轨道类型为____________ 。
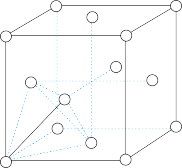
(6)一种储氢合金的晶胞结构如图所示。在晶胞中Cu 原子处于面心,Au 原子处于顶点位置。该晶体中,原子之间的作用力是___________ 。实现储氢功能时,氢原子可进入到由Cu 原子与Au 原子构成的四面体空隙中心(如图),若所有四面体空隙都填满,该晶体储氢后的化学式为__________ 。已知该晶胞的晶胞参数为a nm,阿伏加 德罗常数值为NA,则密度ρ为__________ g/cm3(用NA和a的代数式表示)
(1)基态Li原子核外电子有
(2)Li的焰色反应为紫红色,很多金属元素能产生焰色反应的原因为
(3)亚氨基锂(Li2NH) 中所含的元素,电负性由大到小排列的顺序是
(4)咔唑(
 )的沸点比芴(
)的沸点比芴(  )高的主要原因是
)高的主要原因是(5)NH3BH3(氨硼烷,熔点104℃)与
(6)一种储氢合金的晶胞结构如图所示。在晶胞中Cu 原子处于面心,Au 原子处于顶点位置。该晶体中,原子之间的作用力是

您最近一年使用:0次



